CRISPR/Cas9技术介导烟草CENH3基因突变体的获得
韩平安 ,孙瑞芬 ,常 悦 ,唐宽刚 ,王 良 ,聂利珍 ,张自强 ,梁亚晖 ,吴新荣 ,李晓东
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.内蒙古自治区甜菜品种遗传改良与种质创制重点实验室,内蒙古 呼和浩特 010031)
CENH3是组蛋白H3的一个变体,其特异性定位于着丝粒上[1],可募集其他着丝粒蛋白并与之形成复合体,在有丝分裂和减数分裂时参与着丝粒的组装并和纺锤丝连接,对染色体的正常分离与传递有决定作用[2-4]。编码着丝粒特异性组蛋白基因CENH3是近年来利用诱导系诱导单倍体的一个研究热点[5]。RAVI等[6]通过对拟南芥染色体着丝粒的突变体研究,开发出了通过着丝粒介导使父本或母本染色体选择性丢失,从而获得单倍体的方法。拟南芥CENH3突变体具有致死性,利用组蛋白H3的N末端尾部替换CENH3的N末端尾部,同时将绿色荧光蛋白(GFP)添加到N端终点,形成的GFPtailswap蛋白,定位于着丝粒上,该结构克服了CENH3突变体的致死表型。利用转基因技术获得GFPtailswap Cenh3-/-基因型植株,该植株雄性不育但是能够产生少量花粉,作为父本与野生型进行杂交能够产生5%的母本单倍体,作为母本与野生型进行杂交能够产生25%~50%的父本单倍体[7]。CENH3在不同物种都具有高度进化保守性,对CENH3基因进行修饰获得单倍体诱导系同样适用于其他作物[8-11]。CRISPR/Cas9技术是一种有效的基因组编辑工具[12-16],可以直接改良农艺性状控制基因,具有精准高效、构建简单、操作简便、成本低廉等特点,现已成功应用于模式植物拟南芥、烟草以及水稻、小麦、玉米、大豆、高粱等作物[17-21]。CRISPR/Cas9基因编辑技术的发展和应用为不同作物沉默着丝粒特异性组蛋白CENH3创造单倍体诱导系提供了可能。对玉米CENH3进行遗传修饰,成功获得单倍体,证明了CENH3-tailswap互补系统可以在玉米上作为单倍体诱导系[22-23]。通过筛选被基因组编辑的TaCENH3α-异等位基因组合,获得了可用于小麦商业化的父系单倍体诱导系,诱导率达7%[24]。对拟南芥CENH3进行点突变可以获得单倍体诱导系[7]。本研究以烟草CENH3基因为编辑目标,构建CRISPR/Cas9编辑载体,并通过农杆菌介导法进行烟草遗传转化获得CENH3突变株系,从而为采用CRISPR/Cas9-CENH3技术体系创建甜菜等作物的单倍体诱导系奠定了基础。
1 材料和方法
1.1 试验材料
本氏烟草(Nicotiana benthamiana)无菌苗、载体pBWA(V)K和 pBWA(V)-Cas9、EHA105农杆菌菌株由内蒙古自治区农牧业科学院甜菜分子育种课题组保存。试验所用试剂(盒)为TaKaRa产品。6 000 bp DNA marker、T4连接酶、限制性内切酶Eco31Ⅰ、LguⅠ、EcoRⅤ等均购自武汉伯远生物科技有限公司,大肠杆菌感受态细胞DH5α购自天根生化科技(北京)有限公司;农杆菌感受态细胞EHA105购自北京华越洋生物有限公司,其他常规试剂主要购自TaKaRa公司。引物由南京金斯瑞公司合成,其序列见表1。
1.2 CENH3基因靶位点序列的设计及载体构建
1.2.1 CENH3基因靶标序列
根据烟草 CENH3基因(LOC107795199)cDNA保守序列设计2个靶标以提高编辑效率,靶标1序列:agagcactgagctgttgatcagg,靶标 2序列:gcttgttcgtgaaattgcacagg。扩增含2个靶标序列的sgRNA引物(1F/1R和2F/2R,并引入Eco31Ⅰ酶切位点),序列见表1。

表1 引物信息
1.2.2 sgRNA1和sgRNA2获得
靶标序列较短,故通过引物变性退火就可以得到目的序列。sgRNA1 反应体系(50 μL):ddH2O 40 μL,引物 1F 5 μL,引物 1R 5 μL。反应条件:95 ℃ 10 min,55℃10 min,14℃5 min,同样方法获得sgRNA2片段。
1.2.3 CENH3靶标中间载体构建
1.2.3.1 pBWA(V)-Cas9/CENH3-B1 构建
用Eco31Ⅰ分别酶切目的片段sgRNA1和空载体pBWA(V)-Cas9(细菌抗性为卡纳霉素,植物抗性为潮霉素)并用T4连接酶连接酶切片段。酶切连接反应体系(10.0 μL):10×buffer 1.0 μL,空载体 1.5 μL,sgRNA1 片段 2.0 μL,Eco31 Ⅰ 0.5 μL,T4-ligase 0.5 μL,ddH2O 4.5 μL。混匀后,37 ℃反应2 h。取5 μL连接物转化大肠杆菌感受态细胞DH5α,37℃培养16 h后获得白色单菌落,抽提质粒,测序检测目的片段,重组载体命名为pBWA(V)-CAS9/CENH3-B1。
1.2.3.2 pBWD/CENH3-B2构建
用Eco31Ⅰ分别酶切目的片段sgRNA2和空载体pBWD(LB)DNAi(AT),并用T4连接酶连接酶切片段。酶切连接反应体系(10.0 μL):10×buffer 1.0 μL,空载体 1.5 μL,sgRNA2 片段 2.0 μL,Eco31 Ⅰ0.5 μL,T4-ligase 0.5 μL,ddH2O 4.5 μL。反应条件和转化大肠杆菌同1.2.3.1,测序合格后,重组载体命名为pBWD-CENH3-B2。
1.2.4 双靶标载体CRISPR-Cas9/CENH3构建
用LguⅠ酶切2个中间载体pBWA(V)-Cas9/CENH3-B1和pBWD/CENH3-B2,并用T4连接酶进行连接。酶切连接反应体系(10.0 μL):10×T4 buffer 1.0 μL,pBWA(V)-Cas9/CENH3-B1 1.0 μL,pBWD/CENH3-B2 1.5 μL,Lgu I 0.5 μL,T4-ligase 0.5 μL,ddH2O 5.5 μL。均匀后,37℃反应 2 h。将 pBWD/CENH3-B2的酶切目的片段插入pBWA(V)-Cas9/CENH3-B1,获得含有双靶标的重组载体命名为CRISPR-Cas9/CENH3。将双靶标重组载体CRISPRCas9/CENH3转化到农杆菌EHA105中,用引物3F和3R进行菌落PCR扩增载体上的M13片段以检测重组质粒。提取1个PCR检测阳性质粒,用EcoRⅤ酶切进一步进行酶切鉴定。
1.3 烟草的遗传转化及转基因植株PCR检测
用含有编辑载体CRISPR-Cas9/CENH3的农杆菌EHA105转化烟草无菌苗叶片并诱导丛生芽产生,经Zmpl筛选获得抗性植株。提取抗性植株幼叶DNA,并以此为模板,用引物4F和4R扩增Cas9基因片段以检测阳性植株。PCR反应体系:2×PCR Mix 6.25 μL,4F/4R 引物各 0.50 μL,模板 DNA(50 ng/μL)1.00 μL,ddH2O 4.25 μL;反应程序:94 ℃3 min;94 ℃ 1 min,62 ℃ 1 min,72 ℃ 1 min,30 个循环;72℃ 10 min,4℃保存。
1.4 目的基因拷贝数检测
利用数字PCR(ddPCR)技术,检测转基因植株中CENH3基因的拷贝数。首先对CENH3基因的扩增引物5F/5R(表1)和内参基因RNR2(拷贝数为1)的扩增引物6F/6R(表1)的特异性进行检测。之后用特异引物5F和5R对PCR检测阳性植株进行CENH3基因插入拷贝数检测。ddPCR扩增体系(25.0 μL):2×PerfeCTa Qpcr ToughMix UNG 5.0 μL,AlexaFluorTM6471.0 μL,EvaGreen20×inwater2.0 μL,上、下游引物各 0.4 μL,模板 2.0 μL,ddH2O 14.2 μL。数字 PCR扩增程序为94℃ 5 min;95℃ 30 s,60℃30 s,72 ℃ 30 s,40 个循环;72 ℃ 5 min。每个样品进行3个平行重复试验。外源基因拷贝数=外源基因浓度/内参基因浓度。
2 结果与分析
2.1 CENH3基因编辑载体构建
提取2个中间载体pBWA(V)-Cas9/CENH3-B1和pBWD/CENH3-B2质粒DNA,通过测序证实目的片段已正确插入。2个中间载体通过LguⅠ酶切并用T4连接酶后,获得的双靶标编辑载体CRISPRCas9/CENH3经PCR检测M13片段,获得条带大小为857 bp(图1a),符合预期。提取1个PCR检测阳性质粒进一步进行EcoRⅤ酶切鉴定,获得5条大小正确的条带,分别为 7 023、3 570、2 625、2 200、279 bp(图1b),表明双靶标编辑载体CRISPR-Cas9/CENH3构建成功。

图1 CRISPR-Cas9/CENH3的PCR检测(a)和酶切鉴定(b)
2.2 转基因植株获得及PCR检测
用含有编辑载体CRISPR-Cas9/CENH3的农杆菌转化烟草获得Zmpl抗性植株,随机提取11株抗性植株叶片基因组DNA进行Cas9基因的PCR检测,扩增片段大小均为577 bp,符合预期(图2),初步判断目的基因已整合到烟草基因组染色体上。
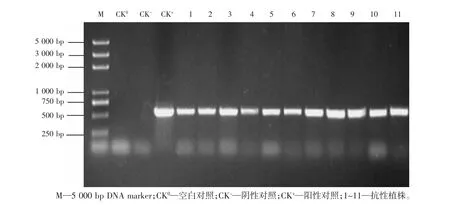
图2 转基因植株PCR检测
2.3 CENH3突变体检测
为了验证靶标序列是否发生突变,对转基因烟草T0代植株和野生型CENH3基因靶序列进行扩增并测序分析。测序结果表明,11株转基因植株中有6株为编辑植株(表2),编辑效率为54.5%。进一步分析表明,靶标1未发生突变,靶标2序列上发生4种突变类型,分别为单碱基插入纯合突变(两条染色体均插入1个碱基“T”,如1号和5号株系),一条染色体单碱基插入杂合突变(插入1个碱基“A”,如2号株系),单碱基插入杂合突变(其中一条染色体插入1个碱基“T”,另一条染色体插入1个碱基“C”,如4号株系),单碱基插入和多碱基缺失的杂合突变(其中一条染色体插入1个碱基“T”,另一条染色体缺失6个碱基“CAATTT”,如3号和6号株系)。
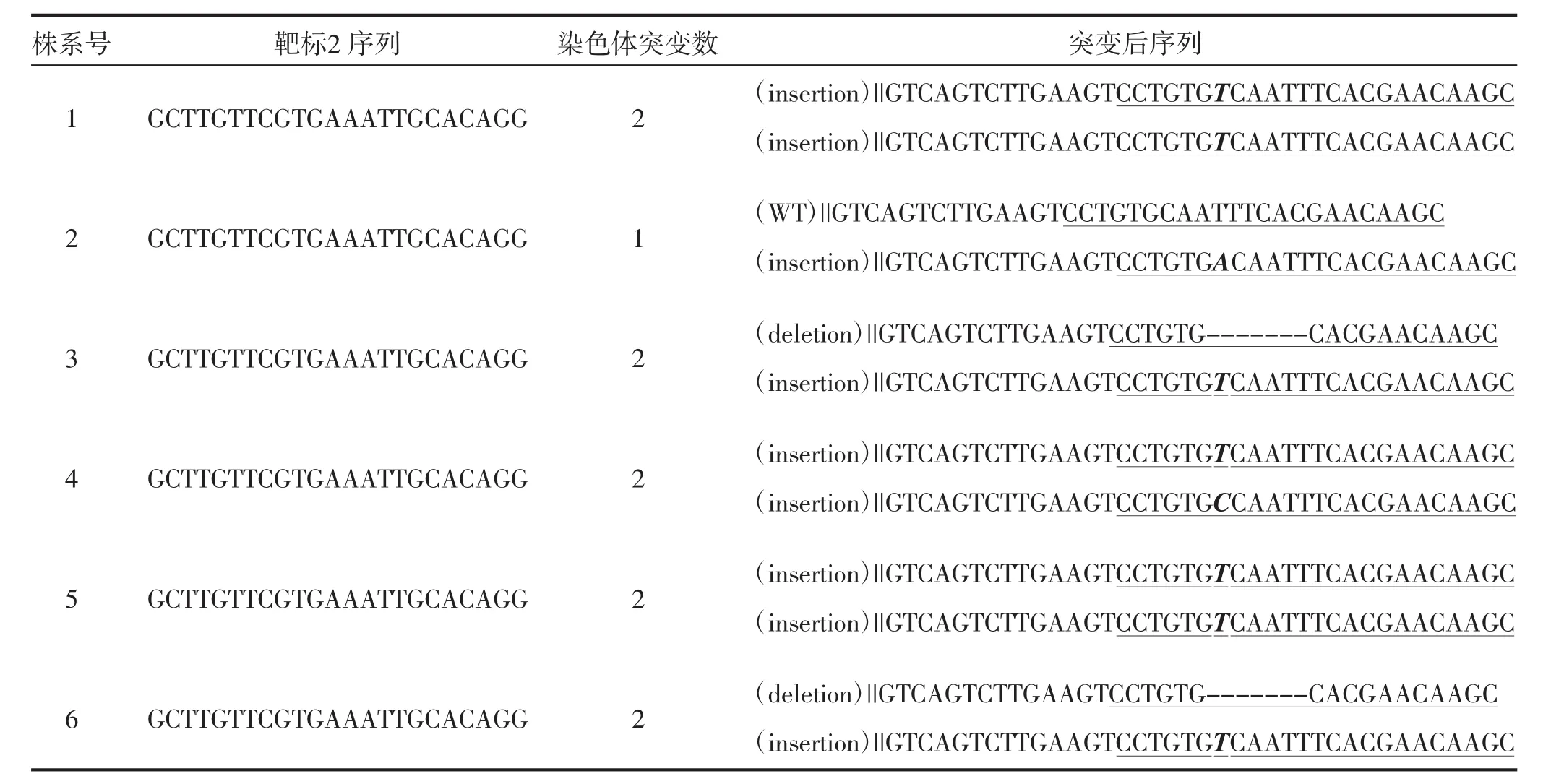
表2 转基因株系突变类型
2.4 目的基因拷贝数检测
利用ddPCR技术对6株突变体进行插入拷贝数检测。首先以烟草RNR2为内参基因,对目的基因CENH3的扩增引物(5F/5R)的特异性进行检测。由图3可知,2个基因对应引物的阳性微滴(蓝色带)与阴性微滴(黑色带)都能明显区分,表明CENH3引物的特异性较好。其次,对ddPCR的重复性进行分析,所有样品CENH3和RNR2基因的试验有效微滴总数平均为24 050~27 924(表3),满足微滴数字PCR微滴的分析要求,试验中生成微滴的相对标准偏差(relative standard deviation,RSD)为1.8%~3.6%(表3),小于25%,符合欧盟核酸定量检测的要求,说明试验中建立的微滴数字PCR体系微滴生成稳定,重复性良好,数据可靠性高。对6株突变体进行拷贝数分析,结果表明,所有突变体均为低拷贝转基因植株,CENH3基因的插入拷贝数均在 0.3~1.2(表 4)。
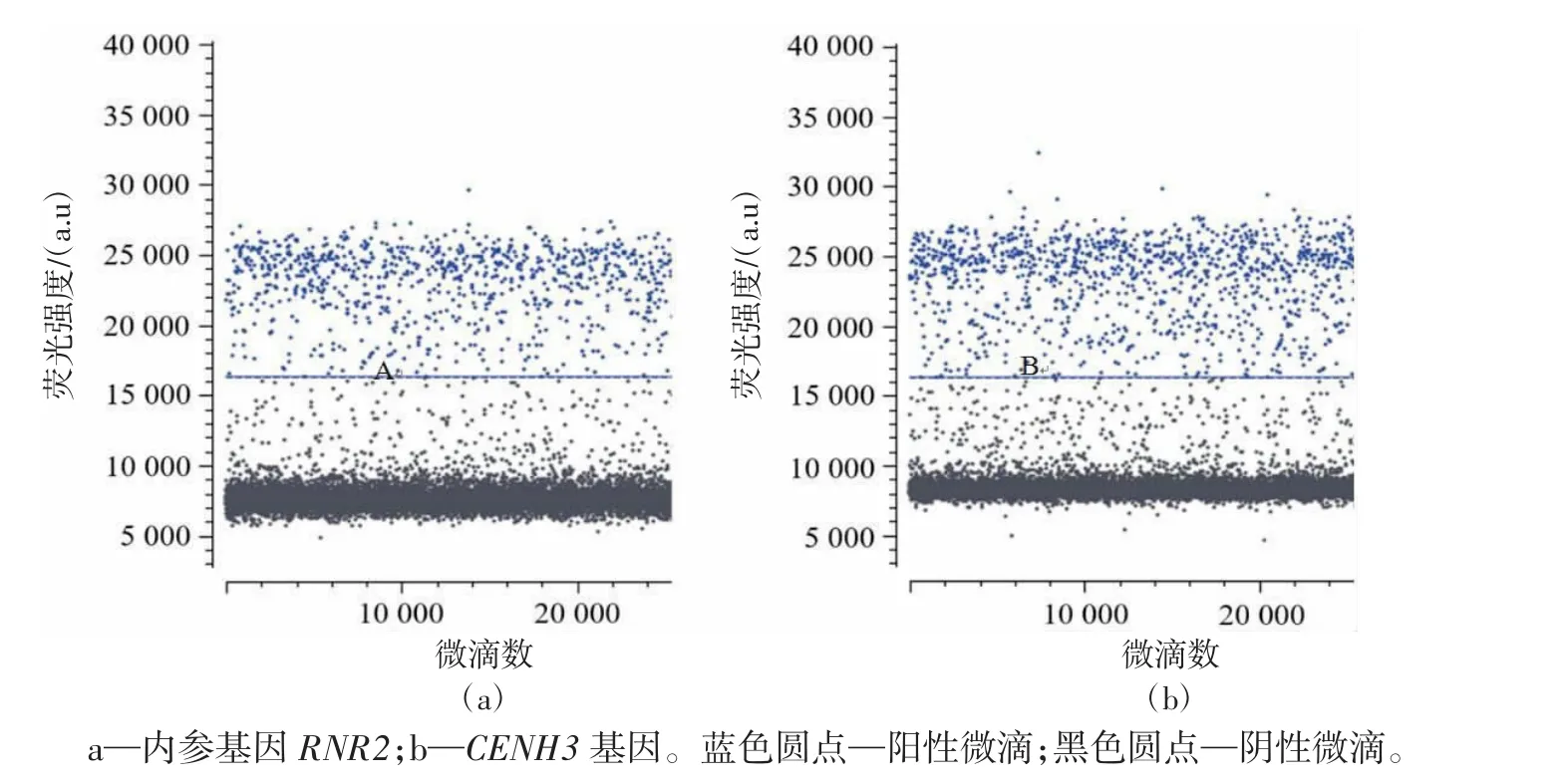
图3 ddPCR引物特异性检测
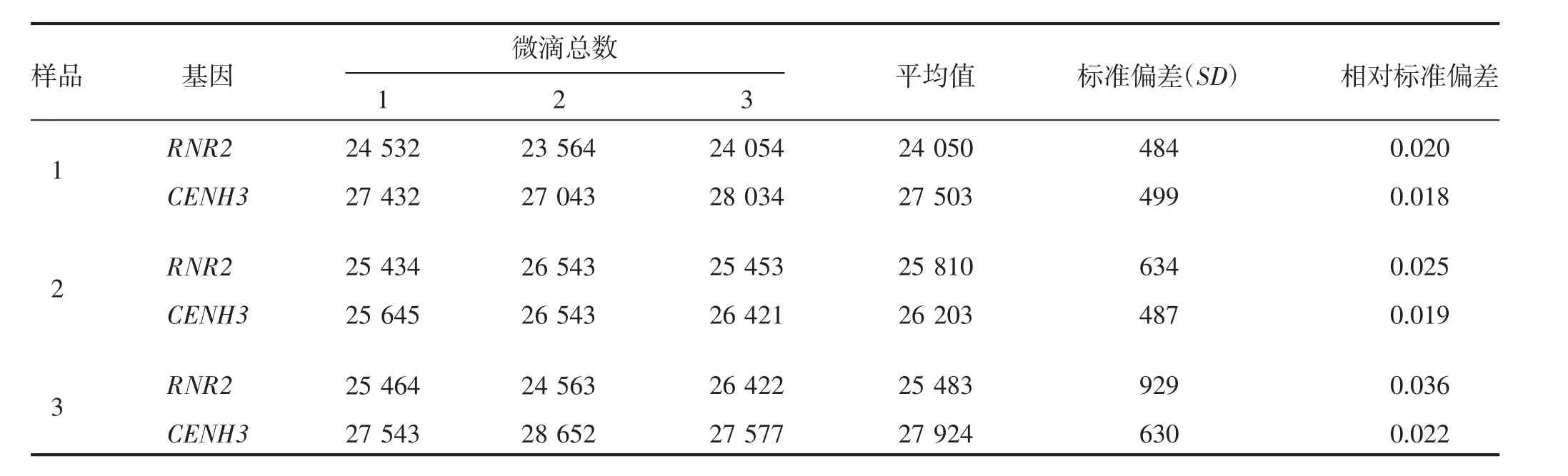
表3 引物ddPCR重复性检测

表4 转基因株系CENH3基因拷贝数检测
3 讨论和结论
基因编辑是探究基因功能的重要技术之一,通过对目的基因的定点敲除、添加或修饰探究特定基因的功能[25]。CRISPR/Cas9技术是目前主流基因编辑技术,因其具有载体构建简单易行、特异性好、打靶效率高等特点,该系统已被广泛应用于作物改良育种[26]。
获得单倍体的方法有很多,如体外诱导(雄配子体诱导和雌配子体诱导)、种间或种内的选择性杂交、对着丝粒特异性组蛋白编码基因CENH3进行基因组编辑(CRISPR/Cas9)等均用于诱导单倍体的产生[27]。单倍体育种利用染色体加倍产生完全纯合的双单倍体,相比传统育种是一种高效快速的植物育种方法[28-29]。利用CRISPR/Cas9系统直接修饰CENH3 在拟南芥[6]、玉米[30-31]和小麦[24]、甘蓝[32]等植物上均获得了单倍体植株。研究表明,拟南芥CENH3无效突变体具有致死性,将经过遗传修饰的CENH3导入该拟南芥突变体,可恢复植株的野生表型,转基因植株与野生型植株杂交可产生只含野生型基因组的单倍体[6]。
本研究以烟草CENH3为编辑目标,利用CRISPR/Cas9技术对CENH3进行定点编辑获得了编辑植株,编辑效率为54.5%。从编辑效率来看,本研究设计的靶标及构建的编辑载体是合理有效的,实现了对烟草CENH3的定点编辑,为利用CRISPR/Cas9编辑系统进行甜菜CENH3基因编辑,为获得甜菜单倍体诱导系奠定了基础。

