人参皂苷Rg1对顺铂损伤大鼠卵巢颗粒细胞的保护作用及其分子机制
颜倩,石丹宁,杨佳迪,何悦双,赵丕文(北京中医药大学 生命科学学院,北京 102488)
近年来,由于环境污染及生活、工作压力的日益增加,卵巢早衰(premature ovarian failure,POF)及其导致的生殖功能障碍发生率明显上升,引起了大家的普遍关注[1]。POF 是指在女性40 岁以前出现卵巢功能衰退的现象,其发病率约1%[2]。临床特征表现为闭经,伴随高促卵泡激素(FSH)和低雌激素水平[3]等。
目前POF 的发病机制尚不完全明确。临床上,对POF 患者常采取的治疗方法是雌激素替代疗法[4],虽然可明显缓解症状,但由于激素治疗所带来的致癌等不良反应及高复发率等问题,使患者对激素治疗的依从性普遍较低,在临床应用中受到一定限制。因此,寻找具有疗效确凿且不良反应小的抗POF 药物并揭示其分子机制具有重要的理论和临床意义。有研究者发现,人参主要活性成分人参皂苷Rg1能明显改善POF 的症状和体征[5],但其发挥作用的分子机制尚待阐明。近年来研究发现FSH 受体(FSHR)可介导激活细胞内多条信号通路,如PI3K/AKT 通路,影响生殖细胞的生长发育[6]。PI3K/AKT 通路与POF 发病机制关系密切,通过激活该通路,可显著抑制细胞的增殖与凋亡[7]。此外,本课题组前期研究中已利用顺铂体外诱导卵巢颗粒细胞损伤,成功建立了POF 模型[8]。因此,本研究利用该模型深入探讨人参皂苷Rg1对FSHR/PI3K/AKT 通路的调控作用,揭示人参皂苷Rg1对卵巢颗粒细胞保护作用的可能分子机制,为人参皂苷Rg1应用于POF 临床治疗提供新的理论依据。
1 材料
1.1 动物
健康雌性SD 大鼠16 只,22 ~24 d,体质量为(55±2)g(北京华阜康生物科技股份有限公司),饲养在温度为(25±3)℃,湿度50%~60%,光照12 h,实验前适应性喂养7 d。动物使用许可证:SYXK [京] 2020-0033。
1.2 试药
人参皂苷Rg1(源叶生物,批号:RSZD-121106,纯度≥98%),β-雌二醇(E2,批号:100182-201906,纯度:96.3%,中国食品药品检定研究院),顺铂(源叶生物,批号:B24462)。Dulbecco’s Modification of Eagle’s Medium/Ham’s F-12 50/50 Mix(DMEM/F12)(Cellgro 公司,货号:10-092-CVR),HE 染色试剂盒(上海碧云天生物技术有限公司),BCA 蛋白定量试剂盒、Hoechst33258 试剂盒(北京索莱宝公司),抗体FSHR、PI3K、p-AKT、AKT、Bcl-2、Bax、β-actin、Coralite594-conjugated goat anti-rabbit secondary antibody(美国Proteintech),LY294002(Abcam,美国ab146593)。
2 方法
2.1 体外原代卵巢颗粒细胞的提取与培养
SD 大鼠适应性喂养结束后,每只注射孕马血清促性腺激素(PMSG)50 IU,48 h 后,无菌环境下提取双侧卵巢颗粒细胞进行培养。操作步骤如下:① 取SD 雌鼠,经颈椎脱臼处死,于75%乙醇中消毒3 min;② 将SD 雌鼠放入消毒托盘中取出双侧卵巢,并加入适量预冷PBS;③将卵巢表面的脂肪,包膜等处理干净后,放入预冷PBS 的消毒托盘中清洗;④ 将卵巢移入无血清培养基中,并用1 mL 一次性注射器刺破卵巢边缘的卵泡,使卵巢颗粒细胞充分释放;⑤ 处理完毕后,将含有卵巢颗粒细胞的无血清培养基移入EP 管,离心(半径 8 cm,1000 r·min-1)10 min;⑥ 弃上清液,加入适量的PBS 冲散细胞,1000 r·min-1离心5 min;⑦ 再次弃上清液,加入一定量的含10% 胎牛血清DMEM/F12 培养基,并吹打均匀;⑧ 调整细胞悬液浓度,以1×105个/孔接种于96 孔板,于37℃、5% CO2培养基中培养,3 d 后换一次培养基。观察细胞贴壁情况,待细胞生长至75%~80%时用于后续实验。
2.2 卵巢颗粒细胞鉴定
2.2.1 HE 染色 将颗粒细胞接种于含爬片的24孔板,培养基体积为1 mL/孔,细胞数量1×106个/孔,按照HE 染色试剂盒说明书进行操作,具体步骤如下:① 移除旧培养基,PBS 洗涤3 次,每次5 min;② 在37 ℃下,用4%多聚甲醛先固定20 min,然后PBS 洗涤3 次,每次5 min;③苏木素染色2 min,自来水冲洗2 min;④ 盐酸乙醇分色2 s,快速取出并用自来水小心冲洗3 min;⑤ 醇溶性伊红染色2 min,自来水冲洗;⑥ 无水乙醇脱水,并用二甲苯透明化处理。封片后镜下观察细胞形态并拍照。
2.2.2 免疫细胞化学法 以 1×106个/孔的密度将颗粒细胞接种于含爬片的24 孔板中,使用免疫细胞化学法测定FSHR 表达量。具体操作如下:① 弃培养基后用PBS 洗涤3 次,每次2 min;②先用4%多聚甲醛于37℃下固定15 min,接着PBS 洗涤3 次,每次3 min;③ 每孔加0.5 mL5%BSA 室温封闭1 h 后弃掉;④ 每孔加0.5 mL FSHR 一抗(1∶250),4 ℃过夜,次日PBS 洗涤3 次,每次10 min;⑤ 每孔加0.5 mL 相对应的羊抗兔二抗(1∶200),室温条件下,避光孵育1 h,PBS 洗涤3 次,每次10 min;⑥ 将含DAPI 的抗荧光淬灭封片剂滴加于载玻片上,盖上爬片,于荧光显微镜下观察并拍照。
2.3 CCK8 法
2.3.1 实验分组 不同质量浓度人参皂苷Rg1(0 ~ 400 ng·mL-1)处理颗粒细胞24 h,用于研究人参皂苷Rg1对颗粒细胞的毒副作用,并根据结果选择人参皂苷Rg1低、中、高浓度。不同质量浓度顺铂(0 ~80 μg·mL-1)处理颗粒细胞12 h,用于建立POF 模型,并选出最佳造模浓度。然后,将细胞分为正常组、模型组、人参皂苷Rg1低(顺铂+低浓度人参皂苷Rg1)、中(顺铂+中浓度人参皂苷Rg1)、高浓度组(顺铂+高浓度人参皂苷Rg1)和E2 组(顺铂+β-雌二醇),并分别培养24、48 h,用于研究人参皂苷Rg1对顺铂作用下颗粒细胞的影响,并根据实验结果选择最佳人参皂苷Rg1的浓度。
2.3.2 细胞活力检测 以1×105个/孔将颗粒细胞接种于96 孔板,每组5 个复孔,药物处理结束后,将含10% CCK8 无血清DMEM/F12 培养基加入每个孔中,100 μL/孔,并在37℃下继续培养2.5 h,于450 nm 处检测吸光值。
2.4 Hoechst 33258 染色
按“2.3.1”项下方法进行细胞的分组与给药,用4%多聚甲醛固定后加入Hoechst 33258 染色液反应5 min。其他操作同“2.2.2”项下⑤⑥的步骤。
2.5 Western blot
使用预冷PBS 清洗细胞后,用含1% PMSF和1%磷酸酶抑制剂的RIPA 裂解液裂解细胞,提取总蛋白。离心后吸取上清液,进行BCA 蛋白定量。用12% SDS-PAGE 分离蛋白,将蛋白转移到PVDF 膜(100 V 75 min)。然后,室温下封闭1.5 h,再将膜与一抗:FSHR 抗体(1∶1000)、PI3K 抗体(1∶1000)、Akt 抗体(1∶1000)、p-AKT抗体(1∶1000)、Bax 抗体(1∶1000)、Bcl-2 抗体(1∶1000)和β-actin 抗体(1∶5000)在4 ℃孵育过夜。用PBST 洗涤3 次,每次10 min 后,加入对应的二抗(1∶10 000)室温孵育1 h。再用PBST 洗涤3 次,每次10 min,用BCL 发光底物后使用凝胶成像仪显影,通过Image J 软件统计条带灰度值。
2.6 统计学分析
采用SPSS 18.0 软件对数据进行统计学分析,实验结果以均值±标准差表示,组间差异用单因素方差分析检验,两两比较采用独立样本t检验,以P<0.05 表示差异具有统计学意义。
3 结果
3.1 卵巢颗粒细胞的鉴定
HE 染色结果显示,细胞贴壁生长,体积较大,呈多角梭形,细胞核位于细胞中央,为深蓝色,呈卵圆形或者不规则形;胞质为淡红色,染色均匀,边缘清晰(见图1)。免疫细胞化学法结果显示,卵巢颗粒细胞的特异性标志物FSHR 在胞质中大量表达,呈红色,在核呈深蓝色,结果表明分离到的细胞是卵巢颗粒细胞(见图2)。

图1 卵巢颗粒细胞形态(HE 染色,×200)Fig 1 Morphological of ovarian granulosa cells(HE staining,×200)

图2 免疫荧光检测卵巢颗粒细胞FSHR 的表达(免疫荧光染色,×200)Fig 2 Expression of FSHR in ovarian granulosa cells detected by immunofluorescence(immunofluorescence staining,×200)
3.2 人参皂苷Rg1 对卵巢颗粒细胞增殖的影响
应用0、12.5、25、50、100、200、300、400 ng·mL-1的人参皂苷Rg1作用于颗粒细胞后,细胞存活率分别为100%、100.94%、100.03%、101.28%、99.86%、100.02%、100.74%、101.78%,表明在此质量浓度范围内,人参皂苷Rg1并未对颗粒细胞产生毒性作用(见图3A)。人参皂苷Rg1在100、200、300 ng·mL-1时,细胞的存活率较为稳定。所以本实验选取100、200、300 ng·mL-1分别作为人参皂苷Rg1低、中、高浓度进行后续实验。
3.3 顺铂诱导的POF 模型建立
如图3B 所示,与正常组相比,顺铂作用于颗粒细胞12 h 后,细胞的存活率随着顺铂质量浓度的增加而下降。基于顺铂处理卵巢颗粒细胞的半数抑制浓度(IC50),选取40 μg·mL-1顺铂处理细胞12 h 作为后续POF 模型建立的条件。
3.4 人参皂苷Rg1 对卵巢颗粒细胞的保护作用
如图3C 所示,40 μg·mL-1顺铂处理12 h 后,再使用低浓度、中浓度和高浓度人参皂苷Rg1处理后,其存活率随着人参皂苷Rg1质量浓度的增加显著提高,且高质量浓度对细胞的保护作用最为明显。以上结果表明,人参皂苷Rg1可保护顺铂诱导的细胞损伤,在高质量浓度时作用效果最佳。因此,选取高质量浓度人参皂苷Rg1用于完成后续分子机制的研究。

图3 人参皂苷Rg1 对颗粒细胞增殖的影响Fig 3 Effect of ginsenoside Rg1 on granulosa cell proliferation
3.5 人参皂苷Rg1 对卵巢颗粒细胞凋亡的影响
与正常组相比,模型组胞核呈亮蓝色荧光,并出现固缩与破碎现象;与模型组相比,高质量浓度人参皂苷Rg1组和E2 组胞核荧光强度降低,且核固缩与破碎现象显著减少(见图4)。

图4 人参皂苷Rg1 对顺铂损伤的颗粒细胞凋亡的影响(Hoechst 33258 染色,×200)Fig 4 Effect of ginsenosid Rg1 on the apoptosis of cisplatin-injured granulosa cells(Hoechst 33258 staining,×200)
3.6 Western blot 检测细胞内相关蛋白的变化
与正常组相比,模型组中FSHR、PI3K、p-AKT/AKT 和Bcl-2 蛋白表达均显著减少,Bax 蛋白表达均增加;与模型组相比,人参皂苷Rg1高浓度组和E2 组中FSHR、PI3K、p-AKT/AKT 和Bcl-2 蛋白表达水平均表达增加,Bax 的表达减少(见图5及图6);与人参皂苷Rg1高浓度组和E2组相比,人参皂苷Rg1高浓度+抑制剂组和E2+抑制剂组中Bcl-2 蛋白表达均明显减少(见图7)。
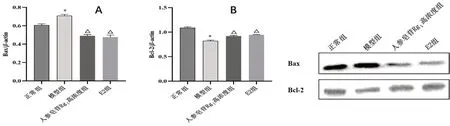
图5 人参皂苷Rg1 对顺铂损伤的颗粒细胞中Bax 和Bcl-2 表达的影响Fig 5 Effect of ginsenosid Rg1 on Bax and Bcl-2 expression in cisplatin-injured granulosa cells

图6 人参皂苷Rg1 对顺铂损伤的颗粒细胞内FSHR/PI3K/AKT 信号通路关键蛋白表达的影响Fig 6 Effect of ginsenosid Rg1 on the expression of key proteins in FSHR/PI3K/AKT signaling pathway in cisplatin-injured granulosa cells
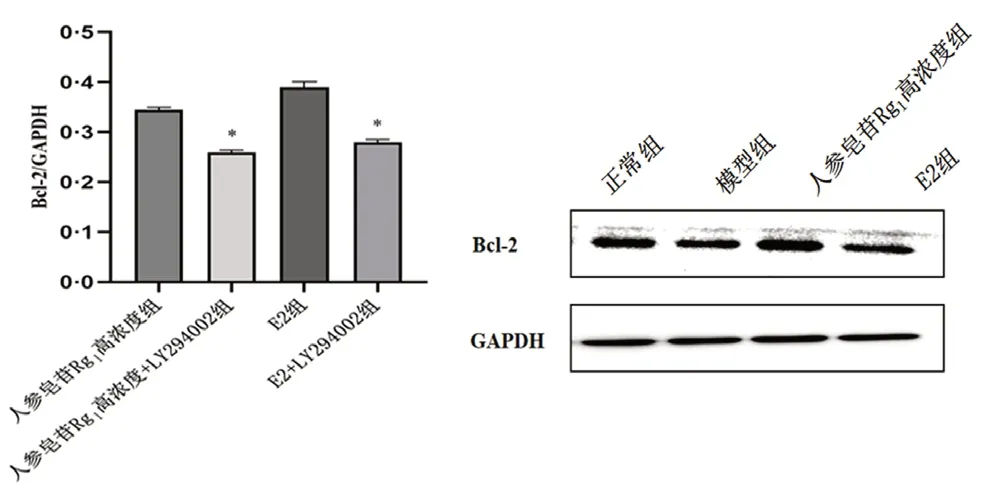
图7 PI3K 抑制剂对顺铂损伤的颗粒细胞Bcl-2 蛋白表达的影响Fig 7 Effect of PI3K inhibitor on the expression of Bcl-2 protein in cisplatin-injur granulosa cells
4 讨论
POF 是一种由遗传和免疫等原因引起的发生于40 岁以下女性的内分泌紊乱性疾病[9],伴有多组织、器官功能障碍,如心血管、骨骼系统相关疾病的发生,甚至促使患者提前衰老,影响其寿命[10-11]。临床上激素替代疗法虽能明显改善患者的症状与体征,但也增加了子宫内膜癌、乳腺癌和静脉栓塞性疾病等发生的风险[12]。近年来,研究发现,人参皂苷Rg1可显著提高卵巢组织的抗衰老能力和POF 小鼠的生育能力[13-14]。课题组前期研究也发现,通过激活PI3K/AKT 通路与抑制颗粒细胞凋亡可改善POF,保护卵巢功能[8,15]。因此,本研究从体外提取原代卵巢颗粒细胞,探讨人参皂苷Rg1是否通过调控FSHR/PI3K/AKT 途径发挥抗POF 作用。
顺铂是临床一线常用化疗药物,其对肿瘤细胞具有明确的杀伤作用,但其对正常组织细胞的结构和功能也有损伤,研究表明,顺铂可导致POF[16]。另外,在顺铂诱导的POF 大鼠模型中,血清FSH 显著升高,且其卵巢组织衰退性改变与化疗药应用于人体导致的POF 病变过程很相似[17]。因此,本实验利用顺铂诱导卵巢颗粒细胞损伤来建立POF 模型。
FSH 是哺乳动物生殖与发育的重要激素,可促进卵泡的发育、卵母细胞的成熟和性类固醇激素的合成[18]。POF 患者检查结果主要显示为血清FSH值增高和卵泡发育不成熟,其原因可能是卵巢组织上FSH 受体(FSHR)的功能减弱或受损,导致对FSH 刺激不敏感,从而抑制卵泡的发育[19]。本研究结果显示,人参皂苷Rg1可显著增强细胞中FSHR 表达,即人参皂苷Rg1可通过上调FSHR 的表达,促进对卵巢颗粒细胞的增殖生长。
FSH 与靶细胞表面FSHR 结合后,可激活PI3K/AKT 信号通路[20],促进生殖系统的发育与成熟。在D-半乳糖诱导的POF 模型中,姜黄素可通过激活PI3K/AKT 信号通路,有效抑制颗粒细胞凋亡和卵巢损伤[21]。在环磷酰胺和白消安诱导的小鼠POF 模型中,胚胎干细胞来源细胞外小囊泡可以通过激活PI3K/AKT 通路,明显提高血清性激素水平,增加卵泡数量和减少凋亡细胞数量[22]。Wang 等[23]研究表明,针刺百会、关元和太冲等可通过上调PI3K/AKT 通路关键蛋白的表达,抑制颗粒细胞凋亡和改善卵泡的发育,从而减轻环磷酰胺诱导的POF。本研究结果显示,人参皂苷Rg1可明显提高PI3K 和p-AKT 的蛋白表达,提示人参皂苷Rg1可通过上调FSHR 蛋白的表达,激活下游PI3K/AKT 途径中关键蛋白的表达。
PI3K/AKT 通路不但是影响POF 的重要途径,还是影响细胞凋亡的重要途径。在卵巢颗粒细胞凋亡过程中,Bcl-2 和Bax 两种调控因子通过形成同/异源二聚体的形式发挥重要作用。Bcl-2和Bax 两者互为拮抗作用,当Bax 蛋白水平表达上调时,Bax 可与Bax 结合形成同源二聚体,促进颗粒细胞的凋亡。反之当Bcl-2 水平上调时,Bcl-2 可与Bax 形成异源二聚体,抑制颗粒细胞凋亡[24-25]。本研究结果显示,人参皂苷Rg1可显著增强Bcl-2 蛋白表达并降低Bax 表达,而加入PI3K 抑制剂后,Bcl-2 蛋白表达显著降低,即人参皂苷Rg1可通过激活FSHR/PI3K/AKT 途径,抑制颗粒细胞凋亡,保护卵巢的功能。
综上所述,人参皂苷Rg1可能通过激活FSHR/PI3K/AKT 信号通路,抑制顺铂损伤的颗粒细胞凋亡,从而保护卵巢颗粒细胞免受损伤。该实验结果或为深入了解中药人参的药理作用机制和Rg1的进一步研究提供参考。