静息态功能MRI观察血管性痴呆大鼠模型全脑局部一致性
贺 欢,丁文才
(1.十堰市人民医院放射影像中心,湖北 十堰 442000;2.哈尔滨医科大学附属第一医院神经内科,黑龙江 哈尔滨 150000)
血管性痴呆(vascular dementia, VD)主要指与脑血管病相关的认知、记忆功能损伤及精神行为异常[1],临床表现与阿尔兹海默病较为相似,鉴别诊断困难;随着MRI技术的发展,静息态功能MRI(resting-state functional MRI, rs-fMRI)及相关分析技术用于缺血性脑小血管病[2],可观察能够间接反映神经元活动的接近生理状态下脑内血氧水平依赖(blood oxygenation level dependent, BOLD)信号自发活动。已有研究以fMRI所示局部一致性(regional homogeneity, ReHo)[3]及功能连接[4]评价VD患者,发现额叶-皮质下环路受损可能与认知功能损害有关,但部分脑区ReHo结果存在一定矛盾,可能与MR设备的分辨力、个体差异及患者配合度等因素相关。本研究采用rs-fMRI评价VD大鼠全脑ReHo变化,并观察其行为学改变。
1 材料与方法
1.1 建立实验动物模型 50只Wistar雄性大鼠,体质量220~250 g,由哈尔滨医科大学附属第一医院动物中心提供,实验动物许可证号:SYXK(黑)2013-002号,分别纳入VD组(n=35)和对照组(n=15),常规饲养,温度(21.0±1.0)℃,湿度50%,明暗交替,自由采食与饮水,3日后停饲12 h造模。
经腹腔注射10%水合氯醛(350 mg/kg体质量)麻醉大鼠后保定于小动物手术台,对颈部区域进行常规备皮、消毒及铺巾。沿大鼠颈部正中做切口,暴露双侧颈总动脉,分离迷走神经后,对VD组以细线结扎大鼠一侧颈总动脉两端并将其剪断,待大鼠生命体征平稳后分离另侧颈总动脉,以动脉夹夹闭15 min后通血10 min,反复3次后予以永久性结扎;对照组仅行假手术,分离大鼠双侧颈总动脉而不予结扎。手术期间注意保暖,观察大鼠生命体征变化;术后逐层缝合皮肤并消毒,继续常规饲养4周。
1.2 Morris水迷宫实验 以4个象限中的任意一点作为大鼠入水点,将其面向池壁放入水中,记录其游泳路线及爬上平台的时间(逃避潜伏期)。若大鼠于90 s内爬上平台即结束实验,超期则将其引导至平台上并停留10 s后结束实验。每只大鼠每日学习2次,持续5日[5-6]。
1.3 图像采集 采用Bruker 9.4T MR仪,大鼠脑表面线圈。予大鼠吸入5%异氟烷进行麻醉,扫描期间持续吸入1%~2%异氟烷以维持麻醉,并以小型气动枕头传感器(美国SA仪器有限公司)连续监测其呼吸状态。采集大鼠颅脑轴位、冠状位及矢状位MRI,参数:T2WI,TR 3 000 ms,TE 33 ms,FOV 30 mm×30 mm,层数30,层厚1.0 mm,矩阵256×256,回波链长8;行T2液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)序列扫描,TR 3 500 ms,TE 15 ms,层数50,层厚0.5 mm,矩阵100×100,FOV 30 mm×30 mm。
1.4 数据处理 采用Matlab R2016b平台中的统计参数映射(statistic parametric mapping, SPM)12软件及rs-fMRI数据处理助手(data processing assistant for rs-fMRI, DPARSF)V4.3版对rs-fMRI数据进行预处理。排除大鼠脑结构异常及成像质量不佳者。将DICOM数据格式转换为NIFTI格式,剔除前10个时间点的图像后,行去颅骨化处理、时间校正及头动校正,剔除头动>2 mm,旋转>2°的图像。基于蒙特利尔神经研究所(Montreal Neurological Institute, MNI)坐标,利用空间归一化将所获数据配准至同一标准空间。
计算目标体素及其相邻26个体素的肯德尔一致性系数(Kendall's consistency coefficient, KCC),作为ReHo值,用于代表其在同一时间序列和空间位置上的活动一致性或相似度,以间接反映神经元活动的同步性,取值范围为0~1,即局部脑区ReHo值增加代表神经元活动同步性增强、脑区活跃,ReHo值减低提示神经元活动同步性降低。
1.5 统计学分析 采用GraphPad Prism 8.0软件。以双样本t检验比较2组大鼠逃逸潜伏期的差异。采用双样本t检验比较2组大鼠ReHo值存在差异的脑区,以GFR法校正多重比较,以校正前单个体素P<0.01、团簇>49个体素和校正后P<0.05区域为差异有统计学意义的脑区。
2 结果
造模后VD组12只大鼠死亡,3只于图像分析过程中被排除,最终VD组共20只;对照组1只大鼠因麻醉死亡,4只图像分析过程中被排除,最终对照组10只大鼠纳入实验。
2.1 VD大鼠行为学改变 Morris水迷宫实验中,对照组大鼠可于短时间内找到平台,而VD组耗时较长;随着学习次数增加,2组大鼠逃逸潜伏期均逐渐缩短,但各时间点VD组逃逸潜伏期仍长于对照组(P均<0.01),见图1、2。
2.2 VD大鼠ReHo值改变 VD组大鼠双侧纹状体ReHo值低于对照组(P<0.05,GFR校正),右侧背外侧内嗅皮层、右侧新脑皮层ReHo值高于对照组(P均<0.05,GFR校正),见表1及图3。
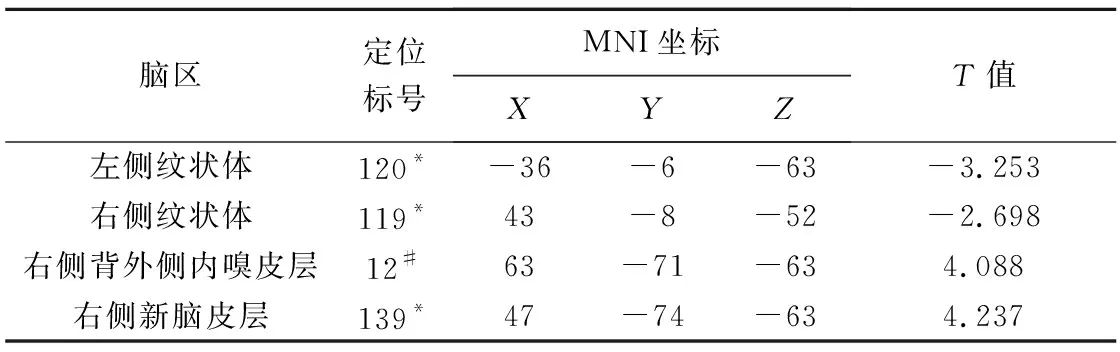
表1 VD组与对照组大鼠ReHo值存在差异的脑区
3 讨论
目前用于制备VD动物模型的方法包括血管阻断法、血管栓塞法、颅内注射及转基因法等[9]。血管阻断法主要通过夹闭或结扎大鼠颈总动脉减少其脑部供血。直接阻断大鼠双侧颈总动脉法重复性好、可致大鼠学习记忆功能受损明显,且无神经功能缺损症状,但所致大鼠死亡率较高[10],甚至达65%[11]。本研究采用两步血管阻断法,先结扎一侧颈总动脉,之后对另侧颈总动脉先间歇阻断后再予结扎,操作简便,常用于建立慢性低灌注及白质损伤动物模型,可使动物出现明显的学习、记忆功能障碍,具有慢性、持续性等特点,且不引起明显的感觉、运动功能损害。水迷宫实验通过训练黑暗环境下大鼠辨别方向的能力,可测试其学习和记忆能力。本研究各时间点VD组大鼠逃逸潜伏期均较对照组明显延长,提示VD组大鼠学习、记忆功能均已出现障碍。
纹状体属于基底神经节,主要包括尾状核与壳核,其功能为调节肌肉张力、协调精细复杂运动。近年来,越来越多的研究表明纹状体在学习认知方面也具有举足轻重的作用,如LI等[12]发现纹状体多巴胺能功能可随语言功能下降而缓慢降低,尾状核头在此过程中起关键作用,而壳核则通过影响强化学习和内隐学习参与学习、认知过程。纹状体由深穿支动脉供应,为脑神经回路的重要中转站。结扎VD大鼠双侧颈总动脉可使其血脑屏障损伤、神经元细胞损伤和脑灌注减少,导致纹状体损伤;纹状体损伤与海马引起的认知功能下降具有协同作用,可进一步导致认知功能下降。本研究发现VD组大鼠纹状体ReHo值较对照组减低,进一步证实纹状体功能降低可能与大鼠学习认知下降相关;VD大鼠脑灌注降低致纹状体区神经元活动异常,使其神经元同步性降低,而纹状体ReHo减低则影响多巴胺信号的传递,进而影响大鼠认知功能,与THERMENOS等[13]的结论相似。
大鼠内外侧内嗅皮层分工不同,内侧内嗅皮层主要负责编码空间信息,而外侧内嗅皮层主要编码嗅觉及形状等信息。LEE等[14]采用光遗传学技术、单细胞电生理记录和光纤记录系统进行观察,发现受多巴胺信号控制的小鼠外侧内嗅皮层扇形细胞在关联性学习过程中具有关键作用:大脑将任务相关信息发送至海马前,外侧内嗅皮层接受来自嗅觉区域的气味信息并进行转换,成为奖赏相关信息,提示外侧内嗅皮层直接编码奖赏相关学习记忆[14]。新脑皮层为大鼠大脑中较晚出现的区域,但其体积逐渐增大,是大部分感觉的汇总区,也是许多高级认知的关联皮层。本研究发现VD组大鼠右侧背外侧内嗅皮层及右侧新脑皮层ReHo值较对照组明显提高,提示水迷宫学习任务中,背外侧内嗅皮层处于关键环节,ReHo值提高可能与VD组大鼠对位置信息的学习能力较差,须通过代偿性提高外侧内嗅皮层功能以弥补编码空间位置信息的能力缺失有关;新脑皮层ReHo值提高同样可能为代偿性反应,但其具体机制尚不明确,有待进一步观察。
综上,VD大鼠模型局部ReHo值与对照组存在差异,其双侧纹状体、右侧背外侧内嗅皮层及右侧新脑皮层改变可能与认知功能下降有关。但本研究样本量小,未进一步分组观察,且未进行相关血液因子检测,有待后续加以完善。

