低聚半乳糖对植物乳杆菌发酵乳特性及抗蜡样芽孢杆菌活性的改善
刘 乐,邹开翔,邵开生,于 晖,陶雪莹,魏 华,3,张志鸿,3,
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.江西省疾病预防控制中心,江西南昌 330029;3.南昌大学中德联合研究院,江西南昌 330047)
益生乳酸菌因具有调节宿主健康并改善发酵食品风味的特点而得到广泛的应用[1−2]。乳制品作为乳酸菌应用最常规的载体[3−4],具有为乳酸菌提供保护剂的功能,同时可以为菌株发酵提供丰富的营养物质。乳酸菌代谢产生的代谢物,如乳糖酶和蛋白分解酶,可分别分解牛奶里的乳糖和蛋白质,并产生有机酸等小分子代谢产物,有利于人体消化吸收[5−7]。
植物乳杆菌ZDY2013 是一株分离于自然发酵酸豆角中,且具有自主知识产权的优势菌株,具有耐受胃肠道环境并调节宿主肠道菌群的能力[8−9]。前期研究表明,植物乳杆菌ZDY2013 展现了良好乳制品发酵剂的作用,能用于牛奶发酵,并能抑制污染各类乳制品的食源致病蜡样芽孢杆菌在发酵过程中的生长[10],同时该菌发酵的牛奶可有效预防由产肠毒素蜡样芽孢杆菌引起的肠道菌群稳态失衡[11]。因此,该植物乳杆菌应用于乳制品生产将有效防止发酵乳被该致病菌污染,从而提升发酵乳的安全性。
低聚半乳糖(Galactooligosaccharide,GOS)是一类肠道微生物可获得性碳水化合物(Microbiotaaccessible carbohydrate,MAC),能不被肠道消化吸收,直接进入大肠供肠道固有乳酸菌代谢使用,具有益生元特性[12−13]。研究表明,低聚半乳糖在动物的乳汁中有微量的存在,而人母乳中含量相对较多[14],被认为是一种乳源性功能低聚糖,可以改善肠道菌群的稳定性,为婴幼儿健康发育不可或缺的成分[15−16]。研究发现低聚半乳糖可以降低多种类型腹泻疾病的风险,包括旅行者腹泻、渗透性腹泻和艰难梭菌相关复发性腹泻[17−19],还可以通过改善优势益生菌属的定植来达到促进肠道健康,进而预防炎症性肠病以及便秘等[20−22]的目的。
目前,低聚半乳糖主要应用于婴儿配方奶粉、糕点、面包等。据报道,添加低聚半乳糖在奶粉中可促进宿主体内双歧杆菌和鼠李糖乳杆菌的生长[13];摄入添加了低聚半乳糖的酸奶能够提高肠道菌群的丰度、短链脂肪酸的产量以及钙的利用率[23]。因此,开发兼具益生菌和益生元功能,或协同功能的乳制品是丰富该领域产品的有效策略。为此,本文在确定低聚半乳糖能促进植物乳杆菌ZDY2013 体外代谢的基础上,进一步采用响应面法分析多种因素对发酵乳特性的影响,并考察低聚半乳糖对植物乳杆菌发酵乳抑制食源性产肠毒素蜡样芽孢杆菌的改善作用。本研究将为低聚半乳糖在发酵乳中的应用,及植物乳杆菌ZDY2013 的功能开发提供理论基础。
1 材料与方法
1.1 材料与仪器
植物乳杆菌(Lactobacillus plantarum)ZDY2013、产肠毒素蜡样芽孢杆菌(Bacillus cereus)HN001 均保存于食品科学与技术国家重点实验室;葡萄糖、低聚半乳糖、胰蛋白胨、牛肉膏、酵母提取物、MRS 培养基 北京索莱宝科技有限公司;氯化铵、四水硫酸镁、磷酸氢二钾、磷酸二氢钾、半胱氨酸盐酸盐、七水硫酸镁、吐温-80 西陇化工股份有限公司;其他有机试剂均为国产分析纯。
Anaerobox IV 型厌氧培养箱 美国Gene Science公司;ZXSD-B1090 型恒温培养箱 中国上海智城分析仪器有限公司;ST 16R 型台式高速冷冻离心机德国Eppendorf 公司;MultiskanGO 型全波长酶标仪 美国Thermo Fisher Scientific 公司;PHS-3E 型pH计中国上海仪电科学仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制 MRS 培养基:称取48 g MRS培养基粉末,加蒸馏水溶解并定容至1 L,锥形瓶分装,121 ℃高温灭菌15 min;LB 培养基:称取NaCl 10 g、胰蛋白胨10 g、酵母提取物5 g、加蒸馏水溶解并定容至1 L,121 ℃高压灭菌15 min;Basal MRS(BMRS)培养基[24]:称取胰蛋白胨10.0 g、牛肉膏5.0 g、酵母提取物5.0 g、氯化铵3.0 g、四水硫酸镁0.05 g、磷酸氢二钾4.0 g、磷酸二氢钾2.6 g、半胱氨酸盐酸盐0.5 g、七水硫酸镁0.102 g 和吐温-80 1.0 g,加去离子水至1 L,溶解并调pH 至6.2±0.1,于121 ℃灭菌15 min。BMRS 用于后续改良培养基的配制。
1.2.2 菌株活化 从−80 ℃冰箱取出植物乳杆菌ZDY2013,在MRS 固体培养基上划线,于37 ℃静置厌氧培养24 h,将单菌落挑至5 mL 液体MRS 培养基中,37 ℃静置厌氧培养24 h,以1.0% (v/v)接种量传代两次,使得菌液浓度为1.5×109CFU/mL。蜡样芽孢杆菌HN001 需在LB 固体培养基上划线,并传代至5 mL LB 培养基中,在37 ℃、180 r/min 条件下培养12 h。
1.2.3 低聚半乳糖对植物乳杆菌生长的影响 在BMRS 培养基中添加无菌的低聚半乳糖或者葡萄糖溶液,使其终浓度为2.0%(v/v),获得不同改良MRS 培养基,其中葡萄糖组作为对照组。取上述活化后的菌液以1.0%(v/v)接种到改良培养基中,于37 ℃条件静置厌氧培养,从2 h 开始,每隔2 h 取样一次,进行活菌计数。pH 测定:取上述传代两次后的菌液1.0%(v/v),添加到含有2.0%葡萄糖或低聚半乳糖的改良MRS 培养基中培养,每隔2 h 取一次,测量其pH。
1.2.4 植物乳杆菌发酵液的抑菌活性测定 将上述活化后的植物乳杆菌以1.0%(v/v)接种到添加了葡萄糖或低聚半乳糖(2.0%,w/v)的改良MRS 培养基中,37 ℃静置厌氧培养24 h,于8000×g 离心10 min,发酵上清液备用。将上述活化后的蜡样芽孢杆菌HN001 按1%(v/v)的接种量接种至5 mL LB 培养中,在37 ℃、180 r/min 条件下培养12 h,再用1×PBS 对培养液进行10 倍稀释,后取100 μL 涂布到LB 固体培养基上,待菌液晾干后,加入上述150 μL植物乳杆菌发酵上清液于牛津杯,静置20 min,37 ℃培养12 h,记录抑菌圈直径。
1.2.5 不同发酵条件对低聚半乳糖发酵乳特性的影响
1.2.5.1 单因素实验设计 a.菌株接种量:以接种量0.5%、1.0%、2.0%和3.0% (v/v)的植物乳杆菌重悬液分别接种至已灭菌的10%的脱脂乳(含1.0%的葡萄糖或低聚半乳糖)中,在37 ℃下静置发酵24 h,测定发酵乳中植物乳杆菌的活菌数、pH 和持水力;b.低聚半乳糖浓度:配制含0.5%、1.0%、2.0%和4.0%的葡萄糖或低聚半乳糖的10%的脱脂乳,再接种1.0%的植物乳杆菌重悬液,于37 ℃条件下发酵24 h,测定发酵乳中植物乳杆菌活菌数、pH 和持水力;c.发酵时间:以接种量为1.0%的植物乳杆菌重悬液接种至已灭菌的10%的脱脂乳(含1.0%的葡萄糖或低聚半乳糖)中,在37 ℃条件下分别发酵6、12、24 和48 h,测定发酵乳中植物乳杆菌活菌数、pH 和持水力;d.发酵温度:以接种量为1.0%的植物乳杆菌重悬液接种至已灭菌的10%的脱脂乳(含1.0%的葡萄糖或低聚半乳糖)中,分别在27、32、37、42 ℃条件下静置发酵24 h,测定发酵乳中植物乳杆菌活菌数、pH 和持水力。
1.2.5.2 发酵乳特性的测定 a.活菌数:用1×PBS对发酵乳样品进行10 倍梯度稀释,接着在MRS 固体培养基上涂板,于37 ℃条件下厌氧培养24 h,计算活菌数;b.pH:用PHS-3E 型pH 计测定不同条件下发酵乳样品的pH;c.持水性:称取发酵乳样品5 g(M0),在5000×g,4 ℃下离心15 min,除去上清后再称重(M1)。发酵乳持水力计算公式如下:持水力(%)=(M1/M0)×100。
1.2.6 响应面试验优化发酵乳制备条件 根据单因素实验结果,以植物乳杆菌活菌数为响应值,以菌液接种量(X1)、糖添加质量浓度(X2)、发酵时间(X3)、发酵温度(X4)为考察指标,利用Designexpert 8.0.6 软件设计四因素三水平试验,其中Box-Behnken试验因素与水平见表1。

表1 Box-Behnken 试验因素与水平Table 1 Factors and levels of Box-Behnken test
1.2.7 低聚半乳糖发酵乳的抑菌活性 参考前期研究方法[10],在含有1.0%低聚半乳糖的10%脱脂乳粉溶液中接种产肠毒素蜡样芽孢杆菌HN001,使其终浓度为103CFU/mL,模拟较低浓度的污染,再接种植物乳杆菌ZDY2013 至其终浓度为105CFU/mL,静置培养。分别在0、24、36 和48 h 取发酵液1.0 mL,用1×PBS 进行10 倍梯度稀释,在MRS 固体平板上进行涂布,计算活菌数。试验进行三次重复。
1.3 数据处理
上述实验均重复三次,结果用均数±标准差(Mean±SD)表示。采用GraphPad Prism 8.0 软件对数据进行处理和统计分析,各组总体均数采用双因素方差分析(Two-way ANOVA)进行显著性比较,其中P<0.05,表示差异显著。
2 结果与分析
2.1 低聚半乳糖对植物乳杆菌体外代谢的影响
根据前期植物乳杆菌ZDY2013 全基因组测序结果,可知其具有代谢多种碳水化合物的相关酶[25]。本研究采用低聚半乳糖制作改良MRS,评价植物乳杆菌ZDY2013 体外发酵特点。结果发现,接种量为1.0%的植物乳杆菌能很好的利用低聚半乳糖进行代谢,生长能力类似碳源为葡萄糖的对照组(图1A)。其中,前4 h 为代谢调整期,植物乳杆菌利用两种碳源代谢的浓度变化较少;在4~10 h 间为指数生长期,细菌浓度能达到109CFU/mL;在10 h 之后为代谢稳定期,低聚半乳糖组的植物乳杆菌浓度要高于葡萄糖组,且在第22 h 时有显著差异(P<0.05),说明低聚半乳糖在促进植物乳杆菌代谢方面要优于葡萄糖。另外,植物乳杆菌代谢两种不同碳水化合物后发酵液的pH 变化趋势非常相似(图1B)。其中,前4 h 的pH 变化均不明显,4~12 h 后pH 急速下降,与菌株代谢的浓度结果基本一致,随后pH 慢慢趋于稳定并维持在3.8 左右,说明植物乳杆菌利用低聚半乳糖代谢能力较强,能降低发酵液pH,这和前期研究发现的植物乳杆菌ZDY2013 利用商业化MRS 代谢产酸降低pH 结果一致[10]。综上所述,植物乳杆菌ZDY2013可以利用具有益生元特性的低聚半乳糖进行良好生长代谢。

图1 低聚半乳糖对植物乳杆菌ZDY2013 生长代谢的影响Fig.1 Effect of GOS on the metabolism of L.plantarum ZDY2013
2.2 低聚半乳糖对植物乳杆菌发酵上清液抑菌能力的影响
植物乳杆菌代谢碳水化合物发挥抗菌活性对其在食品中的开发应用具有重要意义。本研究采用食品中可引起呕吐和腹泻食源性疾病的蜡样芽孢杆菌作为指示菌[26],考察植物乳杆菌发酵低聚半乳糖后上清的抑菌能力。结果发现植物乳杆菌利用改良培养基发酵后的上清对产肠毒素蜡样芽孢杆菌HN001 具有良好的抑制作用,抑菌圈均在10 mm 以上,且低聚半乳糖组的抑菌效果优于对照的葡萄糖组(图2)。上述结果与前期植物乳杆菌利用MRS 培养基发酵上清的抑菌效果相似,说明采用低聚半乳糖改良的培养基进行发酵也产生了能抑菌的有机酸[10]。

图2 植物乳杆菌利用改良培养基发酵的抑菌能力Fig.2 The antibacterial ability of L.plantarum fermented with modified media
2.3 影响低聚半乳糖发酵乳特性的因素
2.3.1 不同菌液接种量对发酵乳特性的影响 植物乳杆菌作为乳品发酵菌剂,对发酵乳的特性具有决定性的影响作用。在低聚半乳糖添加量一定的条件下,乳品中接种不同比例的植物乳杆菌菌液对发酵乳中活菌数有一定的影响,表现为随着接种量的升高(0.5%~3.0%),最终活菌数不断提高,且最高浓度达8.9 lg CFU/mL,与接种量为0.5%时,有高度显著差异(P<0.001;图3A);然而,葡萄糖添加量一定时,乳品中接种不同比例的植物乳杆菌菌液对发酵乳中活菌数没有特别的影响(均低于8.6 lg CFU/mL),这可能是因为1.0%(m/v)葡萄糖浓度较低,难以促使植物乳杆菌在发酵乳中高效生长,这也说明接种高浓度植物乳杆菌时,低聚半乳糖相比葡萄糖更有利于提高发酵乳中植物乳杆菌活菌数。与发酵乳中活菌数变化相对应的是,当乳品中添加一定量低聚半乳糖时,发酵乳pH 随菌液接种量升高而降低(图3B),这主要是由于发酵液中高浓度活菌会产生更多的有机酸,从而导致发酵乳的pH 高度显著下降(P<0.001)。类似地,葡萄糖对照组pH 也不断下降,推测可能是由高含量接种量促使植物乳杆菌快速进入稳定期,并不断积累有机酸导致的。发酵乳的持水力体现了发酵乳体系对水的截留能力,与其微观结构有关[27],影响发酵乳的品质。本研究发现当接种较高浓度的植物乳杆菌时,葡萄糖组的发酵乳持水力比较差(75%),这可能与菌株在发酵乳中过早进入稳定期,并不断积累有机酸影响发酵乳的渗透压有关;而低聚半乳糖组未发生此类现象,接种量变化不会影响发酵乳较高的持水力(图3C),这可能是低聚糖更有利于发酵乳中酪蛋白生成,从而在酸性的环境下相互作用形成三维空间胶体结构,包容更多的水分子[24,28]。综上,说明添加了低聚半乳糖的发酵乳对菌液接种量变化的适应性更佳,且当菌液接种量为2%或3%时,更有利于改善发酵乳的特性。

图3 不同菌液接种量对植物乳杆菌发酵乳特性的影响Fig.3 Effect of different inoculation amount on the characterization of L.plantarum fermented milk
2.3.2 不同低聚半乳糖浓度对发酵乳特性的影响低聚半乳糖是一种具有优良益生元特性的功能低聚糖,其能被肠道内乳酸菌所利用,开发含有益生元的发酵乳制品具有重要意义。由前面结果已知,低聚半乳糖能促进植物乳杆菌在发酵乳中的代谢,为此进一步探究不同浓度的低聚半乳糖添加量对发酵乳特性的影响。从图4A 结果可知,发酵乳中糖添加浓度的变化对植物乳杆菌活菌数无明显影响,但低聚糖组的活菌数均高于葡萄糖组,其中添加浓度为1.0%~4.0%时,有显著差异(P<0.05),这主要是因为低聚半乳糖在发酵乳中更有利于促进植物乳杆菌生长,从而提高了其在稳定期的浓度;由图4B 可知,随着糖浓度的增加,pH 有下降趋势,且低聚半乳糖组的pH 均低于葡萄糖组,在糖浓度为1.0%~4.0%时有高度显著差异(P<0.001),结合图4A,说明随着糖浓度的升高,植物乳杆菌在发酵乳中产有机酸的能力变强。另外,当低聚半乳糖浓度为4.0%时,pH 低于4.5,将有利于抑制发酵食品中病原微生物的繁殖。由图4C 可知,随着糖浓度的增加,发酵乳的持水力有上升的趋势,但是低聚半乳糖组与葡萄糖对照组均无显著差异(P>0.05),说明糖浓度不是发酵乳持水力变化的决定因素。综上所述,不同浓度的糖对发酵乳特性有一定的影响,且糖质量浓度超过1.0%时优于葡萄糖。
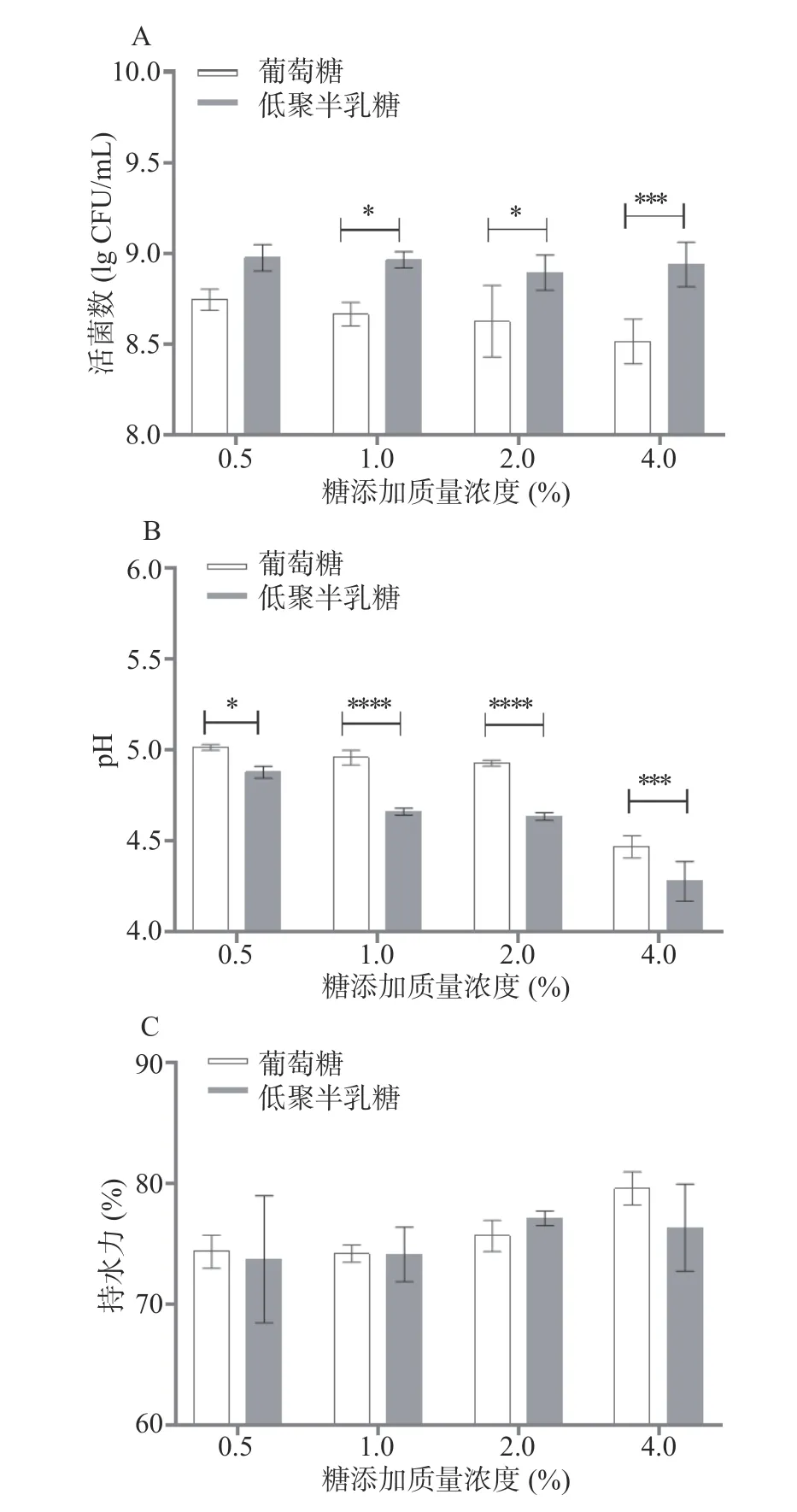
图4 不同浓度低聚半乳糖对植物乳杆菌发酵乳特性的影响Fig.4 Effect of different concentration of GOS on the characterization of L.plantarum fermented milk
2.3.3 发酵时间对发酵乳特性的影响 乳酸菌发酵时间长短的选择对发酵食品质量控制至关重要。如图5A 所示,发酵结束时间的不同,发酵乳中的植物乳杆菌活菌数是有差异的,尤其是发酵6 h 结束时,活菌浓度均不及108CFU/mL,只有发酵12 h 后,低聚半乳糖组的菌株开始进入生长稳定状态,且低聚半乳糖和葡萄糖组之间没有显著差异(P>0.05)。然而,低聚半乳糖和葡萄糖组在发酵24 h时,pH 有显著差异(P<0.05),整体上发酵乳pH 随发酵时间的延长而不断下降,这主要是活菌在发酵乳中快速代谢,积累有机酸导致的,且在24 h 后pH降到5.0 以下,能有效预防病原微生物污染。另外,发酵乳持水力在发酵前12 h 很强,无论低聚半乳糖组还是葡萄糖组均超过85%,而发酵24 h 之后会降低并趋于平稳(图5C)。综上,说明发酵24 h 为发酵乳综合特性最适时间。
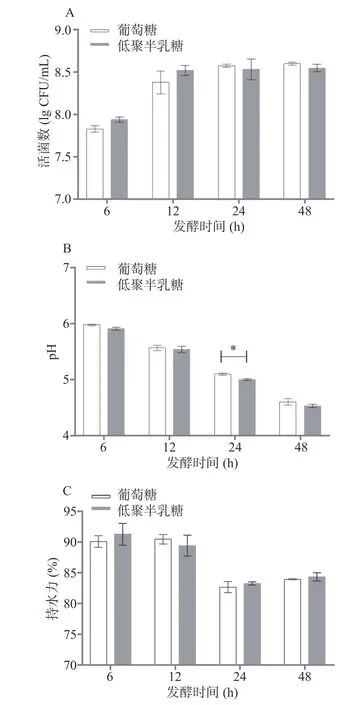
图5 发酵时间对植物乳杆菌发酵乳特性的影响Fig.5 Effect of fermentation time on the characterization of L.plantarum fermented milk
2.3.4 发酵温度对发酵乳特性的影响 发酵温度是影响乳酸菌发酵乳品质的另一个因素,因此评估植物乳杆菌发酵的最适温度有重要意义。根据植物乳杆菌的最适生长温度为37 ℃的特点,本研究选择27、32、37 和42 ℃温度指标来探究发酵温度对发酵乳特性的影响。由图6A 可知,发酵温度为27~37 ℃时,发酵乳最终活菌浓度较高,接近109CFU/mL;而温度为42 ℃时,对发酵乳最终活菌数有一定影响,但浓度也高于108CFU/mL。另外,由图6B 可知,不同发酵温度对发酵乳pH 影响不大,这主要取决于发酵乳中活菌数和发酵时间的影响,和图6A 结果相似。此外,从图6C 可知,发酵温度变化对发酵乳的持水力影响也不明显,且只有当发酵温度在37 ℃时,低聚半乳糖组的持水力显著高于葡萄糖组(P<0.05)。综上,发酵温度在一定范围内变化对发酵乳特性影响不大,说明该发酵乳的制备对温度要求不太苛刻。

图6 发酵温度对植物乳杆菌发酵乳特性的影响Fig.6 Effect of fermentation temperature on the characterization of L.plantarum fermented milk
2.4 植物乳杆菌与低聚半乳糖在牛奶中发酵的条件优化
2.4.1 Box-Behnken 试验结果与分析 发酵乳中活菌数为影响发酵乳特性的最主要因素,其可以影响发酵乳的pH 和持水性。因此,在单因素实验的基础上,以发酵乳活菌数为响应值,以影响发酵乳特性的接种量(X1)、低聚半乳糖浓度(X2)、发酵时间(X3)和发酵温度(X4)为考量因素,获得Box-Behnken 试验结果与分析(表2),再运用Design Expert V8.0.6 对表2 中的数据进行二次多元线性回归拟合,得到活菌数Y=8.74+0.057X1+0.062X2+0.14X3−0.27X4−0.063X1X2−0.040X1X3−0.0025X1X4−0.045X2X3−0.0075X2X4−0.005X3X4+0.010X12+0.015X22−0.22X32−0.28X42的回归方程,接着对回归方程进行方差分析,结果见表3。

表2 Box-Behnken 试验设计与结果Table 2 Design and results of Box-Behnken test

表3 回归方程的方差分析Table 3 Variance analysis of regression equation
结果显示,模型组P值小于0.01(P=0.0038),说明试验回归方程模型显著。失拟项P值为0.2764,不显著,证明模型选择正确;决定系数R2=0.8201,校正决定系数R2Adj=0.6402,证明该预测模型结果与实验结果的拟合性较好。综上,说明此模型可预测最佳发酵条件。
2.4.2 响应面分析 响应面中图形的陡峭程度反映了两两因素之间交互作用对响应值变化情况的影响。当响应曲面越陡峭,说明交互作用越明显;当等高线越趋于椭圆,表明因素之间的交互作用越是显著,呈圆形则说明交互作用不显著。由图7 可知,除了接种量和糖添加质量浓度这两因素之间的交互作用外,其余各图都呈现凸形曲面,即X1(接种量)和X3(发酵时间)、X1(接种量)和X4(发酵温度)、X2(糖添加质量浓度)和X3(发酵时间)、X2(糖添加质量浓度)和X4(发酵温度)、X3(发酵时间)和X4(发酵温度)之间有一定的相互作用。此外,可以从图中看出,各因素对活菌数的影响依次为X4>X3>X2>X1。

图7 不同因素对发酵乳活菌数的交互影响Fig.7 The interactive influence of different factors on viable bacteria counts of fermented milk
根据软件Design Expert V8.0.6 预测以菌液接种量为2.0%、糖添加质量浓度为1.0%、发酵时间为24 h、发酵温度为42 ℃是最佳发酵条件,对应理论活菌数最大值为1.42×108CFU/mL。进一步对最优条件进行试验验证,三次重复的活菌数分别为1.24×108、1.06×108和1.04×108CFU/mL,与通过响应面试验预测的理论值很接近,说明本模型在模拟发酵条件上具有可靠性。该发酵条件是否同样有利于改善乳品口感、风味、营养价值及肠道健康有待进一步探究。
2.5 低聚半乳糖发酵乳对蜡样芽孢杆菌的抑制作用
前面研究结果表明低聚半乳糖改良的培养基能改善植物乳杆菌ZDY2013 发酵上清抑制蜡样芽孢杆菌的能力,且前期研究发现该菌在牛奶发酵过程中可有效抑制蜡样芽孢杆菌的繁殖[10]。本研究进一步以乳品中常见污染微生物蜡样芽孢杆菌作为指示菌,考察乳品中添加低聚半乳糖后进行植物乳杆菌发酵是否能有效抑制较低浓度蜡样芽孢杆菌的生长。结果如图8 所示,蜡样芽孢杆菌的总活菌数在牛奶发酵24 h 后达到5×105CFU/mL,并在随后的发酵过程中维持该数量级,而该数量级的蜡样芽孢杆菌被认为是不会引起食源性疾病的[29]。另外,105CFU/mL低于前期研究发酵乳中无添加低聚半乳糖时蜡样芽孢杆菌的最高浓度(1.8×106CFU/mL)[10],说明添加低聚半乳糖有利于提高植物乳杆菌发酵乳拮抗蜡样芽孢杆菌的活性。综上所述,低聚半乳糖的添加提高了植物乳杆菌发酵乳预防蜡样芽孢杆菌污染的潜力,摄入该发酵乳可能对肠道健康具有一定的促进作用。

图8 低聚半乳糖发酵乳对蜡样芽孢杆菌的抑制作用Fig.8 Inhibition of GOS fermented milk on B.cereus
3 结论
植物乳杆菌ZDY2013 能抑制病原微生物并维护宿主肠道菌群的稳态,同时具有代谢多种碳水化合物并应用于发酵乳的良好潜力。本研究选取具有益生元特性的低聚半乳糖作为植物乳杆菌发酵乳添加成分,经体外代谢评价和单因素实验确定了植物乳杆菌的接种量、碳源的添加量、发酵时间和发酵温度对发酵乳的活菌数、pH 和持水力有一定影响;综合各因素的交互作用,获得发酵乳制备的最佳条件:菌液接种量为2%、糖添加质量浓度为1.0%、发酵时间为24 h、发酵温度为42 ℃,并经实验得到验证。另外,添加了低聚半乳糖的发酵乳对产肠毒素蜡样芽孢杆菌的抑制能力较强。本研究将为开发一种具有益生菌、益生元特性,并抑制病原微生物的功能发酵乳奠定基础。

