葛根散治疗结肠癌网络药理学研究
聂 新,唐东昕
(1.贵州中医药大学,贵州 贵阳 550002;2.贵州中医药大学第一附属医院,贵州 贵阳 550001)
现代社会人们不健康的生活方式越来越多,癌症的发生率也高居不下,据国际癌症研究机构2021年最新公布的数据显示[1-2],预计2020年全球新增结直肠癌患者近193.16万人,死亡约93.52万人,死亡率高居癌症死亡率的第二位。尽管目前现代医学通过手术、放化疗及靶向治疗等手段干预结肠癌取得了一定的临床疗效,但治疗引起的毒副作用常给患者的生活质量及治疗信心带来消极影响。随着恶性肿瘤个体化综合治疗的逐步推进与深入发展,中医药在配合放化疗时的减毒增效作用,以及对肿瘤患者的临床症状、生活质量及生存期等多方面的改善作用逐渐得到了广泛认可[3],但其复杂的分子机制仍处于进一步探索当中。
葛根散原为张从正创制的解酒毒之方,记载于《儒门事亲》,由葛根、葛花、甘草、贯众、砂仁组成,具有清热解毒、行气化湿、醒脾解酒的功效[4]。研究表明,葛根散能有效抑制结肠腺癌细胞生长,促进其凋亡,并能改善荷瘤小鼠的生存质量[5];葛根散方中葛根素、槲皮素等多种成分已被证实具有抗肿瘤的功效[6-7],然而中药复方治疗恶性肿瘤具有多种组分、靶点、通路互作的特点,故本研究将应用网络药理学方法来预测葛根散治疗结肠癌的潜在分子网络机制,以期为今后的药理及临床研究提供理论参考。
1 资料与方法
1.1 葛根散有效成分及靶点筛选
分别以“葛根、葛花、甘草、砂仁、贯众”为关键词在TCMSP数据库中(https://tcmspw.com/tcmsp.php)检索葛根散的有效成分,设定筛选条件为:口服生物利用率(Oralbioavail ability,OB)≥20%,类药性(Drug-likeness,DL)≥0.1,并结合文献资料对葛根散的有效成分进行补充。应用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)检索葛根散有效成分对应的SMILES号,并将其导入Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)以预测成分相应靶点,设定Probability≥0.7[8],所得靶点与TCMSP数据库中有效成分对应的“Related Target”版块所示靶点合并去重,最后运用UniProt数据库(http://www.uniprot.org/)将获得的靶标蛋白名称转换为相应的基因Symbol。
1.2 结肠癌相关靶点筛选
以“Colon Cancer”为关键词,“Relevance Score≥10”为筛选条件[9],在GeneCards数据库(https://www.genecards.org/)检索结肠癌相关靶点。
1.3 葛根散抗结肠癌潜在作用靶点筛选
将葛根散靶点与结肠癌靶点导入Venn在线平台(Calculate and draw custom Venn diagrams,http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制韦恩图,以获取两者的交集靶点——即葛根散抗结肠癌的潜在作用靶点。
1.4 蛋白互作网络构建及核心靶点筛选
运用String数据库(https://www.string-db.org/)对葛根散抗结肠癌潜在作用靶点进行蛋白互作网络(PPI Network)分析,设置“Organism=Homo sapiens”“High confidence(0.700)”并隐藏离散的蛋白节点;利用Cytoscape 3.7.1软件对结果进行拓扑分析并可视化,依据拓扑分析所得的节点度值(Degree)、间距中心度(Betweenness Centrality,BC)以及紧密中心度(Closeness Centrality,CC)筛选出葛根散治疗结肠癌的核心靶点。
1.5 葛根散抗结肠癌核心靶点GO及KEGG富集分析
运用Metascape平台(http://metascape.org/)对葛根散治疗结肠癌的核心靶点进行GO及KEGG富集分析,设置“PValue<0.01”;运用Bioinformatics平台(http://www.bioinformatics.com.cn/)绘制GO及KEGG富集分析气泡图。
1.6 网络图构建
利用Cytoscape 3.7.1软件绘制“成分-核心靶点-通路”网络图,并依据度值筛选出葛根散的主要作用成分。
1.7 化合物-靶点分子对接
运用PubChem数据库检索葛根散主要作用成分的2D结构,使用ChemBioOffice软件将其转换为3D结构并保存为Mol2格式;在RCSB PDB数据库(https://www1.rcsb.org/)检索葛根散治疗结肠癌核心靶点的蛋白结构,导入Pymol软件去除水分子并分离蛋白及原始配体,运用Autodock Tool软件将化合物、蛋白及原始配体均转化为pdbqt格式,最后运用Autodock Vina进行分子对接,运用Pymol进行对接可视化。
2 结果
2.1 葛根散有效成分及相关靶点
通过检索TCMSP数据库并结合相关文献补充后[10-16]共筛选出活性成分216种,其中葛根12种、葛花41种、砂仁28种、贯众9种、甘草126种,剔除重复部分后得到葛根散活性成分190种。将TCMSP数据库及Swiss Target Prediction数据库检索得到的相关靶点合并去重后共得到葛根散成分靶点425个。
2.2 葛根散治疗结肠癌潜在作用靶点
根据关键词及筛选条件在GeneCards数据库共检索出结肠癌相关靶点1 556个,将其与葛根散成分靶点一同导入Venn在线平台绘制韦恩图(图1),得到交集靶点——即葛根散治疗结肠癌的潜在作用靶点227个。
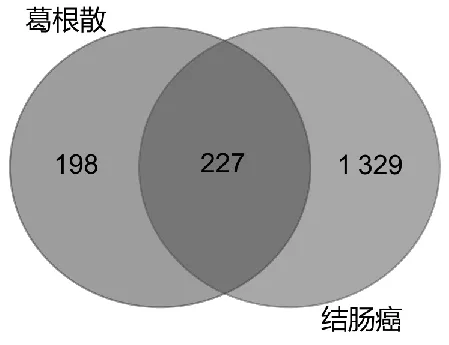
图1 葛根散-结肠癌交集靶点韦恩图
2.3 PPI网络分析及核心靶点筛选
应用String数据库及Cytoscape 3.7.1软件分析葛根散治疗结肠癌的潜在作用靶点并可视化(图2);图中共有224个节点,依据各节点Degree值对其大小及颜色进行调整,节点越大、颜色越深则表示相应Degree值越高,在整个网络中的作用越重要。依据拓扑分析结果,以节点Degree>2倍Degree中位数(34)及BC、CC大于各自中位数(BC:0.00113829,CC:0.444666445)为标准,筛选出TP53、AKT1、IL-6、INS、MAPK1等共43个核心靶点(表1),这些靶点可能在葛根散抗结肠癌过程中发挥关键作用。

图2 葛根散-结肠癌交集靶点PPI网络图
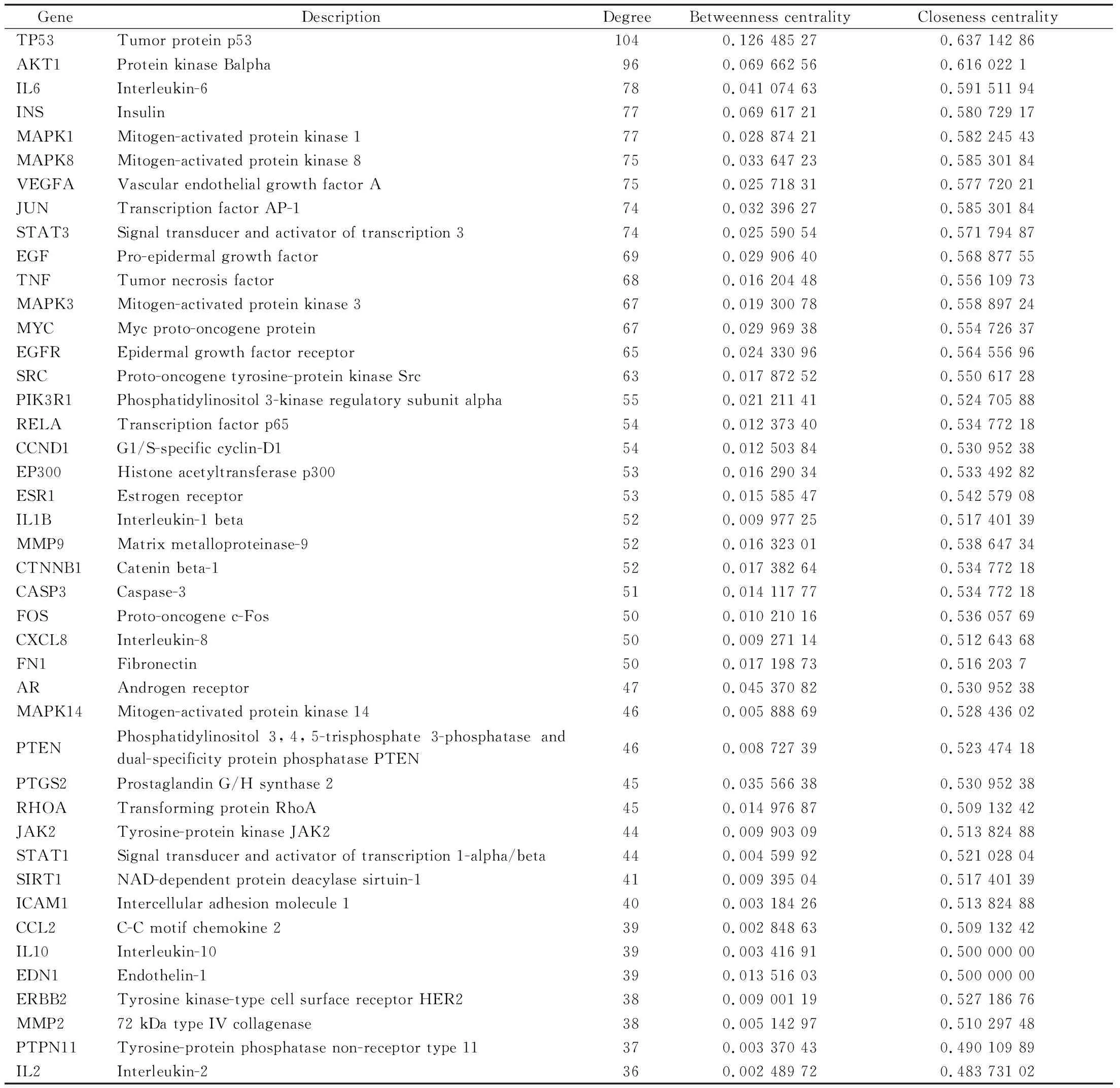
表1 葛根散抗结肠癌核心靶点拓扑参数
2.4 核心靶点GO及KEGG富集分析
将葛根散治疗结肠癌的核心靶点导入Metascape平台进行GO及KEGG富集分析。GO功能注释及富集分析结果共涉及1 637条条目,包括膜筏、膜微结构域、转录调节复合物、黏着斑、常染色质等48项细胞组分条目,转录因子结合、DNA结合转录因子结合、激酶结合、蛋白激酶结合等81项分子功能条目,以及调控DNA结合转录因子活性、生长因子的应答、细胞迁移的正调控等1 508项生物学过程条目。分别筛选出细胞组分、分子功能、生物学过程3项中P值最小的前20项条目制作气泡图(见图3、图4、图5),图中纵向轴为对各条目的描述,横向轴为log(Pvalue)值,气泡的颜色及面积分别对应P值与富集到的靶点信息(Count);条目的log(Pvalue)值越大,对应的P值则越小,气泡颜色偏红;气泡面积越大,则该条目富集到的靶点信息越多。
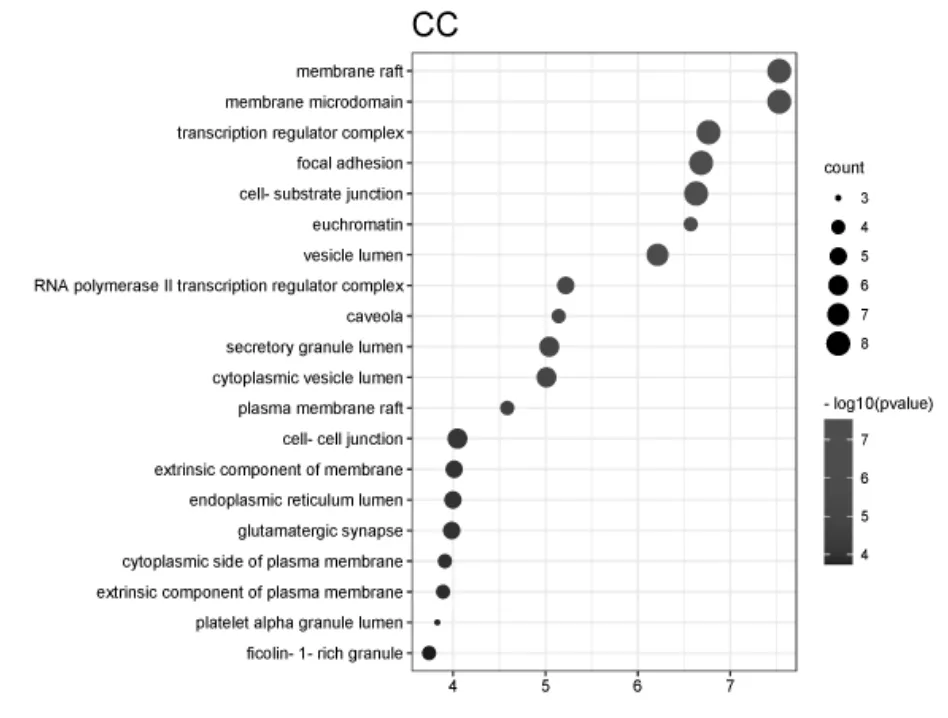
图3 细胞组分气泡图
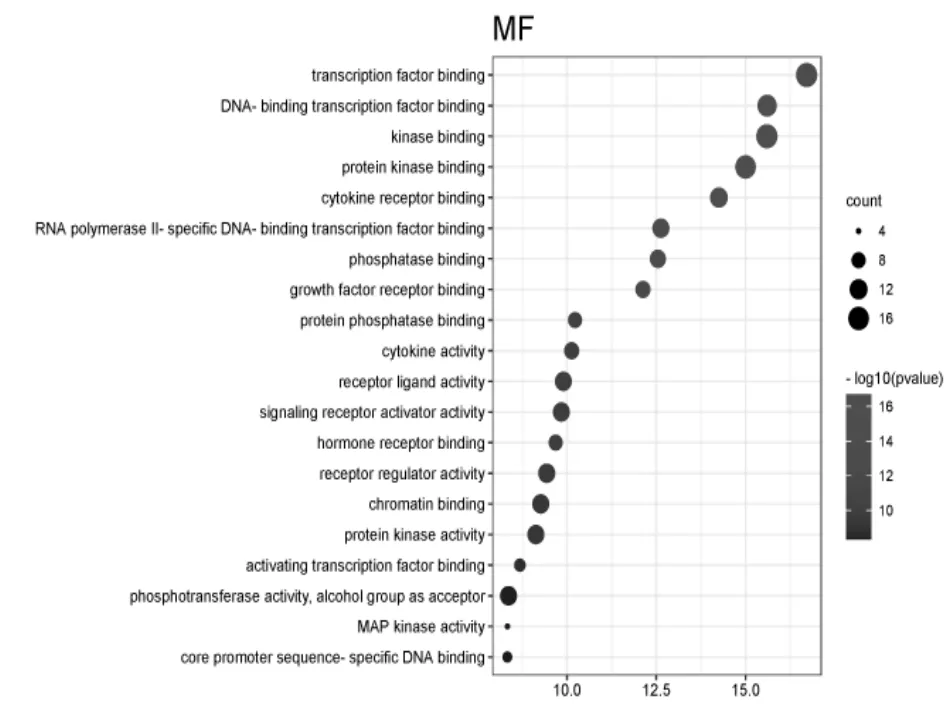
图4 分子功能气泡图
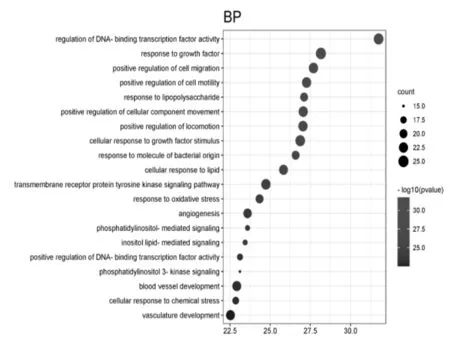
图5 生物学过程气泡图
核心靶点KEGG信号通路分析共富集到140条信号通路,主要涉及癌症通路(Pathways in cancer)、癌症相关蛋白聚糖通路(Proteoglycans in cancer)、膀胱癌通路(Bladder cancer)、前列腺癌通路(Prostate cancer)、胰腺癌通路(Pancreatic cancer)、FoxO信号通路(FoxO signaling pathway)、结直肠癌通路(Colorectal cancer)等肿瘤信号通路,TNF信号通路(TNF signaling pathway)、IL-17信号通路(IL-17 signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway)等炎症相关通路以及与内分泌、心血管、感染性疾病有关的多种类别信号通路。依据信号通路P值由小到大选取前20条制作气泡图(图6),图中纵向轴为信号通路释义,横向轴为通路相应的-log(pvalue)值;信号通路的-log(pvalue)值越大,则相应P值越小,气泡颜色偏红;气泡面积越大,则该通路富集到的靶点信息越多。
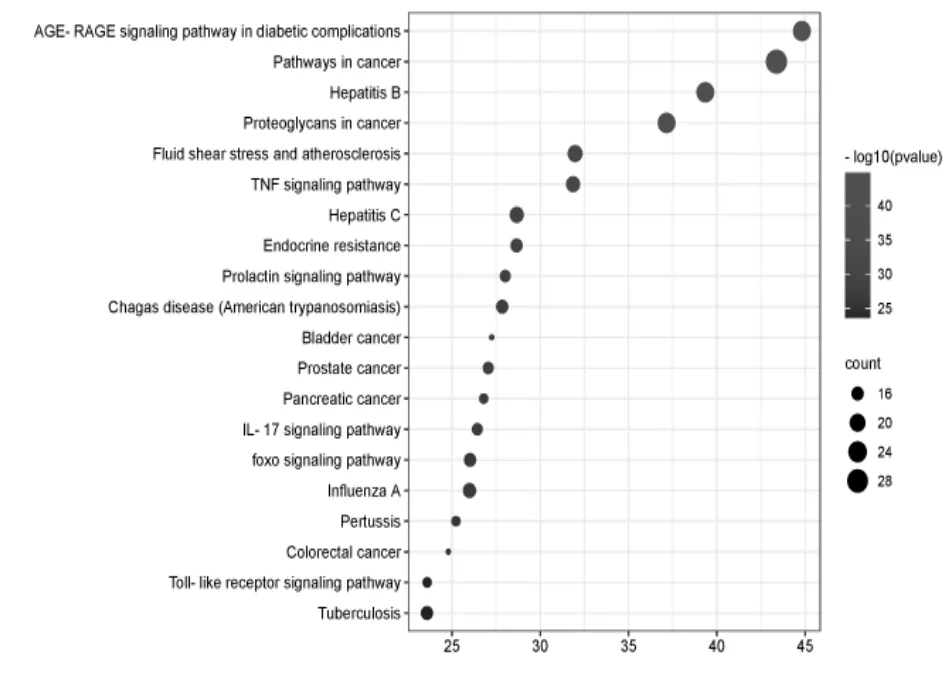
图6 KEGG信号通路气泡图
2.5 “成分-核心靶点-通路”网络图的绘制
运用Cytoscape 3.7.1软件制作“成分-核心靶点-通路”网络图(图7),左侧网络图以葛根散中5味中药为中心节点,绿色节点为中药间共有成分,黄色节点为葛根特有成分,橘色节点为葛花特有成分,粉色节点为贯众特有成分,浅紫色节点为砂仁特有成分,蓝色节点为甘草特有成分,右侧网络图中圆形节点为葛根散抗结肠癌核心靶点,方形节点为P值最小的前20条KEGG信号通路。对该网络图进行拓扑分析,按Degree值由大到小的葛根散成分节点依次为槲皮素(Quercetin)、金雀异黄素(Genistein)、葛根素(Puerarin)、山柰酚(Kaempferol)、大豆苷元(Daidzein),这些可能是葛根散治疗结肠癌的主要成分。见表2、图8。
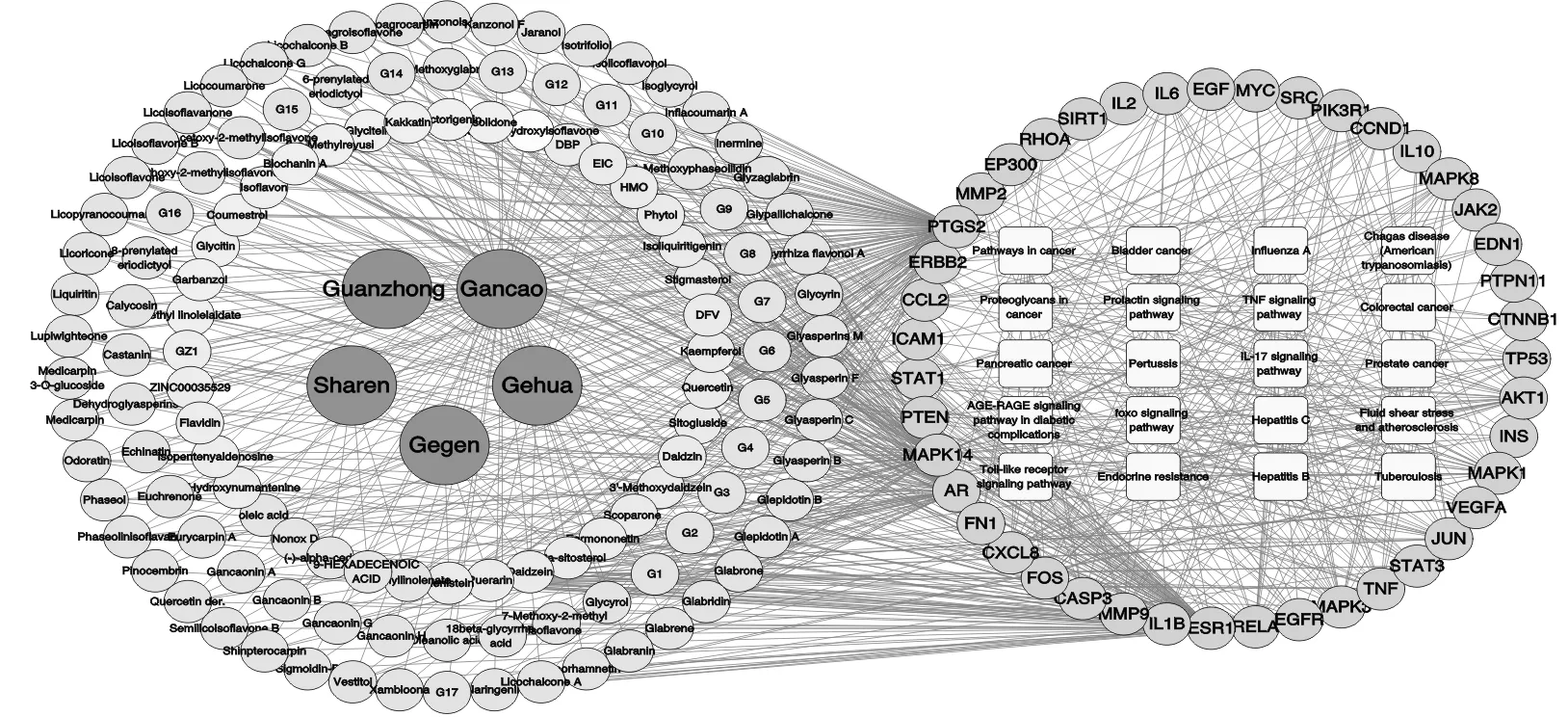
图7 “成分-核心靶点-通路”网络图
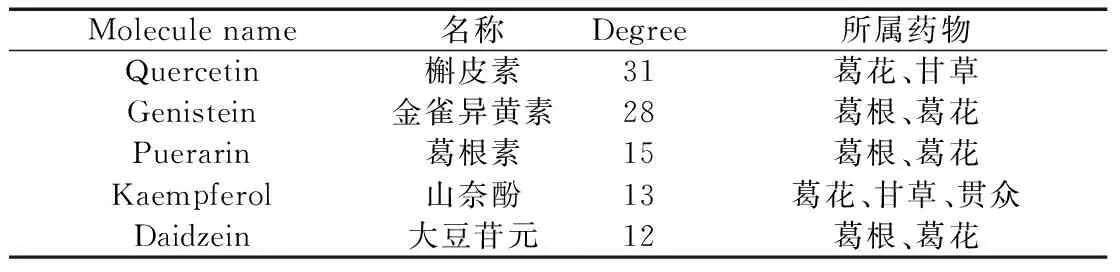
表2 葛根散抗结肠癌主要成分
图8 葛根散核心成分结构图
2.6 分子对接结果
将葛根散治疗结肠癌的主要成分槲皮素、金雀异黄素、葛根素分别与作用核心靶点TP53、AKT1、IL-6、INS、MAPK1进行对接。研究发现,配体与受体对接结合能(Affinity)小于-5.0kcal/mol则提示二者具有较好的结合活性[17];分子对接结果显示,槲皮素、金雀异黄素、葛根素与各靶蛋白对接后结合能均≤-5.0kcal/mol,其中各成分与AKT1(PDB ID:3O96)的结合活性更佳。结果见表3、图9。

表3 分子对接结合能
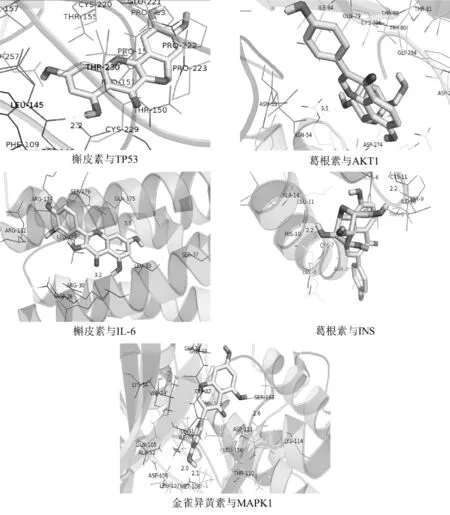
图9 分子对接示意图
3 讨论
结直肠癌症状与中医古籍所述“肠蕈”“锁肛痔”等疾病的症状类似,故可将其归属于该范畴。刘尚义教授将结直肠癌的中医病因病机归纳为先天不足、脾肾两虚,加之饮食失节、情志失调、久居湿地等,而致脾虚失运、湿热内生、蕴结成毒、湿热毒邪搏结于大肠[18]。其他医家亦有各自的见解,一般认为结直肠癌病因病机与正气虚弱、饮食不当所致脾胃受损、湿热瘀毒蕴结大肠有关[19]。葛根散出自张从正所著《儒门事亲》,原为治疗酒伤所致诸症的常用方剂,具有清热解毒、行气化湿之效[4]。国医大师刘尚义教授以葛根散为基础方加减创制了具有养阴散结、活血消癥功效的蟾灵膏[20],用于治疗各类良、恶性肿瘤。根据临床研究显示,蟾灵膏能改善气滞血瘀型肠癌患者的临床症状,提高患者生活质量[21];不过目前有关葛根散治疗结肠癌的有效成分、靶点及机制还不十分明确,故本研究运用网络药理学方法对其进行进一步探讨。
本研究PPI网络图中共有224个节点,经拓扑分析筛选出葛根散治疗结肠癌核心靶点43个,依据节点Degree值由大到小排名靠前的核心靶点依次为肿瘤蛋白p53(Tumor protein p53,TP53)、蛋白激酶B-α(Protein kinase B alpha,AKT1)、白介素-6(Interleukin-6,IL-6)、胰岛素(Insulin,INS)、丝裂原活化蛋白激酶1(Mitogen-activated protein kinase 1,MAPK1)等。肿瘤蛋白p53(TP53)是由抑癌基因p53编码的一种DNA序列特异性转录调节因子[22],参与转录、DNA重组与修复、细胞应激反应、细胞增殖与凋亡及血管生成等多个生物学进程[23],对防止肿瘤的发生发展具有重要意义,约有60%的结直肠癌患者会出现p53基因突变[24],从而失去对肿瘤细胞增殖、分化等过程的抑制作用。蛋白激酶B-α(AKT1)作为介导PI3K/AKT信号通路中关键的一员[9],是其上游调节因子PI3K主要的效应对象[25],活化后的AKT1与细胞的增殖、凋亡、周期调控以及机体葡萄糖代谢等多种生物学过程密切相关[26];AKT1在结肠癌组织中的表达明显升高[9],且升高程度与肿瘤的体积、分期及淋巴结转移与否呈正相关[27]。白介素-6(IL-6)是由单核巨噬细胞、肿瘤细胞等多种细胞分泌的,能参与免疫调节、炎症反应及细胞增殖与分化调控等过程的多效炎症细胞因子,IL-6的失调控可能导致恶性肿瘤发生[28],其促进增殖及抑制凋亡的作用主要由STAT3介导,STAT3作为IL-6的下游效应因子,可通过上调cyclin D、PCNA、Bcl-xL、Bcl-2等基因及蛋白的表达来抑制细胞凋亡、促进细胞增殖[29];研究显示,IL-6的高表达还能通过IL-6/STAT3信号通路引起结肠癌HCT-116/5-FU细胞耐药[30];同时IL-6对调控肿瘤炎性微环境也具有重要作用。此外,结肠癌患者血清的IL-6水平显著升高[31],故可考虑将其作为判断结肠癌预后的指标之一[32-33]。胰岛素(Insulin)对PI3K/AKT、FoxO、MAPK等信号通路均能起到调控作用,从而影响肿瘤的进展[34-35]。研究证实,胰岛素通过上调ACAT1表达促进了结肠癌细胞的增殖与迁移[36]。丝裂原活化蛋白激酶1(MAPK1)是调控细胞增殖与分化的关键因子,研究证明,下调MAPK1的表达可抑制结肠癌细胞增殖、凋亡与侵袭[37]。
网络拓扑分析显示,槲皮素、金雀异黄素、葛根素、山柰酚及大豆苷元可能是葛根散抗结肠癌主要成分;槲皮素是一类天然黄酮醇类化合物。研究显示,槲皮素通过可调控p53、Caspase-3、Bax、Bcl-2、CDK、MMP-9等多种基因及蛋白的表达来实现抗肿瘤效应[38-40],且能通过下调P-糖蛋白(P-gp)的表达降低细胞的外排作用,来逆转肿瘤细胞的耐药,同时在联合放化疗时有较好的协同作用[41-42]。金雀异黄素、葛根素、大豆苷元为葛根与葛花共有活性成分;金雀异黄素具有十分广泛的抗肿瘤特性,除了对细胞凋亡、增殖及迁移的影响以外[43],还可促使LC3I转化为LC3II,从而诱导结肠癌细胞发生自噬[44],并能特异性抑制增殖状态下的血管内皮细胞,通过调节VEGF、EGF、TGF-α、PDGF等来抑制血管生成,是十分安全且有效的血管生成抑制剂。同时,金雀异黄素还可通过抑制酪氨酸蛋白激酶(PTK)、DNA拓扑异构酶II(Topo II)、胰岛素样生长因子I(IGF-1)等多种酶及生长因子的活性来起到抗肿瘤的作用[45]。异黄酮类化合物的主要成分葛根素[46],同大豆苷元、山柰酚一样具有明确的抗肿瘤效应[6,45,47,48]。
GO分析结果显示,葛根散治疗结肠癌核心靶点所涉及的生物学过程主要富集在DNA结合转录因子活性的调控、对生长因子的应答、细胞迁移的正向调控、血管生成等方面。KEGG分析表明,葛根散对结肠癌的治疗作用主要是通过调控癌症通路、癌症蛋白多糖通路、TNF信号通路、IL-17信号通路、FoxO信号通路、Toll样受体信号通路、结直肠癌通路等多信号通路来实现的。白介素-17作为十分重要的促炎因子,可通过激活NF-κB、MAPK信号通路,上调IL-6、TNF、COX-2等多种因子表达来促进肿瘤相关炎症反应[49]。在肿瘤中,FoxO信号通路与其上游的PI3K/AKT信号通路关系最为密切,FoxO转录因子激活后可通过阻滞细胞周期、促进细胞凋亡等方式发挥抗肿瘤效应[50],但被PI3K激活后的AKT可使FoxO磷酸化并降解,从而引起肿瘤进展。Toll样受体信号通路的异常激活与结直肠癌的发生亦密切相关,其作用机制之一可能与肠道菌群-Toll样受体信号通路-炎性反应以及肿瘤级联反应有关[51],此外,KEGG信号通路还涉及内分泌、心血管、感染性疾病等多种机制通路,提示葛根散可能对该类疾病同样具有治疗作用。
综上,葛根散治疗结肠癌是通过多组分、多靶点、多通路、多机制的协同作用来实现的,其发挥作用的主要成分可能为槲皮素、金雀异黄素、葛根素、山柰酚及大豆苷元,涉及的靶点主要有TP53、AKT1、IL-6、INS、MAPK1,并通过调节癌症通路、癌症蛋白多糖通路、FoxO信号通路等肿瘤通路及TNF信号通路、IL-17信号通路、Toll样受体信号通路等炎症通路多途径发挥抗结肠癌作用,且葛根散主要成分与作用核心靶点间有较好的结合活性。结果表明葛根散治疗结肠癌除了发挥促进细胞凋亡、抑制细胞增殖等作用外[5],还能够起到调控肿瘤炎症微环境的作用。肿瘤炎性微环境是导致肿瘤复发、转移、耐药的重要原因之一,机体在感受湿热之邪时往往会出现炎症细胞浸润并发生炎症反应,且“湿热蕴毒”的病机过程与炎-癌转化的进程具有一定的相似性且关系密切[52],故结肠癌发生的病理过程与其中医病机高度相符;加之葛根散具有清热解毒、行气化湿之效,故可推测葛根散对治疗结肠癌有较好的疗效,但由于本研究仅对筛选出来的葛根散治疗结肠癌的核心作用靶点进行了网络分析,故在探究其作用机制上还存在一定的局限性,还需要对其进行进一步探索,并给予实验验证,以更好地挖掘葛根散的临床作用。

