降糖益肾丸对糖尿病肾病大鼠肾Toll样受体4和炎症因子的影响
谢 瑜,杨 蕙,雷 昌,廖小娟*,王 青,聂孝平,邹菊英,崔 姣,王艾琳
(1.湖南中医药大学第二附属医院,湖南 长沙 410005;2.湖南中医药大学第一附属医院,湖南 长沙 410007;3.湖南中医药大学 科技创新中心/湖南省中药粉体与创新药物省部共建国家重点实验室培育基地,湖南 长沙 410208)
炎症因子的募集和激活在促进DN肾损伤发展进程中发挥着主要的介导作用[1]。DN患者体内的炎症水平随病程进展而加重,通过炎性介质及炎症信号通路介导肾小球内皮细胞损伤并最终导致肾小球硬化[2]。TLR4(Toll-like receptors 4,TLR4)能识别内源性配体并激活NF-κB(nuclear factor kappa B,NF-κB),导致促炎细胞因子的合成和分泌,持续参与DN的炎症反应,研究表明,在DN炎症反应中下调TLR4可抑制JNK/NF-κB通路,减少促炎细胞因子IL-6、IL-1α、IL-8和TNF-α的释放,抑制TLR4/NF-κB信号通路及其促炎细胞因子的产生,对炎症性肾损伤具有保护作用[3-4]。前期临床研究证实,降糖益肾丸可明显改善瘀毒损伤肾络型DN早期患者的临床症状、体征,改善尿微量白蛋白排泄率,能明显延缓DN肾损伤的发生与发展[5]。然而降糖益肾丸治疗DN的确切机制不清楚,阻碍了进一步的开发和应用。因此,本研究探讨该药是否通过调控肾小球细胞TLR4/NF-κB炎症通路的表达降低DN大鼠的肾炎症水平,进而发挥保护肾小球炎症损伤作用。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠36只,体质量(300±20) g,购自长沙市天勤生物技术有限公司,许可证号:SCXK(湘)2019-0014;饲养笼具、垫料、普通饲料、饮水均按SPF级实验动物的要求进行制备与消毒,高脂高糖饲料购自长沙市天勤生物技术有限公司;自由摄食与饮水适应性饲养3天后开始实验。
1.2 试药
降糖益肾丸(湖南中医药大学第二附属医院制剂室生产,批号:20200407)。盐酸二甲双胍(石家庄以岭药业股份有限公司,规格0.25 g,批号:A2011056),厄贝沙坦(江苏恒瑞医药股份有限公司,规格0.15 g,批号:201110JB)。
1.3 仪器与试剂
AE224型电子天平(上海舜宇恒平科学仪器有限公司);5804R离心机(德国Eppendorf公司);GA-3型血糖仪(三诺生物传感股份有限公司);MK3型酶标仪(美国Thermo公司);SE-150高速粉碎机(永康市圣象电器有限公司)。链脲佐菌素(STZ,S17049,18883-66-4 USP级,98.5%,上海源叶生物技术有限公司);灭菌注射用水(石家庄四药有限公司,批号:2005203201),其余实验用水为重蒸馏水;羧甲基纤维钠(CMC-Na,批号:200401,安徽山河药用辅料股份有限公司);MB-1762B大鼠Toll样受体4(TLR4)、NF-κB p65 酶联免疫吸附(ELISA)试剂盒(批号:2021053106,江苏酶标生物科技有限公司);IL-6、TNF-α酶联免疫吸附(ELISA)试剂盒(江苏菲亚生物科技有限公司)。
1.4 动物造模、分组及给药
36只SD大鼠按照体质量随机分为模型组30只,空白对照组6只。空白对照组给予普通饲料喂养3天后,按体质量换算后予单次腹腔注射等量柠檬酸-柠檬酸钠缓冲液。除空白对照组外其余大鼠给予高脂高糖饲料+饮水饱和适应性喂养3天后,予单次腹腔注射STZ 60 mg/kg(STZ临用前用0.1 mol/L柠檬酸缓冲液溶解,pH=4.5,4 ℃,配制成1%STZ溶液,避光冰浴中进行)。72 h后,尾静脉采血,用快速血糖仪测空腹血糖(Fasting blood glucose,FBG),FBG稳定于16.7 mmol/L及以上,列入观察对象。同时用尿糖试纸测定尿糖,尿糖强阳性,继续给予高脂高糖饮食8周,24 h尿蛋白定量≥30 mg/dL/24 h,即提示糖尿病肾病造模成功[6-7]。
造模成功后大鼠随机分为5组,每组6只:DN模型组、DN模型+降糖益肾丸组(高剂量组)、DN模型+降糖益肾丸组(中剂量组)、DN模型+降糖益肾丸组(低剂量组)、DN模型+盐酸二甲双胍+厄贝沙坦组。分组后开始给药,每日定时灌胃1次,空白对照组、DN模型组给予等体积蒸馏水,连续给药4周。降糖益肾丸按成人等效剂量换算成大鼠每日灌胃剂量为低剂量组(1.35 g/kg/d)、中剂量组(2.7 g/kg/d)、高剂量组(5.4 g/kg/d)。阳性药盐酸二甲双胍180 mg/kg/d、厄贝沙坦27 mg/kg/d。各组大鼠均于相应给药4周后收集血清、肾组织样本保存,备用。
1.5 指标检测
给药结束后,分别对各组大鼠进行血液采集,血浆注入含有10%乙二胺四乙酸(EDTA)二钠的离心管里,混匀后在4 ℃条件下3 000 r/min离心10 min,取上层血清样品于-80 ℃冰箱中保存,备用。取血后处死各组大鼠,于冰上摘取肾脏,剥离肾包膜,滤纸吸干血迹后,将各肾样本取出切割,分别称取适量,进行冰浴上匀浆;3 000 r/min低温离心15 min,收集上清,分装后一份待检测,其余用液氮迅速冷冻,于-80 ℃冰箱中保存,备用。
1.5.1 血清炎性因子IL-6和TNF-α的含量检测 将各组大鼠血样取出静置,解冻融化后保持 2~8 ℃的温度,3 000 r/min离心15 min,取上层血清转移,分装备用。检测严格按照酶联免疫(ELISA)试剂盒说明书进行。
1.5.2 肾TLR4、NF-κB p65的含量检测 将各组大鼠肾样本取出切割后,分别称取1 g,选用组织匀浆器,加9 mL的匀浆液来进行冰浴上匀浆(0.1 g/mL)。匀浆液选取PBS(pH=7.2~7.4,浓度为0.01 mol/L);3 000 r/min离心15 min,收集上层血清,分装后待检测。检测严格按照酶联免疫(ELISA)试剂盒说明书进行。
1.6 数据处理
对各组相应指标的原始数据用均数±标准差表示,采用SPSS 20.0软件对数据进行统计分析;方差齐者采用LSD(L)法进行统计学分析,方差不齐者用Tamhane检验,组间两两比较用q检验。采用双侧检验,检验水准α=0.05。
2 结果
2.1 组大鼠血清炎症因子IL-6、TNF-α表达比较
与对照组比较,模型组大鼠IL-6、TNF-α表达均显著升高(P<0.01)。与模型组比较,阳性药组与中、高剂量组大鼠IL-6、TNF-α表达均显著下降,低剂量组大鼠IL-6、TNF-α表达亦下降(P<0.01或P<0.05)。与中、高剂量组比较,低剂量组大鼠IL-6、TNF-α表达显著升高(P<0.01)。与阳性药组比较,中、高剂量组大鼠IL-6、TNF-α表达亦升高,低剂量组大鼠IL-6、TNF-α表达显著升高(P<0.01)。见表1。
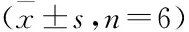
表1 各组大鼠血清炎症因子表达比较
2.2 各组大鼠肾TLR4和NF-κB p65表达比较
与对照组比较,模型组大鼠TLR4、NF-κB p65表达均显著升高(P<0.01)。与模型组比较,阳性药组与中、高剂量组大鼠TLR4、NF-κB p65表达均显著下降,低剂量组大鼠TLR4、NF-κB p65表达亦下降(P<0.01)。与中、高剂量组比较,低剂量组TLR4、NF-κB p65表达显著升高(P<0.01)。与阳性药组比较,中、高剂量组大鼠TLR4、NF-κB p65表达亦升高,低剂量组大鼠TLR4、NF-κB p65表达显著升高(P<0.01)。见表2。
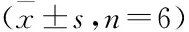
表2 各组大鼠肾TLR4和NF-κB p65表达比较
3 讨论
DN属中医学“消渴”范畴,消渴日久,热灼津亏,伤阴耗气,气阴两虚。气虚血运无力则涩滞,滞而成瘀,气血失调致气阴更虚,血脉更瘀。血瘀内阻,阻碍三焦水道运行[8]。《济生方》言:“消渴之疾,皆起于肾。”肾居下焦,水湿内聚,湿邪重浊黏腻,易于化热,明代医家吴昆在《医方考》中云:“下焦之病,责于湿热。”水湿不化,焦灼津液,津液失于运化,瘀血内生,瘀阻肾络。久瘀肾络胶结化毒,毒邪阻络,瘀毒互结内蕴,毒邪伤络,毒损肾络[9]。因此,DN基本病机为“虚、瘀、毒”,以益气养阴、化瘀解毒论治。本研究采用降糖益肾丸(本院制剂,批准文号:湘药制字Z20080821)以化瘀解毒为重要治则,控制DN症状疗效确切,在多年临床应用中无不良反应,安全性高。方中生地、山药益气养阴,为本方之君药;丹参、丹皮活血化瘀,黄芩、黄连除湿清热解毒,均为臣药,配合君药以活血化瘀、泄浊解毒;诸药合用,通过对人体气血津液的调整而达到“阴平阳秘”,共奏益气养阴、化瘀解毒之功[5]。瘀毒损伤肾络贯穿DN的发生发展过程始终,早期表现为肾小球毛细血管数量增加,GECs数量增多、肿胀、功能受损,导致血管渗透性增加,血浆蛋白漏出,与肾络受损的中医理论相符合[10]。炎性因子属中医“毒邪”范畴[11]。DN“毒”的特征性为肾组织内高度表达的单核细胞趋化因子、NF-κB等细胞因子的变化,与中医学提到的消渴病日久不愈、脏腑功能失调,导致瘀、热、湿等病理产物瘀阻血脉而成的“毒”具有相似性[12]。
本研究采用的降糖益肾丸所含丹参药味能有效降低高糖诱导大鼠肾细胞TLR4蛋白表达,下调TLR4/NF-κB信号通路并降低下游相关信号分子表达,对糖尿病状态下的大鼠肾组织有保护作用[13]。方中黄连能降低链脲佐菌素(STZ)所致DN模型大鼠的糖化血红蛋白、血清TNF-α含量,抑制肾脏NF-κB表达及增强过氧化物酶增殖物受体-γ(PPAR-γ)mRNA表达缓解糖尿病肾脏病变[14-15]。方中君药生地的主要有效成分环烯醚萜苷梓醇可缓解DN的蛋白尿,通过调节TLR4/MyD88和p38MAPK信号传导途径阻止NF-κB活化,改善炎症损伤[16]。
综上所述,以化瘀解毒为重要治则的降糖益肾丸治疗瘀毒损伤肾络型DN有效,能显著降低DN大鼠的肾炎症水平,其作用可能与下调TLR4和NF-κB p65、IL-6、TNF-α等炎性因子表达相关。

