鸢尾素介导抗炎和抗氧化作用的机制
涂永梅,于卫华,彭 洁,刘江正,刘 瑞,吴 昊,孔德钦,何改花,李文丽,王 冲
(1.陕西中医药大学公共卫生学院,陕西 咸阳 712046;2.空军军医大学军事预防医学系军事毒理学与防化医学教研室,特殊作业环境危害评估与防治教育部重点实验室,陕西省自由基生物学与医学重点实验室,陕西 西安 710032)
炎症是临床上最常见病理过程,其本质是炎性细胞浸润和炎症因子的释放。巨噬细胞(macrophages,mø)是机体最主要的炎症细胞,在多数器官和组织中大量分布,按功能可分为促炎(M1)型和抗炎(M2)型两大类[1-2]。以往研究显示,在脂多糖(lipopolysaccharide,LPS)或γ干扰素(interferon,IFN-γ)等因子刺激下,巨噬细胞发生M1 型极化,生成大量肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、一氧化氮(NO)等促炎因子,是机体杀灭细菌和抗病毒的重要武器。相反,在IL-4等刺激下巨噬细胞发生M2 型极化,可分泌大量抗炎因子如白细胞介素10(interleukin-10,IL-10)、精氨酸酶(arginase 1,Arg-1)和甘露糖受体206(亦称CD206)等,参与机体炎症消除和创伤修复[3]。研究表明,巨噬细胞及其介导的炎症反应在肥胖、肿瘤、糖尿病、心脑血管疾病和神经退行性疾病中发挥关键作用[4-5]。其中,M2型巨噬细胞可通过生成抗炎因子调控机体炎症消退,被认为是炎症疾病治疗的新靶点。
鸢尾素(irisin,IR)是由112 个氨基酸组成的多肽,2012 年美国哈佛大学布鲁斯团队首次发现[6]并证实了运动后鸢尾素水平显著上升。研究表明人体锻炼后肌肉可分泌过氧化物酶体增殖物激活受体γ共激活因子1(proliferator-activated-receptor-γ co-activator 1α,PGC1α),进而刺激纤维连结蛋白III 型域包含蛋白5(FNDC5) mRNA 表达上调,FNDC5 蛋白在经过水解、糖基化和二聚化后,释放包含III型纤连蛋白结构域的新蛋白质,即为鸢尾素。而鸢尾素可激活过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor-γ,PPAR-γ),促进白色脂肪的棕色化,增强机体热量消耗,进而改善肥胖和糖尿病。最新研究[7]发现20 min的中等强度运动后,人体血液中TNF-α等炎症因子水平降低,提示运动具有抗炎作用。而鸢尾素作为一种运动因子,可能在炎症反应和氧化损伤过程中发挥关键调控作用。鸢尾素干预可抑制核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性小体和核因子-κB(nuclear factor kappa-B,NF-κB),阻断M1 型巨噬细胞促炎信号的转录调控[8],但鸢尾素是否影响巨噬细胞M2型极化尚不清楚。因此,本文旨在研究鸢尾素对巨噬细胞抗炎和抗氧化作用,即巨噬细胞M2 型极化的影响及其调控机制,为鸢尾素相关临床应用提供依据。
1 材料与方法
1.1 材 料
1.1.1 主要试剂小鼠巨噬细胞系(RAW264.7)由空军军医大学细胞库提供;鸢尾素购自山东金威斯生物(00170-01-100),纯度98%;LPS 购自Sigma 公司;2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorofluorodiacetate,DCFH-DA)荧光探针购自美国Sigma 公司;Mito-LX 荧光探针由西北大学柔性电子研究所赠送;小鼠IL-10、Arg-1和CD206酶联免疫吸附(ELISA)试剂盒购自上海科兴生物;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽(glutathione,GSH)酶活性试剂盒购自武汉塞维尔公司;PPAR-γ抑制剂T0070907 购自中国MCE 公司(HY-13202);PPAR-γ 抗体购自美国Abcam 公司;BCA 蛋白定量试剂盒购自美国Thermo 公司;总RNA提取试剂盒、反转录试剂盒和扩增试剂购自北京TIANGEN 公司;DMEM 培养液、胎牛血清、0.25%胰蛋白酶、PBS等常用试剂购自美国Sigma公司。
1.1.2 仪器超净台(ESCO,新加坡);CO2培养箱(Thermo Scientific,美国);多功能酶标仪(FLUOstar Omega,德国);激光共聚焦显微镜(Olympus,日本);流式细胞仪(BD,美国);PCR 仪、电泳和凝胶成像系统(Bio-Rad,美国)。
1.2 方 法
1.2.1 RAW264.7 细胞培养及炎症模型建立RAW264.7 细胞加入DMEM 高糖培养基(含10%胎牛血清),置于37 ℃、CO2体积分数为5%的孵箱中培养。100 ng/mL LPS处理细胞24 h后,建立炎症模型[9]。
1.2.2 实时荧光定量PCR 测定相关因子mRNA 的表达接种RAW264.7 细胞于6 孔板,根据文献[10]提示,选用50、100、200 ng/mL 鸢尾素处理细胞24 h 后采用实时荧光定量PCR(quantitative real-time PCR,qPCR)检测IL-10 mRNA 的相对表达水平,以选择合适鸢尾素剂量。各组细胞处理完毕后,使用TIANGEN试剂盒提取细胞总RNA,反转录获得cDNA。小鼠IL-10、Arg-1、CD206、PPAR-γ、β-actin、TNF-α、IL-6、HO-1、SOD2 和Nrf2 的引物由北京擎科生物合成,序列如表1 所示。以cDNA 为模板使用SYBR Green PCR master Mix 进行实时荧光定量PCR(quantitative real-time PCR,qPCR)扩增,使用两步法,扩增程序设定如下:95 ℃、30 s;95 ℃,5 s,60 ℃、30 s,40 个循环。以β-actin 为内参,按2-ΔΔCT计算mRNA相对表达量。
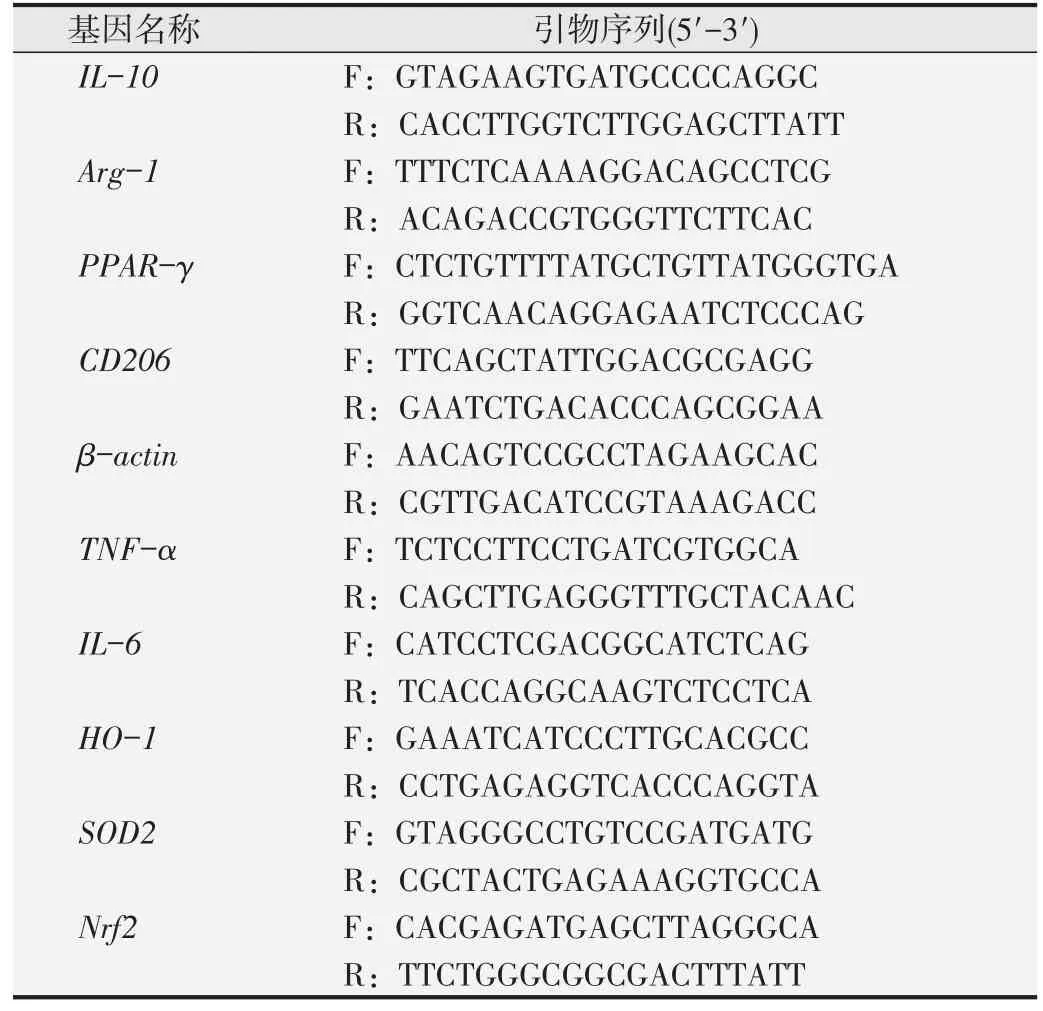
表1 引物序列信息
1.2.3 ELISA 检测细胞上清IL-10、Arg-1 和CD206浓度实验设200 ng/mL 鸢尾素处理细胞0、24 和48 h共3组。样品处理完成后收集细胞上清,标准品按说明书稀释液为0、25、50、100、200、400 pg/mL,按照试剂盒说明书加入待测样品和标准品,37 ℃条件下孵育2 h,清洗后加入检测工作液,37 ℃孵育30 min,酶标仪测定吸光度D(450)值,通过标准曲线计算样品中IL-10、Arg-1和CD206浓度。
1.2.4 巨噬细胞形态和促炎因子表达的检测实验设对照组、100 ng/mL LPS 组和200 ng/mL 鸢尾素+100 ng/mL LPS 联合组处理巨噬细胞24 h后,倒置显微镜观察巨噬细胞形态。用200 mg/mL 鸢尾素预处理4 h,再用100 ng/mL LPS 刺激巨噬细胞24 h 后,采用qPCR 检测TNF-α 和IL-6 mRNA 的 表达,方法 同1.2.2。
1.2.5 线粒体ROS 水平检测实验设对照组、100 ng/mL LPS 组、200 ng/mL鸢尾素组和200 ng/mL鸢尾素+100 ng/mL LPS 联合组共4 组,每组处理细胞24 h。再用两种荧光染色进行线粒体ROS 水平的检测。DCFH-DA 是一种通用活细胞活性氧(reactive oxygen species,ROS)指示探针,本身无荧光,但被细胞酯酶水解后形成DCF 可发出绿色荧光。Mito-LX 是新型线粒体靶向荧光探针,可选择性进入线粒体识别H2O2,发出红色荧光。细胞处理后分别加入终浓度为5 μmol/L 的DCFH-DA 和Mito-LX 荧光探针,37 ℃条件下孵育30 min,PBS 清洗后,上流式细胞仪检测荧光信号。其中,DCF 选择FL1-A 通道,而Mito-LX 选择FL2-A通道。
1.2.6 抗氧化酶活性检测细胞分成200 ng/mL 鸢尾素处理细胞0、24 和48 h 组共3 组,处理完毕后离心收集细胞,用qPCR 检测SOD2 和HO-1 mRNA 的表达。另外分别按照SOD、CAT和GSH试剂盒说明书进行操作,检测抗氧化酶活性。
1.2.7 免疫荧光检测Nrf2 和PPAR-γ亚细胞定位细胞分为对照组和200 ng/mL 鸢尾素组共2 组,处理细胞24 h,分别检测Nrf2 和PPAR-γ的细胞定位。细胞分别接种于共聚焦培养皿,处理完毕后,用4%的多聚甲醛固定30 min,0.1% Triton X-100 透膜10 min。5%的蛋白封闭液室温孵育30 min。加入1∶100稀释的兔来源Nrf2和PPAR-γ一抗,37 ℃湿盒中孵育过夜。PBS 洗细胞3 次,加入1∶100 稀释的Cy3 标记羊抗兔二抗,37 ℃孵育2 h。最后加入终浓度为10 μg/mL 的DAPI,37 ℃染色30 min。PBS 洗涤细胞3 次,激光共聚焦显微镜检测荧光强度,Cy3(红色)Ex/Em:550 nm/570 nm;DAPI(蓝色)Ex/Em:340 nm/488 nm。
1.2.8 qPCR 和Western blot 测定细胞中PPAR-γ表达细胞分成200 ng/mL 鸢尾素处理细胞0、24 和48 h组共3组,处理完毕后收集细胞,一部分细胞用qPCR检测PPAR-γ mRNA的表达;一部分细胞按100∶1∶1比例加入细胞组织快速裂解液、丝氨酸蛋白酶抑制剂和磷酸酶抑制剂,12 000 r/min 离心10 min,提取蛋白后BCA法定量,分装保存于-80 ℃。然后配制SDS-PAGE 凝胶,按每孔40 μg 加入蛋白样品,垂直电泳仪,将蛋白转至PVDF 膜上,50 g/L 脱脂牛奶室温封闭2 h。按照1∶1 000 浓度加入PPAR-γ一抗,4 ℃摇床过夜,TBST 洗涤3 次,加入二抗(1∶5 000),室温孵育2 h,TBST 洗涤后显影成像,计算蛋白相对含量。
1.2.9 使用PPAR-γ特异性抑制剂T0070907 验证鸢尾素介导PPAR-γ信号激活为阐明PPAR-γ在鸢尾素抗炎中的关键作用,使用PPAR-γ特异性抑制剂T0070907 干预。实验设对照组,5、10 及30 μmol/L T0070907 组共4 组,将细胞接种于6 孔板,处理24 h后,检测不同浓度T0070907对抗炎因子相对表达水平变化的影响。在明确了T0070907最佳剂量后,细胞分对照组,T0070907 组及T0070907+鸢尾素组共3 组,处理24 h 后,采用qPCR 检测抗炎因子mRNA 表达变化,方法同1.2.2。
1.3 统计学方法
应用GraphPad Prim 8.0 软件分析实验数据,One-way ANOVA 用于方差齐性检验,t检验用于组间两两比较,数据用表示,以α=0.05为检验水准。
2 结果
2.1 鸢尾素促进RAW264.7细胞M2型极化及抗炎因子释放
结果见图1A。200 ng/mL 的鸢尾素抗炎效果最明显,因此选择这一剂量进行后续实验。qPCR 结果表明,与对照组相比,200 ng/mL鸢尾素刺激24和48 h后巨噬细胞M2 型标志物CD206 表达明显升高(P<0.05),抗炎因子IL-10和Arg-1 mRNA表达均增强(P<0.05),见图1B。ELISA 检测结果发现200 ng/mL 鸢尾素处理后培养上清中CD206、IL-10和Arg-1浓度较对照组显著增多(P<0.05),结果见图1C~E。上述研究提示,鸢尾素刺激后巨噬细胞发生M2 型极化,并释放大量抗炎因子。
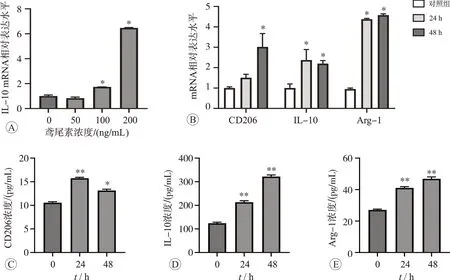
图1 鸢尾素刺激RAW264.7后CD206和抗炎因子表达变化
2.2 鸢尾素抑制LPS 介导的RAW264.7 细胞促炎因子的水平
鸢尾素和脂多糖处理后RAW264.7 细胞形态学变化见图2A。RAW264.7 细胞是小鼠巨噬细胞系,正常培养条件下贴壁生长,形态为圆形或椭圆形,体积较小。在LPS 刺激下,细胞会被激活并伴有形态和功能的改变,主要表现为形态不规则,胞体增大,大量伪足出现。而加入鸢尾素处理后,细胞数目增多,形态改变不明显。qPCR 检测细胞内TNF-α和IL-6 水平,结果见图2B~C。与对照组比较,LPS刺激后TNF-α和IL-6显著升高(P<0.05);与LPS组相比,鸢尾素干预可有效抑制LPS 介导巨噬细胞促炎因子的释放(P<0.05)。上述结果表明,鸢尾素可以有效抑制LPS 诱导的炎症反应。
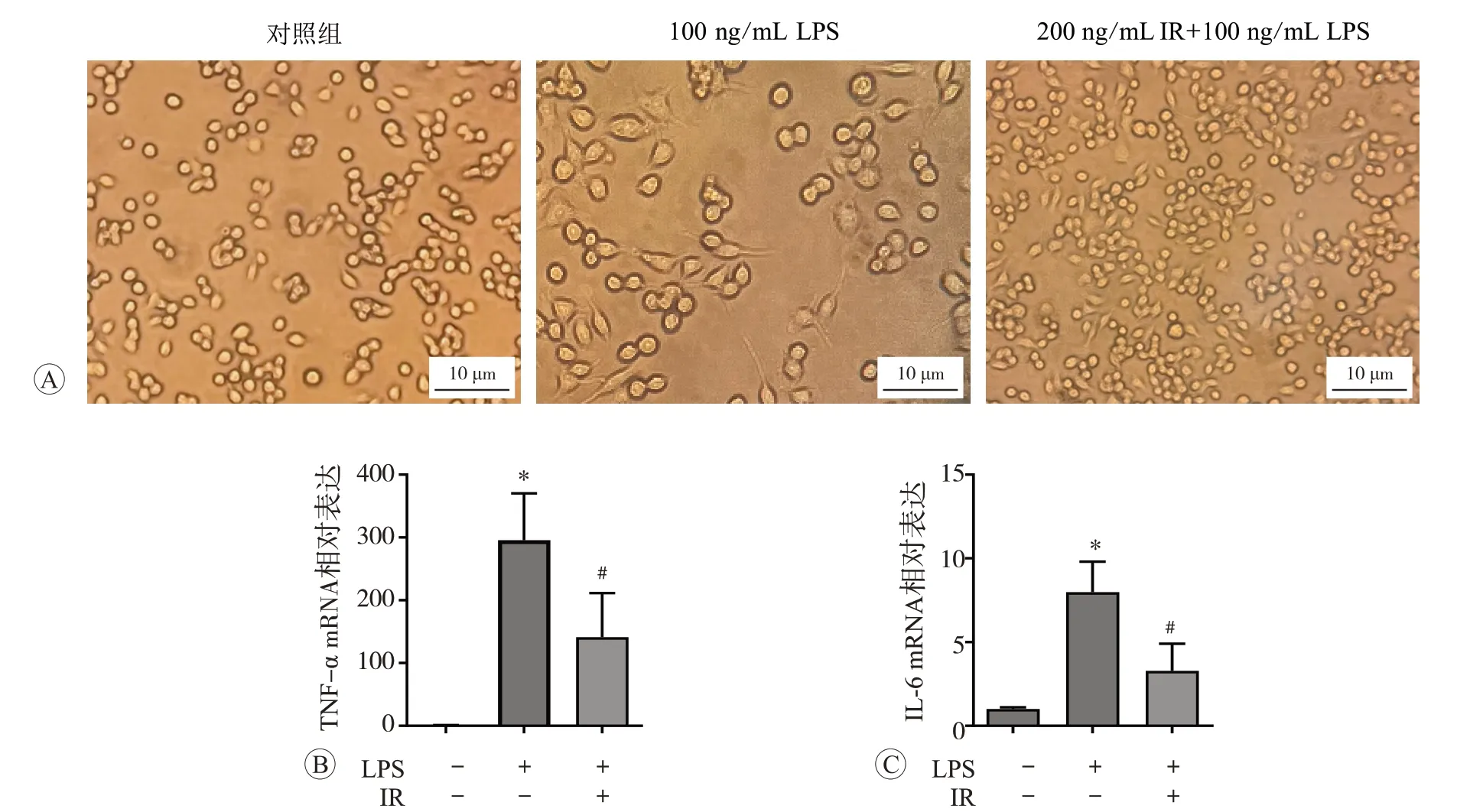
图2 鸢尾素对LPS刺激RAW264.7细胞形态变化及促炎因子TNF-α和IL-6表达的影响
2.3 鸢尾素抑制LPS 诱导的RAW264.7 细胞ROS 生成增多
采用DCFH-DA 和Mito-LX 染色检测细胞和线粒体内ROS 水平,结果见图3。与对照组比较,100 ng/mL LPS 处理后细胞DCF 和Mito-LX 荧光强度升高(P<0.05);与LPS组相比,给予200 ng/mL 鸢尾素可抑制细胞内线粒体水平(P<0.05)。上述结果表明鸢尾素具有抗氧化作用,可抑制LPS诱导巨噬细胞ROS 生成增多。
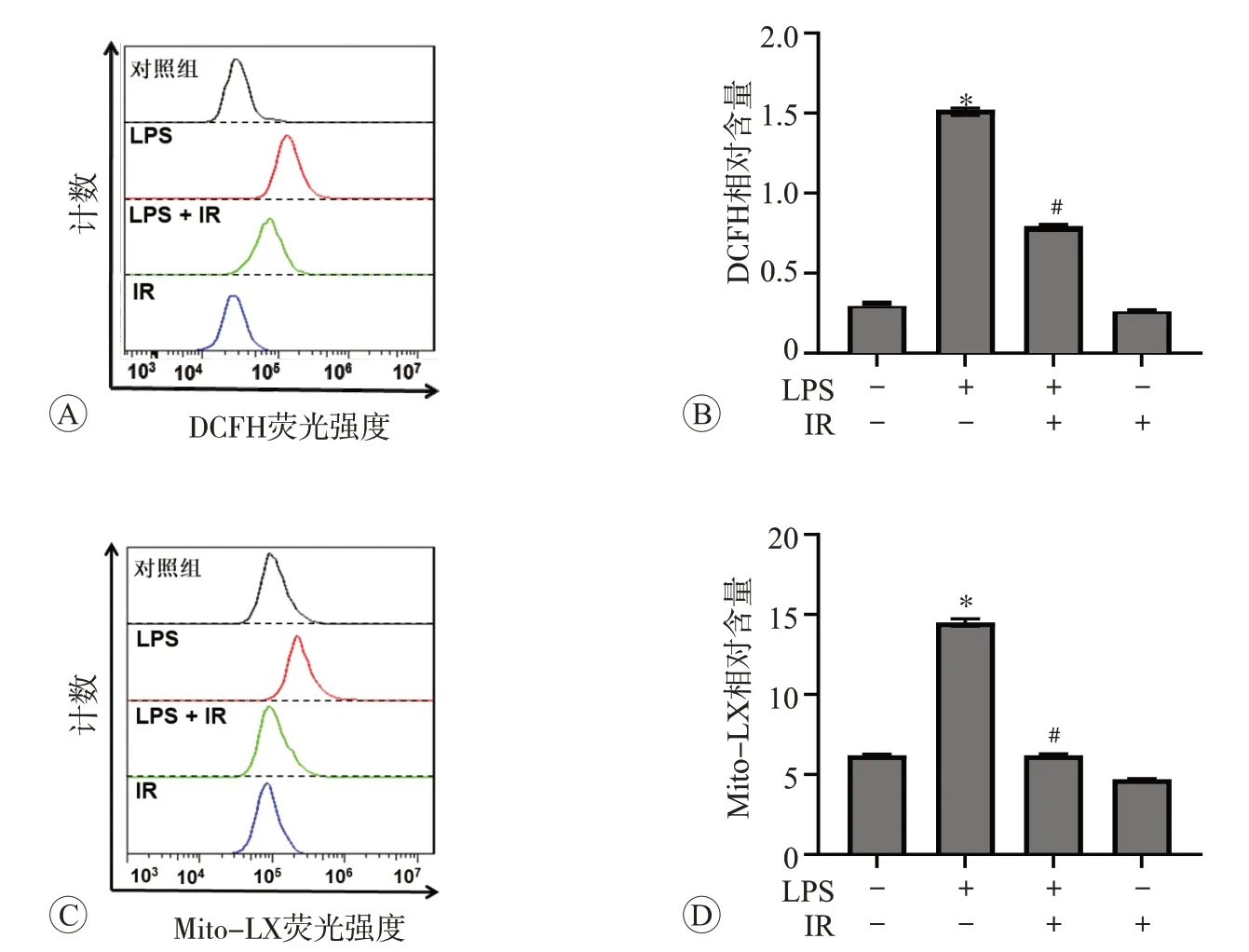
图3 鸢尾素对脂多糖诱导RAW264.7细胞ROS生成的影响
2.4 鸢尾素增强RAW264.7 细胞Nrf2 及下游抗氧化酶表达
Nrf2及下游抗氧化酶系统是细胞内对抗ROS 的重要因子。免疫荧光检测结果见图4A,200 ng/mL 鸢尾素处理RAW264.7 细胞48 h,细胞内Nrf2 荧光亮度增强,且发生明显核转位。qPCR检测发现,Nrf2下游抗氧化酶SOD2 和HO-1 mRNA 升高(P<0.05)(图4B)。进一步检测表明,与对照组相比,鸢尾素组SOD和CAT酶活性、以及GSH 含量均显著增加(P<0.05),结果见图4C~E。上述结果证明,鸢尾素促进Nrf2 及下游抗氧化酶表达。

图4 鸢尾素对RAW264.7细胞Nrf2及下游抗氧化酶表达的影响
2.5 鸢尾素增强抗炎启动因子PPAR-γ的表达及核转位
PPAR-γ是调控M2型巨噬细胞抗炎因子转录表达的关键调控分子[11],在正常情况下表达较低且存在于胞质,与配体结合后可转移至细胞核启动下游抗炎信号[12]。免疫荧光结果表明,200 ng/mL鸢尾素处理细胞后PPAR-γ荧光增强,且出现大量核内聚集现象(图5A)。qPCR 和Western blot 进一步证实,鸢尾素促进了PPAR-γ表达升高(P<0.05)(图5B~D)。上述结果证实,鸢尾素可增强PPAR-γ信号的转录激活。

图5 鸢尾素对RAW264.7细胞PPAR-γ表达和定位的影响
2.6 鸢尾素的抗炎效应依赖于调控PPAR-γ信号激活
分别使用5、10、30 μmol/L PPAR-γ特异性抑制剂T0070907 干预细胞24 h 后,采用qPCR 检测IL-10、Arg-1 和PPAR-γ mRNA 的相对表达水平。结果显示,30 μmol/mL T0070907 效果最显著(P<0.05,图6A),因此,我们选用此剂量进行后续实验。本研究实验结果已证实200 ng/mL 鸢尾素促进了CD206 和Arg-1 mRNA 表达,而用30 μmol/mL T0070907 处理24 h 后,阻断了鸢尾素介导抗炎因子CD206 和Arg-1 mRNA的表达升高(P<0.05)(图6B)。此结果表明,鸢尾素介导的抗炎反应依赖于PPAR-γ信号激活。
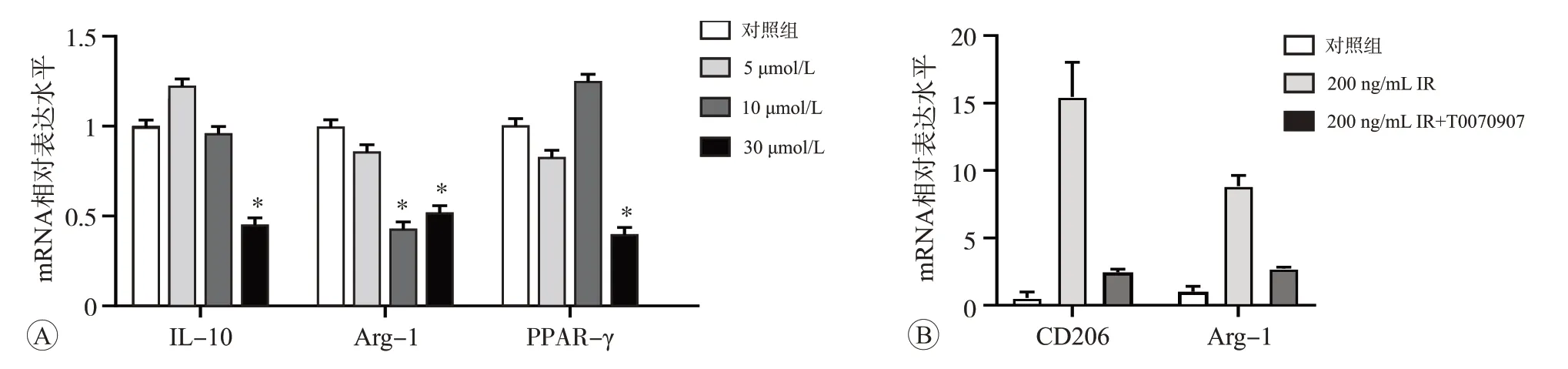
图6 T0070907对鸢尾素介导抗炎效应的影响
3 讨论
炎症反应是机体重要的防御反应,也是临床上常见的病理过程,90%以上临床疾病均存在炎细胞浸润和炎症病理过程[12]。巨噬细胞作为机体最主要的炎症效应细胞,广泛存在于各组织器官,其募集和激活在维持机体健康中发挥关键作用。研究表明,巨噬细胞M2 型激活后可释放IL-10 和Arg-1 等抗炎因子,参与调控炎症消退和创伤愈合[13]。因此,寻找安全有效的M2型巨噬细胞刺激因子是疾病治疗的新思路。
鸢尾素是运动后由肌肉组织大量分泌的因子,对于维持机体健康具有诸多有益作用。研究发现,将鸢尾素注射给高脂饮食小鼠,可促进白色脂肪组织棕色化,增强脂肪消耗,显著改善动物肥胖症状[14]。而糖尿病患者血液中鸢尾素水平降低,给予鸢尾素可显著降低血糖,增强胰岛素敏感性[15-16]。此外,鸢尾素还能改善病理性心脏肥大,抑制缺血再灌注损伤导致的心肌细胞凋亡[17]。最新研究提示,适度运动有助于降低机体促炎因子,改善机体炎症反应[18]。鸢尾素可降低肥胖和糖尿病体内的炎症反应,改善LPS 诱导脓毒症小鼠的肝脏、肺脏、心脏和肾脏炎症,提示鸢尾素可能是运动过程中产生的抗炎因子。我们实验发现,鸢尾素处理RAW264.7 细胞CD206 表达显著升高,并释放IL-10 和Arg-1 抗炎因子;此外,鸢尾素可抑制LPS诱导的TNF-α和IL-6 mRNA表达升高,提示鸢尾素具有抗炎保护作用。
研究表明[19-20],氧化还原与炎症反应关系密切,ROS 剂量不同对炎症信号的影响也存在差异,当ROS增多或抗氧化减弱有利于巨噬细胞促炎反应,而ROS减少或抗氧化增强有助于巨噬细胞抗炎分化。在病理损伤条件下,ROS 可通过NF-κB、NLRP3 和COX2 等多种炎症信号通路,调控M1 型巨噬细胞促炎反应。给予抗氧化剂能清除ROS 并阻断LPS诱导巨噬细胞促炎反应。同时,抗氧化剂还能促进巨噬细胞M2 型极化,通过分泌抗炎因子改善肥胖、心肌梗死、糖尿病和急性肺损伤。研究表明,鸢尾素处理可抑制ROS水平,减轻低密度脂蛋白造成的血管损伤和血管紧张素II 引起的心脏纤维化。鸢尾素可通过激活Akt 信号通路来减轻氧化应激,改善糖尿病小鼠的心肌损伤[21]。Nrf2是细胞内氧化还原系统的关键调控因子,其磷酸化和和转位对于下游抗氧化酶谱的转录启动具有至关重要的作用。我们发现200 ng/mL 鸢尾素刺激可显著增强Nrf2 及下游抗氧化酶SOD2 和HO-1 表达,降低LPS 诱导的巨噬细胞ROS 生成。因此,我们认为鸢尾素通过激活Nrf2启动抗氧化信号,进而参与调控巨噬细胞抗炎反应。
PPAR-γ属于核受体转录因子超家族的关键蛋白,主要通过配体结合途径激活,参与调控脂肪细胞分化和脂肪酸代谢,在肥胖和糖尿病等疾病进展中发挥重要作用。1988 年,Ricote 课题组首次在Nature 杂志报道[18],PPAR-γ信号激活可抑制巨噬细胞炎症,改善小鼠脓毒症。2014 年法国巴斯德研究所研究报道[21],PPAR-γ激活可促进巨噬细胞M2 型极化,并上调CD206、IL-10 和Arg-1 等抗炎因子表达。研究表明,罗格列酮等PPAR-γ激动剂可促进巨噬细胞的抗炎反应,改善多种急慢性炎症疾病[22-23]。上述结果提示,PPAR-γ是巨噬细胞抗炎反应的关键调控因子。以往报道[24]认为,鸢尾素处理后可激活PPAR-γ,进而调控脂肪酸和葡萄糖代谢的稳态,改善肥胖和糖尿病。我们的研究则证实,鸢尾素刺激巨噬细胞中PPAR-γ的mRNA 和蛋白表达显著增强,且出现明显核转位,而PPAR-γ活性抑制剂T0070907 可逆转鸢尾素介导的抗炎作用。因此,我们认为PPAR-γ信号激活可能在鸢尾素介导的抗炎反应中发挥关键作用。
我们前期研究发现,炎症反应与氧化应激之间存在交互调控作用,炎症过程中会释放大量ROS,而ROS也会促进多种炎症信号的转录表达,二者易形成恶性循环。同时,炎症信号和氧化还原具有独立的调控机制,炎症反应主要受到NF-κB和NLRP3等通路影响;而抗氧化信号主要受到以Nrf2为核心的抗氧化酶链和ROS 生成酶链的调控[25]。因此,单纯使用抗炎和抗氧化药物对于治疗炎症性疾病效果有限,无法根除问题。本研究发现,鸢尾素可通过激活PPAR-γ调控抗炎因子转录表达,并可增强Nrf2及下游抗氧化酶表达,兼具抗炎和抗氧化的双重功效,有望成为炎症疾病治疗的候选药物。然而,本文也存在一定局限性,我们仅在RAW264.7 细胞系上验证了鸢尾素介导抗炎和抗氧化作用及其分子机制,应在多种细胞和动物水平进一步明确其功能。此外,临床上急慢性炎症疾病治疗,应首先考虑控制感染、创伤和中毒等炎症因子产生的源头。
——鸢尾花

