IRAK4在对乙酰氨基酚诱导的急性肝细胞损伤中的作用及其机制
蔡 娇,孔德钦,龙 子,彭 洁,刘江正,刘 瑞,海春旭
(空军军医大学军事毒理学与防化医学教研室,陕西 西安 710032)
药物性肝损伤是一个严重的临床问题[1]。对乙酰氨基酚(acetaminophen,APAP),又名扑热息痛,是临床常用的解热镇痛药,作为一种非处方药极易获得,在世界范围内被广泛使用。APAP 在治疗剂量下通常是安全的,但过量使用则易造成急性肝衰竭(acute liver failure,ALF)[2-3]。ALF 危及生命,肝移植成了唯一的救治途径[4]。目前,APAP所致急性肝细胞损伤的机制尚不完全清楚,有研究认为氧化应激和炎症反应是其重要的生物学机制[5],而线粒体又在其中发挥了关键作用,因此,探究其确切机制非常必要。
研究发现Toll 样受体(Toll-like receptors,TLRs)/IL-1R 信号通路在非酒精性脂肪性肝炎中起关键作用[6]。白细胞介素-1 受体相关激酶4(interleukin-1 receptor-associated kinase 4,IRAK4)作为TLR/IL-1R介导级联信号激活的主要激酶,是IRAK 家族重要的信号分子[7]。IRAK4 对于机体正常发挥先天性免疫和适应性免疫是必不可少的[8]。另外,IRAK4 在心脏炎症[9]和类风湿性关节炎[10]中也发挥着重要作用,被认为是炎症性疾病一个新的潜在治疗靶点[11]。然而,在APAP 诱导的急性肝细胞损伤中IRAK4 的作用并不清楚。本实验以人肝细胞系L02 为实验对象,初步探究了IRAK4 分子在APAP 诱导的急性肝细胞损伤中的作用。
1 材料与方法
1.1 细胞系
人正常肝细胞系L02 由中国科学院上海细胞生物所提供,用含10% FBS 和1%双抗的RPMI-1640 培养基,于37 ℃、CO2体积分数为5%及饱和湿度条件下培养。取处于对数生长期的L02 细胞,用0.25%的胰蛋白酶消化,再以含10%胎牛血清(FBS)和1%双抗的RPMI-1640培养基等体积中和,将细胞吹打均匀,稀释成单细胞悬液备用。
1.2 主要试剂与仪器
APAP和二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma 公司;RPMI-1640 培养基、双抗(青霉素及链霉素)、PBS 以及0.25%胰蛋白酶均购自Hyclone 公司;胎牛血清(FBS)购自Gibco 公司;CCK-8 购自南京恩晶生物科技有限公司;Annexin V/PI 双染凋亡试剂盒购自南京凯基生物公司;JC-1染料购自南京建成生物工程研究所;MitoSOX 和转染试剂购自Thermo Fisher 公司;BCA 蛋白定量试剂盒购自Glpbio 公司;Tubulin、IRAK4和羊抗兔IgG(H&L)-HRP(二抗)均购自Biorbyt公司;实时荧光定量PCR(quantitative real-time PCR,qPCR)试剂盒购自天根生化科技有限公司;小干扰RNA产品购自北京擎科生物科技有限公司。
主要仪器有:医用型洁净工作台(SW-CJ,苏州安泰空气技术有限公司);CO2培养箱(Thermo for 3111/371,美国);正置荧光显微镜(OLYMPUS BX51,Olympus 公司,日本);全波段酶标仪(infinite M200 PRO,奥地利);流式细胞仪(BD Accuri C6,美国);全自动高速冷冻离心机(3K30,Sigma公司,德国);实时荧光定量PCR 仪(Bio-Rad CFX96,美国);凝胶成像系统(Bio-Rad,美国)。
1.3 方 法
1.3.1 CCK-8 法检测L02 细胞的活力将单细胞悬液以4×105个/mL 的浓度接种于96 孔板,每孔100 μL,接种时注意将细胞混匀,培养板四周用PBS 填充,每组设置6 个重复孔。细胞全部贴壁后,分别用2.5、5、10、20、40、80 mmol/L(200 μL/孔)APAP 作用24 h,另用20 mmol/L APAP(200 μL/孔)分别处理0、6、12 和24 h 后,吸弃APAP 并加入CCK-8 工作液,每孔100 μL,37 ℃作用2 h 后,用全波段酶标仪测定450 nm 处的吸光度,按照CCK-8 试剂盒说明书计算各组L02细胞的存活率。
1.3.2 Annexin V/PI 双染色法检测细胞凋亡将L02细胞以1×105/mL的浓度接种于6孔板,每孔2 mL,待细胞生长至铺满约80%孔底面积时,加入2 mL 终浓度为20 mmol/L 的APAP,然后分别在0、6、12 和24 h 收集细胞,用PBS 洗两次后则按照Annexin V/PI 试剂盒说明书的步骤,每个样品分别加入500 μL 结合缓冲液、Annexin V 和PI 各5 μL,室温避光孵育15 min,使用流式细胞仪检测细胞凋亡情况,每组设3个重复样。数据获取和分析均采用CFlowPlus软件。
1.3.3 线粒体活性氧和膜电位的检测MitoSOX 是活细胞中的一种特异性靶向线粒体的新型荧光染料[12]。MitoSOX 红色试剂渗透入活细胞中,并选择性靶向线粒体,而后被超氧化物快速氧化,氧化产物则结合核酸并产生大量红色荧光。红色荧光的强弱可反映线粒体活性氧的水平。红色荧光越强,表明线粒体活性氧水平越高,反之,则表明线粒体活性氧水平降低。而JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针[13]。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,可以产生绿色荧光。常用红绿荧光的相对比例来衡量线粒体去极化的比例。本实验将L02细胞悬液以3×104/mL 的浓度接种于4 个激光共聚焦小皿,每皿2 mL,培养过夜后,加入2 mL 终浓度为20 mmol/L 的APAP,然后分别在0、6、12 和24 h 后处理细胞,分别按照MitoSOX试剂盒和JC-1试剂盒操作说明进行染色,37 ℃避光孵育30 min,弃染色液,用PBS 洗2 次,使用荧光显微镜拍照。用Image-Pro Plus 6.0软件进行荧光强度的分析。
1.3.4 实时荧光定量PCR 检测IRAK4 mRNA 表达将L02细胞以3×106个/mL接种到6 cm培养皿中,每皿3 mL,培养至细胞完全贴壁且细胞密度达到80%左右时,给予终浓度为20 mmol/L 的APAP 处理,分别设对照组(0 h)、6、12和24 h组,到对应时间点后消化细胞,按照总RNA 提取试剂盒、cDNA 合成试剂盒以及荧光定量试剂盒说明书操作。以Actin 为内参,用qPCR 仪检测细胞中IRAK4 mRNA 的表达量。引物序列为:Actin,5′-CTCCATCCTGGCCTCGCTGT-3′,5′-GCTGTCACCTTCACCGTTCC-3′;IRAK4,5′-CCTGAC TCCTCAAGTCCAGAA-3′,5′-ACAGAAATGGGTCGT TCATCAAA-3′。
1.3.5 Western blot检测IRAK4蛋白表达细胞分组处理同1.3.4。在相应时间点后消化细胞,用RIPA 裂解液及BCA蛋白定量试剂盒说明书进行细胞总蛋白的提取和定量,以β-tubulin为内参,使用凝胶成像仪检测细胞中IRAK4 蛋白的表达量,并用Image-Pro Plus 6.0软件进行灰度值分析。
1.3.6 IRAK4 小干扰RNA(siRNA)细胞转染实验化学合成siRNA 产品为冻干粉,在-20 ℃保存。使用前瞬时离心,用灭菌ddH2O 将靶基因siRNA 配制成20 μmol/L 储存液,严格遵循RNA 操作规则,于冰上放置。对L02 细胞进行siIRAK4 沉默转染处理,预实验从siRNA 1/2/3 中筛选出最佳的siRNA,qPCR 检测IRAK4 mRNA,结果显示siRNA1 效果最为显著,因此,选择siRNA1进行后续实验(简称siRNA)。
将IRAK4基因沉默后,将实验分为4 组,即正常对照组、APAP 处理组、siRNA 组(IRAK4 沉默组)和siRNA+APAP 组(IRAK4 沉默后使用APAP 干预)。按前述方法分别检测细胞活力、细胞凋亡和MitoSOX 染色检测。
1.3.7 NAC 干预后检测细胞活力和IRAK4 mRNA 表达预实验首先分别用1、2.5、5、10、20 mmol/L(200 μL/孔)NAC处理细胞,然后按前述CCK-8法检测细胞活力,再根据预实验结果选择10 mmol/L NAC干预细胞,并将细胞分为对照组、NAC 处理组、APAP处理组、NAC 和APAP 共处理组,最后用CCK-8 法检测细胞活力,qPCR法检测IRAK4 mRNA表达水平。
1.4 统计学方法
利用GraphPad Prism 8 软件进行统计分析,结果以表示,组间数据的比较采用t检验和单因素方差分析,以α=0.05作为检验水准。
2 结果
2.1 不同浓度APAP诱导L02细胞不同时间肝细胞损伤模型的建立
不同浓度APAP 作用24 h 可以诱导L02 细胞活力下降,且细胞损伤程度随着剂量升高而增加,见图1。与对照组相比,APAP 浓度在2.5、5、10、20、40、80 mmol/L 处理细胞24 h 后,L02 细胞活力逐渐下降,与对照组比较,其中20、40 和80 mmol/L APAP 处理组差异具有统计学意义(P<0.05)。由图1A可知,APAP 浓度在20 mmol/L 时细胞损伤程度<50%,因此选择该浓度进行后续研究。

图1 APAP干预对L02细胞活力及形态的影响
采用20 mmol/L APAP 处理L02 细胞不同时间后,观察各组细胞的形态情况如图1B所示,对照组细胞完全贴壁,结构正常,生长状态良好,细胞形态清晰可见,APAP 处理12 和24 h 组部分细胞贴壁不好,细胞胞体有皱缩变圆现象,细胞数量较正常组减少。各组细胞存活率如图1C所示,L02细胞的存活率与对照组比较,在6 h和12 h无明显变化,在24 h时显著降低(P<0.05)。
2.2 APAP干预不同时间对L02细胞凋亡的影响
结果见图2。对照组正常细胞占92.4%,凋亡细胞为6.2%。与对照组相比,APAP 处理6 h 和12 h 后,细胞凋亡率的差异无统计学意义(P>0.05);而APAP处理24 h后,细胞凋亡率明显增加且差异具有统计学意义(P<0.05),说明APAP处理细胞24 h可以诱导细胞发生凋亡。
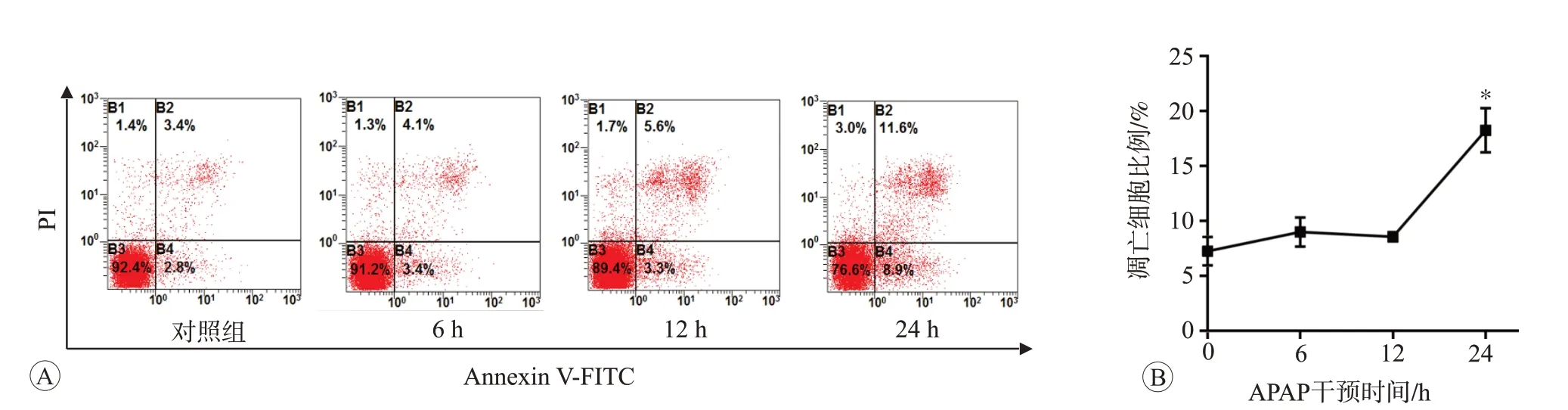
图2 APAP干预不同时间对L02细胞凋亡的影响(n=3)
2.3 APAP干预不同时间对线粒体活性氧和膜电位的影响
MitoSOX 染色结果如图3 所示。与对照组相比,20 mmol/L的APAP处理6、12和24 h后,红色荧光逐渐增强,线粒体活性氧在24 h时间点达到最大。

图3 APAP干预不同时间对线粒体活性氧的影响(n=3)
JC-1检测线粒体膜电位结果及荧光强度分析如图4所示。与对照组相比,20 mmol/L APAP干预6、12及24 h后,红绿荧光的比值逐渐降低,均显著低于对照组(P<0.05),说明20 mmol/L APAP 处理后6~24 h均可降低线粒体膜电位。

图4 APAP干预不同时间对线粒体膜电位的影响(n=3)
2.4 APAP干预不同时间对IRAK4表达的影响
qPCR检测IRAK4 mRNA表达如图5A所示。与对照组相比,用20 mmol/L APAP 处理24 h 后,IRAK4 mRNA 表达量显著增加(P<0.05)。Western blot 结果如图5B所示。蛋白质电泳图和条带灰度值分析(图5C)结果均显示,20 mmol/L APAP 处理24 h 后,IRAK4 蛋白表达水平较对照组明显增加(P<0.05),与qPCR检测结果趋势一致。

图5 APAP干预不同时间后IRAK4 mRNA和蛋白的变化(n=3)
2.5 沉默IRAK4基因后再用APAP处理的作用
不同siRNA之间转染效果的对比见图6A。细胞活力检测见图6B,与对照组相比,发现APAP 组细胞活力降低,siRNA 组细胞活力增加(P<0.05)。与APAP 组相比,siRNA+APAP 组细胞活力也明显增加(P<0.05)。细胞凋亡的结果如图6C 所示,与对照组相比,APAP组细胞凋亡程度增加;与APAP组相比,siRNA+APAP组细胞凋亡程度减小(图6D)。MitoSOX 染色检测结果如图6E 所示,与对照组相比,APAP 组红色荧光增强;与APAP 组相比,siRNA+APAP 组红色荧光减弱(图6F)。以上细胞活力、细胞凋亡和线粒体活性氧的检测结果均表明,与对照组和APAP 组相比,IRAK4基因沉默后,细胞损伤均出现不同程度的改善。
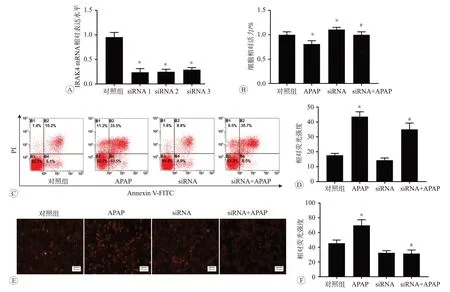
图6 沉默IRAK4基因后再用APAP处理的各指标检测结果
2.6 NAC干预后细胞活力和IRAK4分子的变化
与对照组相比,NAC 浓度在20 mmol/L 时可以显著诱导L02 细胞活力下降(P<0.05,如图7A),使细胞受到损伤,因此我们选用对细胞活力并无明显影响的10 mmol/L NAC 进行后续研究。采用20 mmol/L APAP 和10 mmol/L NAC 对细胞进行干预,与对照组相比,APAP 干预后细胞活力下降(P<0.05),而APAP和NAC 共处理后细胞活力升高(P<0.05),说明NAC 对APAP 引起的细胞损伤有保护作用(图7B)。qPCR 检测IRAK4 mRNA 表达结果(图7C)显示,与对照组相比,使用20 mmol/L APAP 处理24 h 后,IRAK4 mRNA表达水平升高,而APAP 和NAC 共处理后IRAK4 mRNA 表达水平降低(P<0.05),与CCK-8 检测结果相符,同样表明NAC 对APAP 引起的细胞损伤起到保护作用。
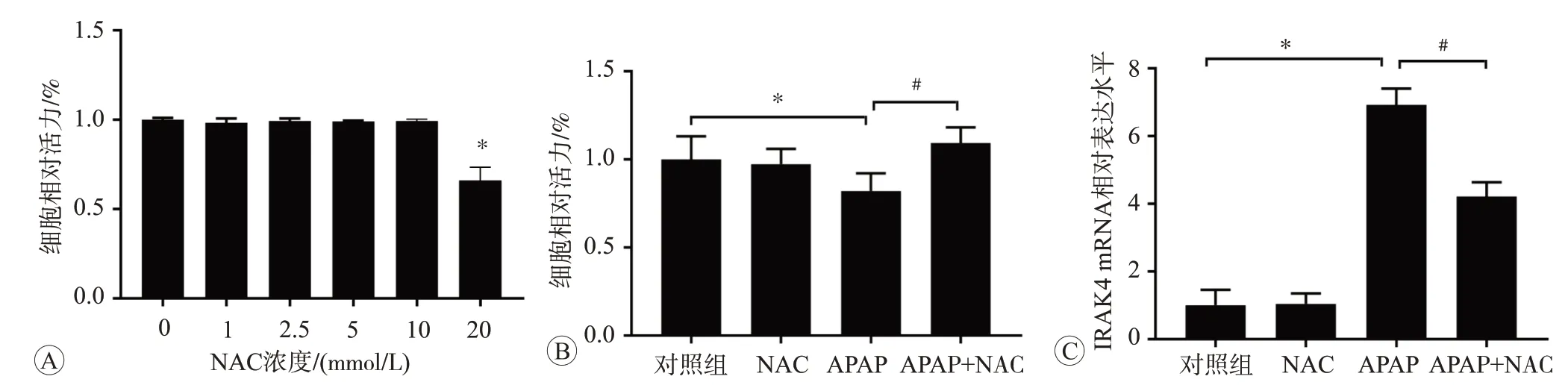
图7 NAC干预后细胞活力和IRAK4 mRNA表达的变化
3 讨论
目前,虽然关于APAP 毒性救治的药物不断创新,但用于临床的标准药物仍仅有抗氧化剂NAC,但NAC存在许多局限性,比如只能用于疾病发生的早期[14]。APAP 致肝损伤机制也不十分清楚,研究发现,线粒体应激和炎症反应在APAP 引起的肝毒性中起着重要作用[15]。当线粒体受损伤时,会持续产生高浓度的ROS,导致线粒体膜脂质和线粒体DNA 氧化受损,从而引起炎症反应[16]。
本文采用20 mmol/L的APAP处理L02细胞不同时间,建立了L02 细胞诱导APAP 肝损伤的体外模型。通过初步研究发现,20 mmol/L APAP 干预24 h 后,L02 细胞的活力明显降低,细胞形态也明显改变。凋亡检测结果显示,20 mmol/L APAP 处理24 h 可显著诱导细胞发生凋亡。这与Liang 等[17]报道的10 mmol/L APAP 处理48 h 后引起细胞凋亡的结果不同,可能是由于所用APAP剂量和处理时间不同的原因。
IRAK4是细胞内丝氨酸-苏氨酸激酶IRAK家族的成员之一。IRAK4在包括系统性红斑狼疮、类风湿性关节炎和银屑病等炎症性疾病的发病机制中起着重要作用[18]。当前,IRAK4 分子主要是在Toll 样受体介导的信号通路中发挥调节作用,Wang 等[19]报道抑制IRAK4活性可有效减轻小鼠酒精性肝损伤。本实验结果表明,用20 mmol/L APAP 处理L02 细胞后,线粒体膜电位自6 h开始逐渐增加,线粒体ROS从12 h开始增高,24 h 可使细胞发生凋亡;且APAP 处理后IRAK4 蛋白表达量呈升高趋势;通过转染实验沉默IRAK4基因后发现,与APAP组相比,L02细胞活力有所增加、细胞凋亡程度减轻以及线粒体ROS减弱,表明肝细胞特异性IRAK4 分子可能参与了APAP 引起的急性肝损伤。由于线粒体ROS在12 h升高,而IRAK4分子在24 h升高,据此我们推测可能是由于ROS起到了明显的调控作用。当我们在APAP 处理L02 细胞的基础上使用ROS清除剂NAC进行干预后,细胞活力明显升高,IRAK4分子表达下降,这体现了NAC的抗氧化作用,也说明ROS可能调控IRAK4。
APAP 肝损伤机制非常复杂,包括线粒体功能障碍、氧化应激、炎症、代谢和自噬等,炎症作为其中一个重要机制被广泛研究,已知线粒体是APAP 肝毒性的关键靶点,过量的APAP 引起ROS 升高和线粒体氧化应激,诱导细胞坏死,导致损伤相关分子模式的释放(包括线粒体DNA、核DNA片段和TLRs等),进而激活促炎细胞因子的形成[2]。鉴于IRAK4 分子在炎症信号传导通路中占据着中心位置,我们推测IRAK4分子在APAP 诱发的炎症反应中可能发挥了关键作用。目前,APAP 肝毒性机制仍有待进一步阐明,治疗药物也需深入探索,我们提出IRAK4 分子在APAP 诱导的急性肝细胞损伤中可能是一个潜在的治疗靶点。

