基于COⅠ基因标记的云南人工养殖金环胡蜂遗传多样性分析
刘鑫阳,宋忠云,杨 晨,和秋菊,易传辉,朱恩骄
(1.西南林业大学生物多样性保护学院,昆明 650224;2.云南省森林灾害预警与控制重点实验室,昆明 650224; 3.西南林业大学云南生物多样性研究院,昆明 650224;4.云南林业职业技术学院,昆明 650224)
【研究意义】胡蜂通常称为黄蜂或马蜂,为膜翅目(Hymenoptera)胡蜂科(Vespidae)昆虫的总称,主要包括胡蜂亚科(Vespinae)、马蜂亚科(Polistiinae)、蜾蠃亚科(Eumeninae)等6个亚科,全世界已记录5445种(亚种),其中中国记录290种(亚种),胡蜂属昆虫17种[1-4]。金环胡蜂(VespamandariniaSmith, 1852)属膜翅目(Hymenoptera)胡蜂科(Vespidae)胡蜂属(Vespa)中性情凶猛、体型最大的捕食性肉食昆虫,俗称“虎头蜂”[5],具有极高的食用、药用、生态和保健价值[6-7]。【前人研究进展】近年来,由于市场对胡蜂蛹的需求急剧增加,促进了金环胡蜂人工养殖的快速兴起,目前已遍布南方各地。但由于技术不成熟,许多关键养殖技术有待突破,仅能实现交配、人工越冬和初巢阶段的人工养殖;同时,目前人工养殖存在其它严重问题,如对蜜蜂的危害,特别是对养殖蜜蜂的危害极其严重,部分地方造成胡蜂养殖农户和蜜蜂养殖农户的严重对立和冲突[8]。目前对金环胡蜂的研究主要集中在生物学特性等方面[9-10],部分研究涉及危害防控等方面[11],少数研究涉及遗传多样性与线粒体全基因组研究[12-13]。【本研究切入点】到目前为此,未见利用mtDNACOⅠ基因对人工养殖金环胡蜂遗传多样性相关研究。线粒体基因具有高度保守性、原始系遗传、进化速度快等特点,被广泛用于昆虫分类、系统发育、种群遗传、物种起源和分化等领域研究[14]。【拟解决的关键问题】本研究选用线粒体COⅠ基因标记,对云南主要人工养殖区金环胡蜂遗传多样性进行研究,以期弄清养殖种群遗传多样性状况,为该昆虫科学养殖和对蜜蜂与其它生物多样性的危害管理提供基础资料。
1 材料与方法
1.1 COⅠ序列试验样品
供试金环胡蜂共237头,收集时间为2017年11月至2019年10月,收集地为云南省人工养殖最主要的8个地级市(表1)。将收集到的金环胡蜂浸泡在45 mL无水乙醇离心管中,记录采集的地理位置和时间,置于-20 ℃冰箱中备用。

表1 金环胡蜂样品采集信息Table 1 Sample collection information of Vespa mandarinia
1.2 试验方法
1.2.1 DNA提取 取金环胡蜂胸部肌肉10 mg,选用Magen公司的HiPureInsectDNAKit试剂盒,并参考其说明书步骤提取DNA。试验后将DNA储存于2~8 ℃冰箱中备用;若时间较长,则储存于-20 ℃冰箱中备用。
1.2.2 PCR扩增与测序 鉴定用COⅠ基因上游引物L1490为5′-GGTCAACAAATCATAAAGATATTGG-3′,下游引物H2198为5′-TAAACTTCAGGGTGACCAAAAAATCA-3′[15]。PCR反应体系为30 μL,其中DNA模板3 μL,上游引物1 μL,下游引物1 μL,LATaqPreMix15 μL,ddH2O10 μL。扩增反应在GmbH Power Cycler SL 96型PCR扩增仪上完成,反应程序为:94 ℃预变性1 min;94 ℃变性40 s,45 ℃退火40 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min。PCR扩增结果通过1%琼脂糖凝胶电泳检测后,送擎科生物科技有限公司进行双向测序。
1.2.3 数据分析 首先使用Bioedit对获得所有原始序列进行比对分析[16],计算碱基组成;再利用DNAsp 5.0软件分析序列多态性[17],序列单倍型多样性、核苷酸多样性等。用Arlequin 3.5软件进行分子方差分析(AMOVA),并计算群体间的分化水平(Fst)[18]。用DNAsp 5.0软件分析序列单倍型,并导出单倍型序列,利用Popart 1.7软件绘制单倍型中介网络图[19];利用MEGA软件构建单倍型系统进化树,并对其起源和系统发育进行分析。
2 结果与分析
2.1 序列碱基组成及变异
截取比对后的600 bp编码区序列进行分析。在金环胡蜂线粒体COⅠ基因中A、G、T、C 4种碱基的平均含量为29.62%,12.81%,38.44%,19.13%,A+T的含量为68.05%,C+G的含量为31.95%,A+T碱基含量(68.06%)明显高于C+G含量(31.94%),说明COⅠ基因具有A+T碱基偏向性。序列变异分析结果显示共有保守位点563个,变异位点37个,占分析位点总数的6.16%。变异类型主要为碱基转换和碱基颠换,未发现碱基插入和缺失。在这37个变异位点中,有30个转换位点,7个颠换位点。
2.2 群体多样性
由表2可知,单倍型分析共发现12个单倍型,其中,Hap_1、Hap_2、Hap_4、Hap_6、Hap_7、Hap_8为共有单倍型,其余6个为群体独有单倍型。其中单倍型Hap_7出现次数最多,为主体单倍型。从养殖地区来看,楚雄地区单倍型较为丰富,有7种单倍型;其次为保山地区,有4种单倍型;昆明地区有3种,普洱、红河地区有2种,曲靖、德宏和文山均仅有1种单倍型。
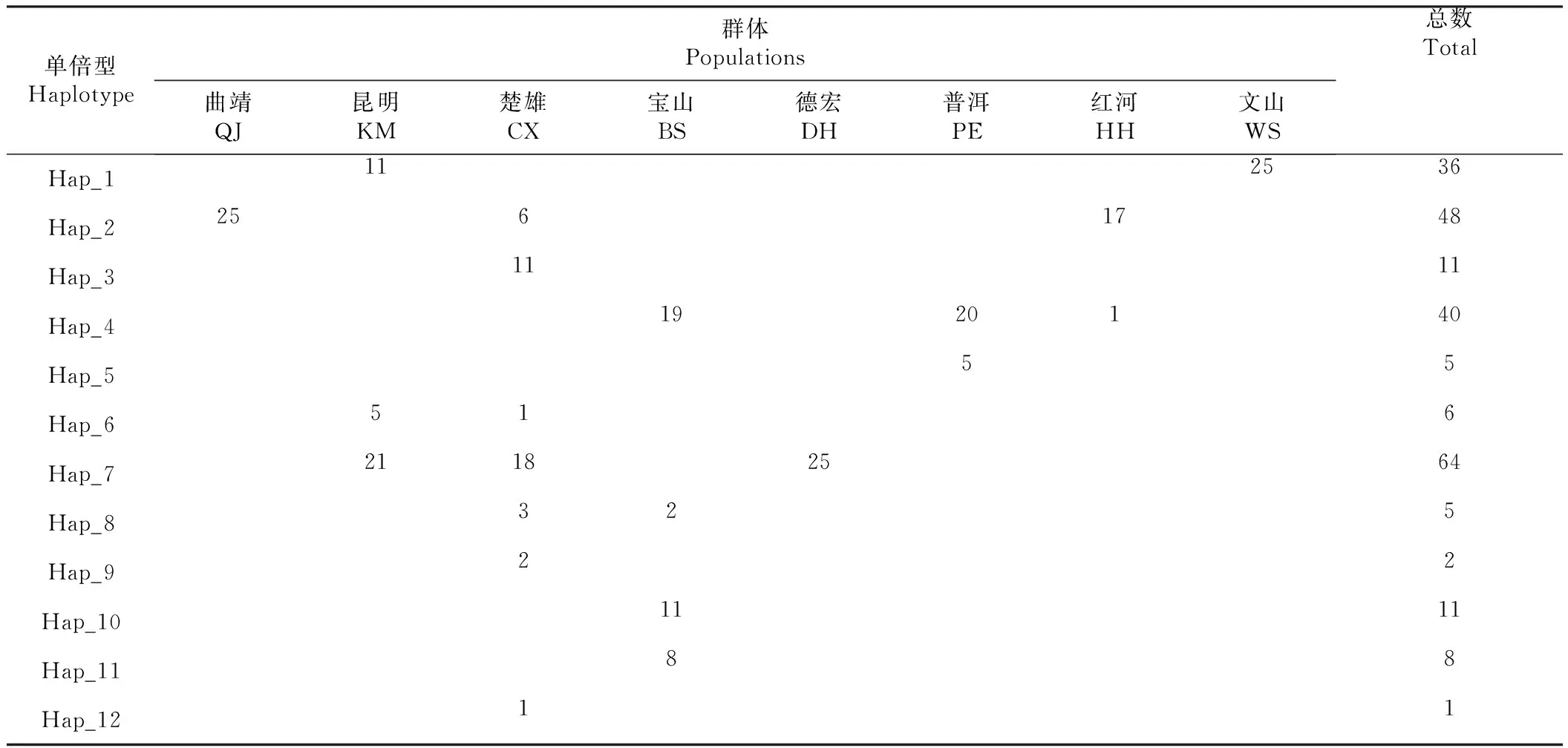
表2 线粒体DNA COⅠ序列单倍型分布情况Table 2 Haplotype distribution of COⅠ sequence in mitochondrial DNA
由表3可知,整体单倍型多样性(Hd)为0.82958。各地理群体单倍型多样性在0~0.74100,不同地理群体差异较大,其中,以楚雄最高(0.74100),其次为保山(0.67308);文山、德宏和曲靖最低(均为0)。整体核苷酸平均差异数(K)为15.18387,整体核苷酸多样性(Pi)为0.02526。核苷酸平均差异数和核苷酸多样性均以曲靖、德宏和文山最小(均为0);平均核苷酸差异数以楚雄的最大(16.21254),其次为昆明(16.04505),核苷酸多样性以昆明最大(0.02670),其次为楚雄(0.02698)。
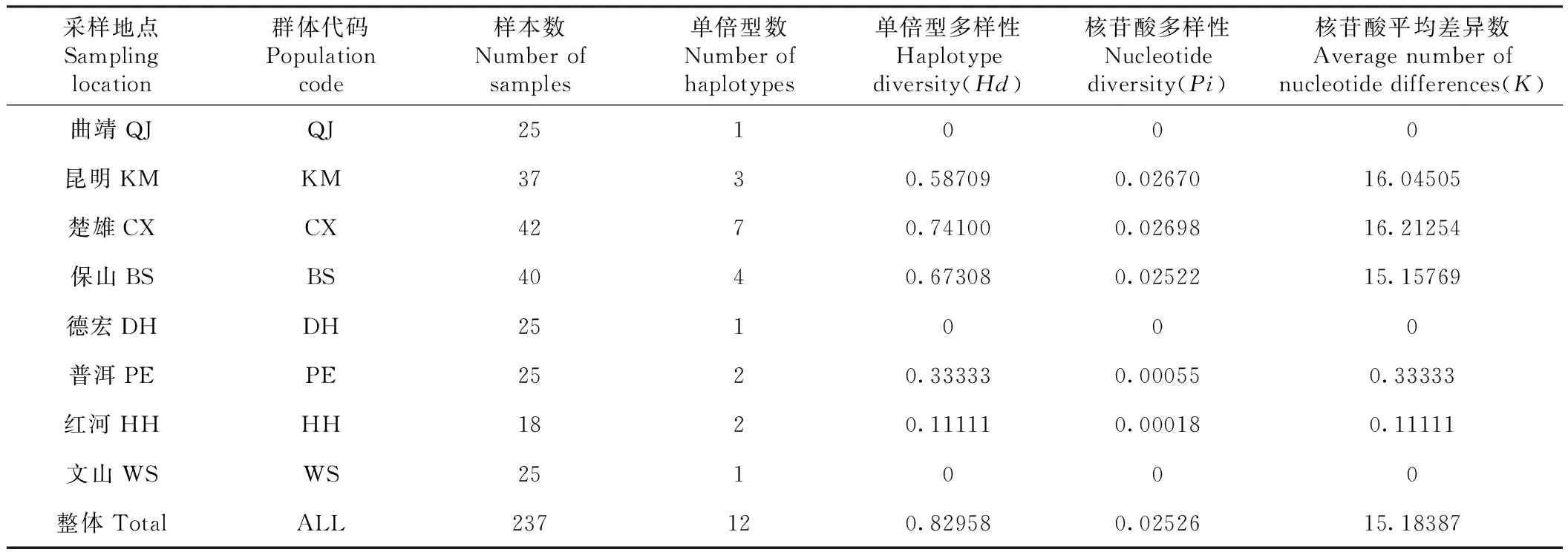
表3 云南省金环胡蜂样本采集信息与多样性指数Table 3 Sample information and diversity index of Vespa mandariniain Yunnan
由表4可知,本研究中使用核苷酸差异(Dxy)和核苷酸净遗传距离(Da)来表示群体之间的核苷酸多态性。各养殖地区核苷酸分歧度(Dxy)在0.00009~0.05191,其中,曲靖和德宏间最大(0.05191),保山和曲靖间最小(0.00009);核苷酸净遗传距离(Da)在-0.00024~0.05164,其中普洱和昆明间最小(-0.00024),德宏和曲靖间最大(0.05164)。
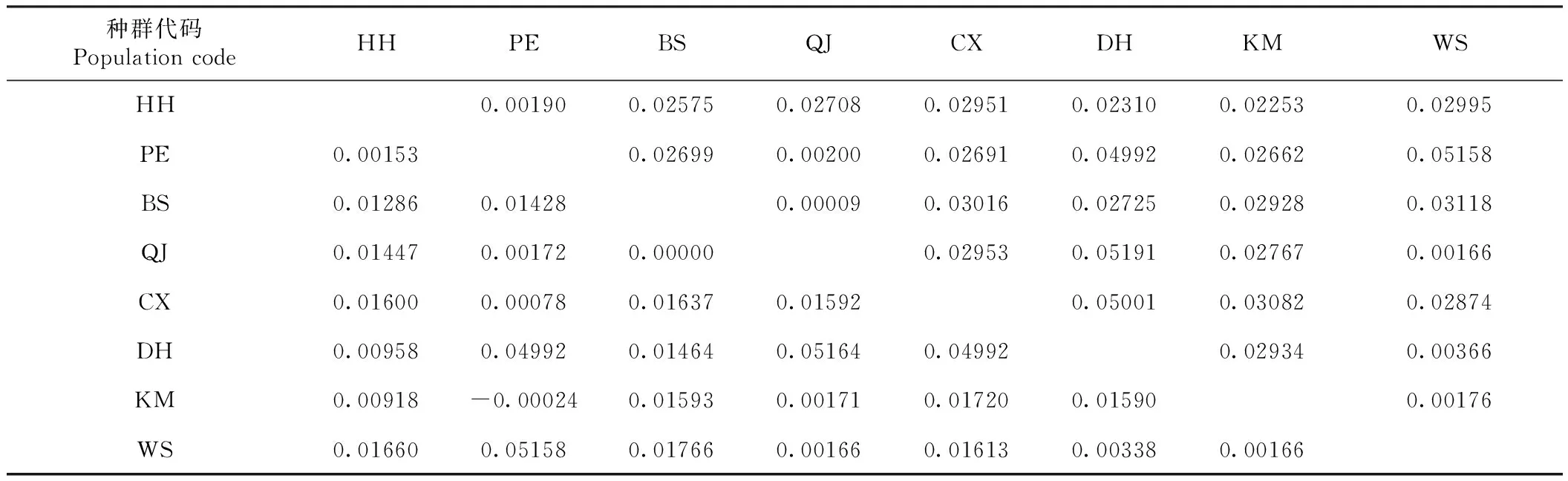
表4 线粒体DNA核苷酸分歧度(Dxy)和净遗传距离(Da)Table 4 Mitochondrial DNA nucleotide divergence (Dxy) and net genetic distance (Da)
2.3 群体遗传结构及遗传分化
由表5可知,各养殖种群金环胡蜂种群内遗传距离在0.00~0.0283。其中,楚雄种群内遗传距离最大(0.0283);其次为昆明(0.0279)和保山(0.0263),文山、曲靖和德宏3个地区种群最小(均为0)。

表5 种群内平均遗传距离Table 5 Average genetic distance within the group
由表6可知,各养殖种群间遗传距离在0.0001~0.0544,其中以德宏与普洱地区种群的遗传距离最大(0.0544),其次为德宏与文山种群(0.0054),曲靖和红河种群的遗传距离最小(0.0001),这说明遗传距离与地理距离没有关系。

表6 种群间平均遗传距离Table 6 Average genetic distance between groups
由表7可知,分子方差分析(AMOVA)结果显示,50.48%的变异来源种群间,种群内部变异为49.52%,说明遗传变异来源于种群外部,但与种群内部遗传变异比例相近,差异较小;基因分化系数Fst=0.50482,差异较显著(P<0.001),表明种群间分化强烈,但不同地区养殖种群间存在一定交流。

表7 线粒体DNA COⅠ序列分子方差分析Table 7 Amova of mitochondrial DNA COⅠ sequence
2.4 系统进化树与单倍型网络中介图
由图1可知,利用邻接法(NJ)对12个单倍型进行聚类分析,形成了2个较为明显的分支。其中单倍型Hap_1,Hap_2,Hap_3,Hap_4,Hap_5与Hap_6形成一个分支,说明它们间的亲缘关系较近,可能来源于同一原始种群。其余单倍型形成另一个分支,表明它们可能来源于另一原始种群。

图1 邻接法(NJ)构建的COⅠ基因单倍型的系统发生树Fig.1 Phylogenetic tree of COⅠ gene haplotype constructed by neighborhood-joining method
由图2可知,网络中介图显示,单倍型有较明显的分化,形成2个主要聚类簇。其中单倍型Hap_1、Hap_2、Hap_3、Hap_4、Hap_5与Hap_6为一个聚类簇,单倍型Hap_7、Hap_8、Hap_9、Hap_10、Hap_11、Hap_12为一个聚类簇,单倍型Hap_2和Hap_7出现的频率最高,包含的地区最丰富。多数单倍型之间只有1个突变位点。
3 讨 论
3.1 遗传多样性
研究结果显示,金环胡蜂mtDNACOⅠ基因A+T的含量为68.05%,表明mtDNACOⅠ基因具有明显的AT碱基偏向性,与典型的昆虫线粒体碱基组成特点相符[20];共发现12个单倍型,其中6个为共享单倍型,6个为各群体独有,表明各养殖种群为适应环境发生了变异,或与当地野生种群进行了基因交流;单倍型Hap_7出现次数最多,该单倍型为养殖种群中适应性较强并广泛分布的原始单倍型,可能来源于同一原始种群。大多数群体中都出现了共享单倍型,这些单倍型在金环胡蜂进化过程中相对稳定,更适合当前环境。群体内的线粒体单倍型多样性较为丰富,说明该群体具有较强的环境适应能力,在云南复杂多变的生境中具有较大的生存空间。单倍型多样性和核苷酸多样性常被作为评价物种遗传多样性的重要指标,两者相对应的单倍型多样性(Hd)和核苷酸多样性(Pi)的值越大,物种遗传多样性越高[21]。金环胡蜂养殖种群整体单倍型多样性(Hd)较高,为0.82958,但核苷酸多样性(Pi)较低,仅为0.02526,表明不同地区养殖种群可能来源于少数相同原始种群,经历了近似于自然种群“瓶颈效应”之后短时期内的快速扩张,核苷酸变异积累不足[22]。
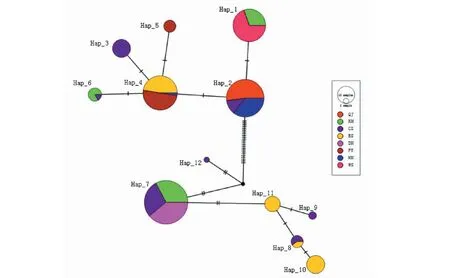
每个圆圈代表一种单倍型,其大小与该单倍型出现的频率成正比Each circle represents a haplotype, and its size is directly proportional to the frequency of the haplotype图2 金环胡蜂编码区单倍型网络中介图(COⅠ)Fig.2 Haplotype network intermediary diagram of the coding area of Vespa mandarinia(COⅠ)
3.2 群体的遗传结构及遗传分化
各地区金环胡蜂养殖种群组内遗传距离在0~0.0283,基因分化系数大(Fst=0.50482),表明不同种群间强烈分化,可能受德宏种群影响,该原始种群主要来源于缅甸。基因分化系数的值介于0~0.05表示种群间遗传分化程度很弱,0.05~0.15为分化中等,0.15~0.25为分化程度较大,大于0.25为分化程度很大[23]。分子方差分析显示,50.48%的变异来源种群间,种群内部变异为49.52%,表明遗传变异主要来源于种群外部,但与内部变异相近,说明各种群间存在一定基因交流,同时与当地野生种群或外地引入种群基因交流强烈。研究结果表明,云南不同地区养殖的金环胡蜂原始种源来源较复杂,可能来源于少数几个原始种群,在养殖过程中与当地野生种群和外来种群(主要是缅甸种群)进行了基因交流,造成了养殖胡蜂单倍型多样性高,核苷酸多样性低,遗传结构与分化复杂化格局。这与云南金环胡蜂养殖情况一致。笔者调查发现,云南人工养殖金环胡蜂第一代原始种源多数来源于保山龙陵,在养殖过程中部分地区采用了当地种源,或与当地种源进行了杂交,并引入了外地种源(主要是缅甸种源)。
4 结 论
云南金环胡蜂养殖种群单倍型多样性较高,但核苷酸多样性较低;各种群间的分化系数Fst强烈,遗传变异主要来源于种群外部,但与种群内部变异相近。表明原始种群来源于少数母种群,在养殖过程中原始种群后代经历了与本地和外地(主要是缅甸)种群的杂交,种群经历了快速扩张过程。研究结果对指导胡蜂人工养殖和危害防控具有一定意义。

