转运蛋白MoMfs2对稻瘟病菌细胞壁完整性和杀菌剂外排的调控
齐中强,杜 艳,潘夏艳,文友义,于俊杰,张荣胜,俞咪娜,曹慧娟,宋天巧,李连伟,刘永锋
(1.江苏省农业科学院植物保护研究所,南京 210014;2.江苏师范大学生命科学学院,江苏 徐州 221116)
【研究意义】由稻瘟病菌(Magnaportheoryzae)引起的稻瘟病是水稻生产上最重要的一种病害,在全世界稻区均有发生,严重威胁世界粮食安全生产[1-2]。稻瘟病菌属于子囊菌,其与水稻的互作模式符合“基因对基因”假说,因此稻瘟病菌—水稻互作模式已经成为研究植物与病原菌互作的模式系统[3-4]。稻瘟病菌主要通过分生孢子侵染水稻,能够对水稻整个生育期造成危害,侵染过程同样受到水稻和外界环境的影响,细胞壁是感受这些压力最重要的结构[5]。【前人研究进展】质子依赖型MFS(Major Faciitator superfamily)转运蛋白属于膜蛋白的一类,主要介导生物膜内外的化学物质和信号交换,在营养物质摄取,代谢产物释放以及信号转导等细胞活动中起着重要作用[6-7]。MFS转运蛋白是一类非常古老、在各个物种中都起着重要作用的转运蛋白[8],一般由400~800个氨基酸残基形成12或14个跨膜结构域。MFS超家族蛋白可以转运单糖、多糖、氨基酸、多肽、维生素、酶辅因子、药物分子、发色团、碱基等众多小分子[9-10]。MFS超家族转运蛋白不但在众多物质的转运过程中起着至关重要的作用,同时还与病毒入侵、病菌抗药性等免疫学问题密切相关[11]。【本研究切入点】本研究利用基因敲除的方法,对稻瘟病菌MFS转运蛋白编码基因MoMFS2的生物学功能进行解析。【拟解决的关键问题】明确MFS转运蛋白MoMfs2在稻瘟病菌致病性及物质转运和对杀菌剂的外排中的作用,为新型杀菌剂的研发奠定基础。
1 材料与方法
1.1 供试材料
稻瘟病菌(Magnaportheoryzae)Guy11由江苏省农业科学院植保所水稻病害防控创新团队保存。水稻为感病品种CO39。
1.2 敲除载体构建及稻瘟病菌敲除转化
通过稻瘟病菌全基因组公布序列网站,将预测到的MoMFS2基因(MGG_01301)序列下载。敲除载体构建具体方法如下:将M.oryzae基因组数据库中MoMFS2基因上、下游各1 kb左右的DNA序列作为同源重组的上、下两臂,构建基因敲除载体。以野生型Guy11基因组DNA为模板,分别用引物mfs2-p1 (F)/mfs2-p2 (R)和mfs2-p3 (F)/mfs2-p4 (R) 扩增上、下臂片段,以质粒pCB1003为模板,用引物FL1111 (F)/FL1112 (R) 高保真PCR扩增抗性筛选基因—潮霉素磷酸转移酶基因(HPH),经电泳、切胶回收将上述3个PCR产物纯化。利用同源重组酶(诺唯赞C112)将上述3个片段和pMD19-T simple vector(TaKaRa, Dalian, China)进行连接,得到质粒pMD::MFS2::HPH,以该质粒为模板,用引物mfs2-p1 (F)/mfs2-p4 (R) 扩增得到约3.4 kb的敲除片段用于M.oryzae的原生质体转化。M.oryzae原生质体转化参照文献[13]。
1.3 转化子验证及Southern杂交
将转化得到的转化子提取基因组DNA(CTAB法),用引物mfs2-p5 (F)/mfs2-p6 (R)进行验证,随后将验证得到的候选突变体进行Southern杂交。以稻瘟病菌野生型Guy11基因组DNA为模板,用引物mfs2-p5 (F)/mfs2-p6 (R)扩增出MoMFS2基因内部503 bp的片段作为探针,并用地高辛标记。Guy11菌丝基因组DNA经Hind III于1.0%琼脂糖凝胶中过夜电泳,充分分离酶解片段,然后转移至带正电的尼龙膜(HybondTM-N+, Amersham, Biosciences UK Limited)上,与地高辛标记的探针于58 ℃杂交过夜。Southern杂交过程参照digoxigenin high-prime DNA labeling and the detection starter kit 1(Roche, Germany)的操作手册。以上引物列表在Table 1。
1.4 分生孢子形成测定
将野生型Guy11及敲除突变体接种在SDC培养基上,28 ℃黑暗培养7 d左右,待菌丝体长满平板后,用手术刀将表面气生菌丝刮掉,于黑光灯下照射3 d,诱导分生孢子产生。收集孢子时,向培养基内加入3 mL无菌水,轻轻用1.5 mL EP管底部将表面气生菌丝和孢子刷下,后经过4层擦镜纸过滤以收集孢子。
1.5 附着胞形成测定
将盖玻片(Fisherbrand,12-540-A 18×18-2)放置在载玻片上(下面滴加无菌水),取40 μL浓度为5×104个/mL的分生孢子液,滴加于盖玻片中央,随后将载玻片放入培养皿中28 ℃黑暗保湿培养,2、4、6、8、24和48 h后分别制片观测附着胞形成率。每次实验设置3个重复。
1.6 水稻喷雾及大麦离体致病性测定
将刷下的孢子浓度调至5×104个/mL,加入0.25%明胶,利用生长14 d水稻进行喷雾,28 ℃黑暗培养24 h,随后16 h光照,8 h黑暗处理期间需要保持高温高湿状态。接种5~7 d后,观察结果。
大麦离体致病性测定,剪取生长7 d的大麦叶片铺于含有保湿滤纸的培养皿中,孢子液浓度调至5×104个/mL,加入0.25%明胶,每片叶片滴3滴调好浓度的孢子液,以水做对照,置于28 ℃黑暗培养24 h,随后16 h光照,8 h黑暗处理。接种5~7 d后,观察结果。每次实验设置3个重复,试验重复3次。
1.7 原生质体释放测定
野生型和突变体菌株在含CM培养基平板上培养6 d后,切取3 mm见方的菌丝块置于CM培养液中,28 ℃摇培48 h,然后用滤纸过滤收集菌丝体,并用吸水纸吸干。各称取0.2 g 菌丝体分别置于2 mL 含有0.7 mol/L NaCl 配制的酶解液(浓度:10 μg/mL)中进行酶解。每隔30 min 终止酶解反应,并用血球计数板来统计原生质体释放数目。试验重复3次,每次设置3个重复,实验结果取平均值。
1.8 细胞壁胁迫因子敏感性分析
从CM培养基上生长6 d的菌落边缘上,切取3 mm见方的菌丝块,接种于直径60 mm的加入不同浓度胁迫因子的CM平板中,28 ℃黑暗培养6 d后测量菌落直径并拍照,试验重复3次,每次设3个重复,结果取平均值。本实验所用胁迫因子及浓度:SDS为0.005%,0.01%,0.02%;Congo Red为200和400 μg/mL。
为构建严格的标识制度,首先应当修订转基因食品标识目录。目前,我国的转基因食品已经得到很大发展,但标识目录仍然沿用着2002年农业部公布的五类十七种转基因食品标识目录,经过15年的发展,该目录已经不适合我国现在的需要,因此亟需修订转基因食品标识目录。除了建立完备的标识目录,在标识内容上也应当严格进行规定。需要规定的内容主要有:标识文本、标识位置、标识显著程度、成分含量、副作用等五个方面。为防转基因食品生产企业钻漏洞,还应合理设置兜底条款。[7]
1.9 不同类型杀菌剂(咪鲜胺、多菌灵和嘧菌酯)敏感性测定
从CM培养基上生长6 d的菌落边缘上,切取3 mm见方的菌丝块,接种于直径60 mm的加入不同浓度杀菌剂的CM平板中,28 ℃黑暗培养6 d后测量菌落直径并拍照,试验重复3次,每次设3个重复,结果取平均值。本实验所用杀菌剂及浓度:咪鲜胺为0.0025,0.0250,0.2500 μg/mL;嘧菌酯为0.0025,0.0250,0.2500 μg/mL;多菌灵为0.1,0.5 μg/mL。
1.10 胞外漆酶及过氧化物酶活性的检测
在CM培养基上切取生长5 d的3 mm见方的菌丝块接种到直径6 cm的含有0.2 mmol/L ABTS的CM培养基上,28 ℃黑暗培养24 d后观察并拍照,实验重复3次。过氧化物酶活性检测见上面刚果红胁迫测定实验,分光光度计测定2种酶的含量方法参照张等[12]的方法。
2 结果与分析
2.1 MoMfs2蛋白进化分析
通过真菌数据库(https://fungidb.org/fungidb/app)下载MoMfs2的氨基酸序列,在NCBI数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行同源比对并下载代表性物种氨基酸序列利用MEGA进行进化树分析,结果发现,与MoMfs2蛋白(XP 003714224.1)最近的是梨胞属真菌(XP 030983394.1和XP 029752700.1),其次是核盘菌(APA08026.1)和白腐小核菌(KAF7874946.1)。
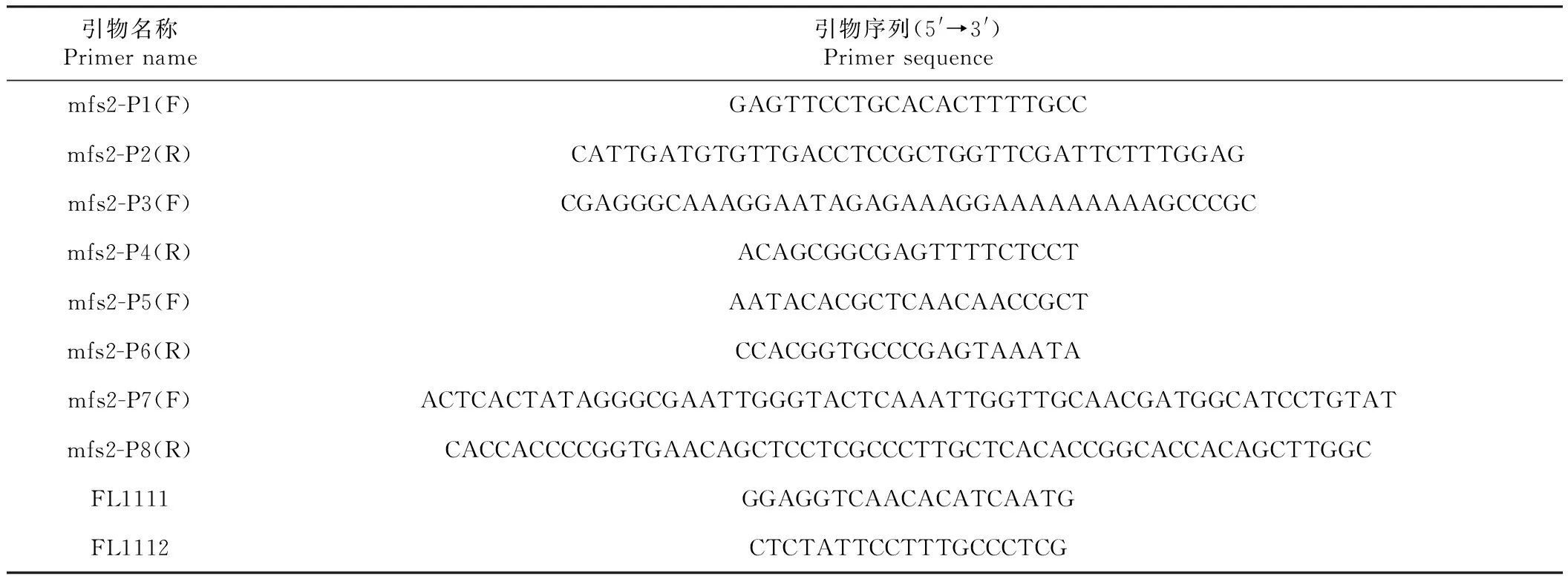
表1 本研究中使用的引物Table 1 Primers used in this study

图1 MoMfs2系统进化树分析Fig.1 Phylogenetic analysis of MoMfs2 and other Mfs2 homologues
2.2 MoMFS2基因敲除突变体的获得
利用同源重组原理对MoMFS2基因在稻瘟病菌中进行了定向敲除,获得的转化子经初步验证得到#28和#101两个转化子。随后进行Southern杂交进行进一步确认,结果(图2)发现2个突变体用基因探针没有杂出约7.3 kb条带,说明MoMFS2基因已被成功敲除;进一步用潮霉素探针杂出了约6.6 kb条带,证明MoMFS2基因已被潮霉素基因成功替换。以下实验均以#28号作为研究对象。
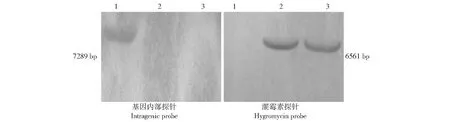
1:野生型菌株Guy11基因组(Hind III酶切);2:敲除突变体ΔMomfs2 #28基因组(Hind III酶切);3:敲除突变体ΔMomfs2 #101基因组(Hind III酶切)1:The genome DNA of wild type strain Guy11 (digested with Hind III); 2: The genome DNA of the knockout mutant ΔMomfs2 #28 (digested with Hind III); 3: The genome DNA of the knockout mutant ΔMomfs2 #101 (digested with Hind III)图2 MoMFS2敲除突变体Southern杂交验证Fig.2 Southern blot of MoMFS2 deletion mutants
2.3 MoMFS2基因不参与稻瘟病菌营养吸收与利用
为了研究MoMfs2在营养吸收和利用中的作用,将野生型Guy11和#28突变体及互补转化子分别接种到CM、MM、SDC、OM培养基上检测其生长情况。结果显示,不管是在天然培养基(SDC和OM)还是在合成培养基(CM和MM)上,突变体生长状态和生长速率较野生型均没有变化(图3~4)。结果表明,MoMFS2不参与稻瘟病菌营养吸收与利用。

Guy11:野生型菌株;ΔMomfs2:敲除突变体;ΔMomfs2/MoMFS2:互补转化子;CM:完全培养基;MM:基本培养基;SDC:产孢培养基;OM:燕麦培养基Guy11: Wild type strain; ΔMomfs2: The deletion mutant; ΔMomfs2/MoMFS2: The complementary mutant; CM: Complete medium; MM: Minimal medium; SDC: Corn agar medium; OM: Oat medium图3 MoMFS2敲除突变体在CM、MM、SDC和OM培养基上的生长情况Fig.3 The growth of MoMFS2 deletion mutant on CM, MM, SDC and OM medium

图4 MoMFS2敲除突变体在不同培养基上的生长速率差异Fig.4 Difference in growth rate of MoMFS2 deletion mutant on different medium
2.4 MoMFS2基因敲除突变体原生质体释放速率
为了分析MoMFS2敲除突变体原生质体释放,将野生型、突变体和互补转化子进行28 ℃液培,随后放入0.75%几丁质裂解酶解液中,30、60和90 min后对释放的原生质体进行计数,结果发现,该基因敲除突变体原生质体释放速率较野生型变慢(图5),表明其细胞壁完整性发生了改变。为了验证这个结论,利用细胞壁胁迫因子刚果红和SDS(十二烷基磺酸钠),将野生型、敲除突变体和互补转化子分别接种到含有不同浓度的药剂CM平板上,28 ℃、黑暗培养7 d后测量3个菌株的菌落直径并且统计在不同浓度药剂处理条件下的抑制率。结果发现突变体在低浓度刚果红和SDS平板上抑制率均显著下降(表2),表明该突变体对2种细胞壁胁迫耐受性增强。进一步证明了MoMFS2参与了稻瘟病菌细胞壁完整性。
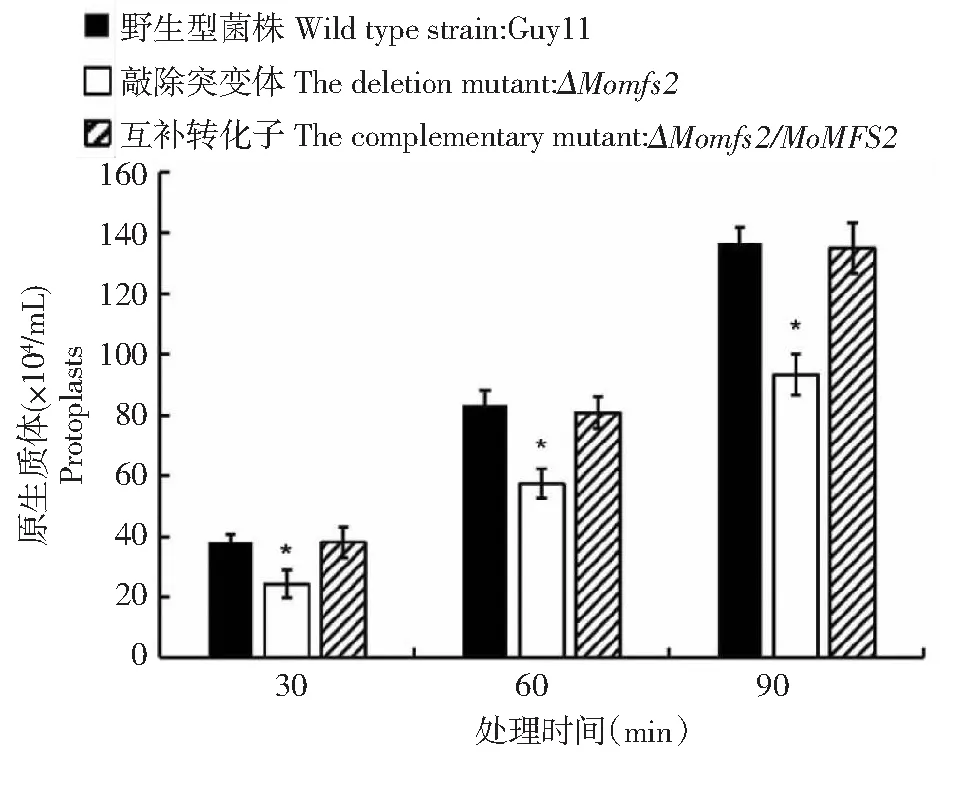
*代表差异达0.05显著水平* represents significant difference of 0.05 level图5 MoMFS2突变体原生质体释放速率变化Fig.5 Change of the rate of protoplast release of the MoMFS2 mutant
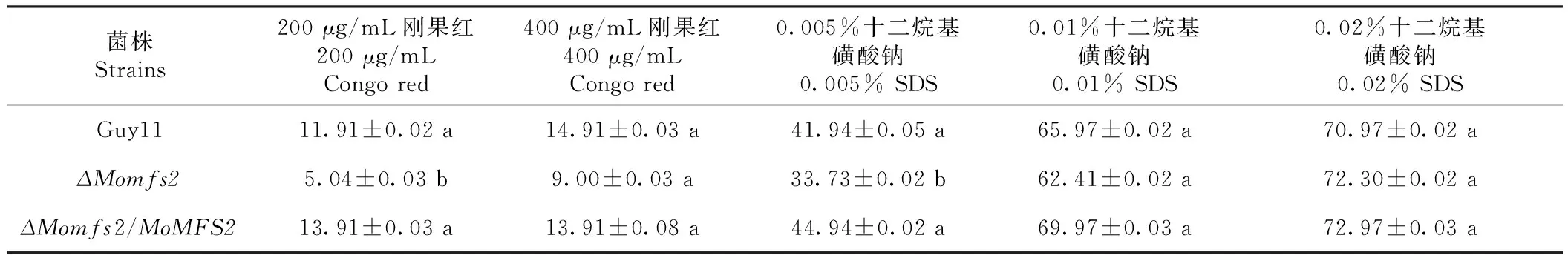
表2 MoMFS2敲除突变体在不同胁迫条件下的抑制率Table 2 Inhibition rate of MoMFS2 detletion mutant on various stress conditions (%)
2.5 MoMFS2参与胞外漆酶和过氧化物酶的外泌作用
MFS转运蛋白主要行使转运小分子化合物作用[10]。为了分析MoMFS2是否参与到稻瘟病菌的外泌过程,利用2种底物对胞外漆酶和过氧化物酶的外泌作用进行测定。外源ABTS可以作为漆酶的底物,被氧化后形成绛紫色物质,将野生型Guy11和#23突变体及互补转化子分别接种到含有0.2 mmol/L ABTS的CM培养基中。28 ℃、黑暗培养24 h后,发现突变体不能形成紫色晕圈,同时通过光密度测量,突变体几乎不分泌胞外漆酶(图6-c~图6-d)。另外,胞外过氧化物酶可以催化刚果红降解形成水解圈[14],对该突变体胞外过氧化物酶的分泌进行测定,结果发现突变体不产生水解圈,同时光密度测定结果显示基本不分泌胞外过氧化物酶(图6-a~图6-b)。上述结果表明MoMFS2参与了稻瘟病菌胞外漆酶和过氧化物酶的分泌。
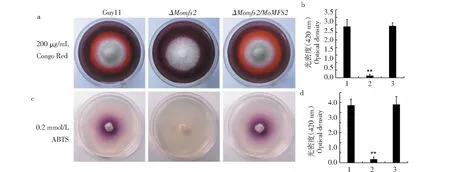
**代表差异达0.01显著水平** represents significant difference of 0.01 level图6 MoMFS2敲除突变体对胞外漆酶和过氧化物酶的分泌影响Fig.6 Effects of MoMFS2 deletion mutant on secretion of extracellular laccases and peroxidases
2.6 MoMFS2参与稻瘟病菌对不同杀菌剂的外排
为了进一步分析MoMfs2在稻瘟病菌外泌过程中的功能,利用4种防治稻瘟病主要杀菌剂咪鲜胺、嘧菌酯和多菌灵,将野生型、敲除突变体和互补转化子分别接种到含有不同浓度的药剂CM平板上,28 ℃、黑暗培养7 d后测量3个菌株的菌落直径并且统计在不同浓度药剂处理条件下的抑制率。结果(图7)显示MoMFS2敲除突变体在含有咪鲜胺、嘧菌酯和多菌灵的平板上生长抑制率上升。上述结果推测该基因参与了稻瘟病菌对杀菌剂的外排。
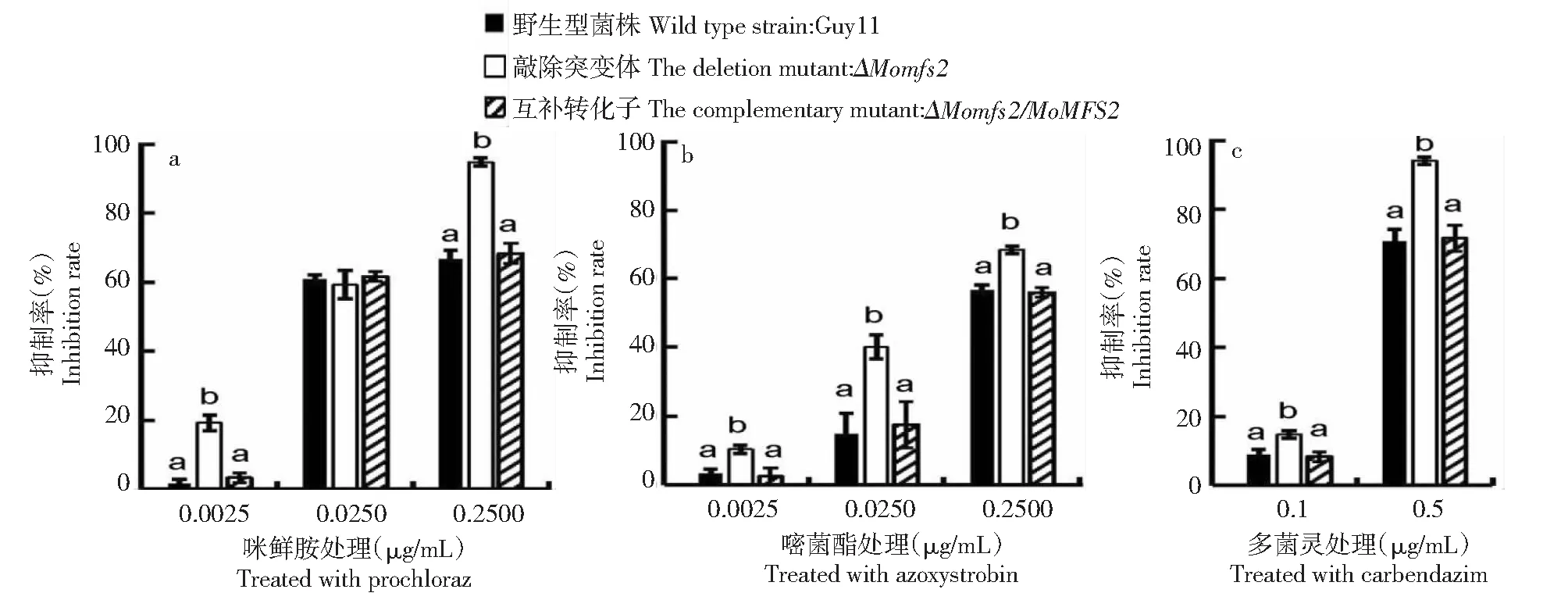
不同字母代表差异达0.05显著水平Different letters represent significant difference of 0.05 level图7 MoMFS2敲除突变体在不同杀菌剂条件下的抑制率Fig.7 Inhibition of MoMFS2 deletion mutant on various fungicide condition
2.7 MoMFS2基因敲除突变体致病性测定
为了分析MoMFS2基因对稻瘟病菌产孢量、附着胞形成和致病性的影响,将野生型,敲除突变体和互补转化子接种到产孢培养基(SDC)上培养,发现其产孢量与野生型没有差异,同时对其附着胞形成情况进行检测,发现附着胞形成率与野生型没有差异(表3)。随后将分生孢子调成浓度为5.0×104个/mL的孢子悬浮液(含0.2%明胶),分别采用水稻喷雾和大麦离体点滴的方法进行致病性测定。结果显示,敲除突变体在2种接种条件下,发病情况和野生型、互补转化子均无差异;同时,还利用梯度稀释方法在大麦叶片上进行了致病性测定,敲除突变体和野生型没有明显差异(图8)。上述结果表明表明MoMFS2基因不参与在稻瘟病菌致病过程。
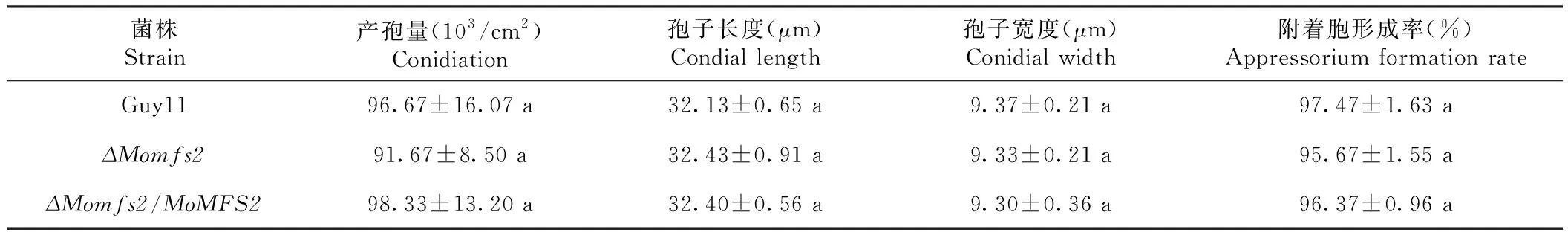
表3 MoMFS2敲除突变体分生孢子及附着胞形成Table 3 Conidiation morphogenesis and appressorium formation of the MoMFS2 detletion mutant

1:野生型菌株Guy11;2:敲除突变体ΔMomfs2;3:互补转化子ΔMomfs2/MoMFS2。C1、C2、C3:孢子悬浮液浓度分别为5×102、5×103、5×104 个/mL1:Wild type strain Guy11; 2: The deletion mutant ΔMomfs2;3: The complementary mutant ΔMomfs2/MoMFS2.C1, C2, C3: The concentration of conidial suspension: 5×102、5×103、5×104 pcs/mL图8 MoMFS2敲除突变体对水稻和大麦的致病性Fig.8 Pathogenicity of MoMFS2 deletion mutant on rice and barley
3 讨 论
MFS转运蛋白是一类非常古老、在各个物种中都起重要作用的转运蛋白[6],根据其序列相似性、功能特征和结构特点分为85个家族。在稻瘟病菌中,共预测出251个MFS转运蛋白,但至今只有一个蛋白的功能被报道。本研究利用基因敲除方法,发现一个MFS转运蛋白MoMfs2参与了稻瘟病菌对物质的分泌和杀菌剂的外排。
在稻瘟病菌中,含有MFS结构域的MATE类蛋白家族Mdt1调控葡萄糖同化下游糖传感器Tps1,同时Mdt1调控稻瘟病菌分生孢子产生和致病性[15]。在本研究中,MoMfs2转运蛋白具有12次跨膜结构,属于典型的MFS转运蛋白结构,但其不参与稻瘟病菌的分生孢子产生和致病性,参与了对胞外漆酶和过氧化物酶的分泌,对杀菌剂多菌灵、咪鲜胺和嘧菌酯的外排。胞外漆酶参与真菌色素合成、子实体形成和分生孢子形成、致病性等过程[16];胞外过氧化物酶的分泌是植物病原真菌逃避寄主活性氧的重要途径[17]。在本研究中,MoMfs2影响漆酶和过氧化物酶的分泌,但是对致病性没有影响,推测主要是稻瘟病菌中MFS家族涉及多个成员,相互之间的功能出现冗余,其他的蛋白弥补了MoMfs2对胞外漆酶和过氧化物酶分泌的缺陷。
MFS转运蛋白在多药抗性方面发挥着重要作用。在白色念珠菌(Canidiaalbicans)中,MFS转运蛋白MDR1和FLU1均对氟康唑具有显著抗性[18],且MDR1蛋白的跨膜结构域发挥了关键作用[19]。在链格孢(Alternariaalternata)中,MFS转运蛋白AaMFS19可以对氧化胁迫和抗真菌药剂产生抗性,且这种抗性受到Yap1、Skn7等MAPK蛋白激酶调控[20]。在本研究中,MoMFS2敲除突变体对四种防治稻瘟病药剂敏感性增强,也证实了MFS转运蛋白参与了稻瘟病菌对杀菌剂的外排作用。
细胞壁完整性在真菌生长发育和对外界环境的耐受性发挥重要作用[4, 21]。在稻瘟病菌中,Mps1 MAPK信号通路主要参与对细胞壁完整性的调控。该信号通路上3个蛋白MoMck1、MoMps1和MoSwi6的缺失均导致细胞壁完整性缺陷[13, 22-23]。在本研究中,缺失MoMFS2导致稻瘟病菌原生质体释放速率变慢,同时对细胞壁胁迫刚果红和SDS表现耐受性增强,推测该基因参与了稻瘟病菌的细胞壁完整性。从上文可知,部分MFS蛋白对药剂的抗性受到MAPK蛋白激酶调控,那么细胞壁完整性与多药抗性之间是否有相关性还需进一步深入研究。
4 结 论
本研究利用敲除的方法对MFS转运蛋白编码基因MoMFS2的功能进行了研究,结果表明该基因参与调控稻瘟病菌细胞壁完整性和对杀菌剂的外排,上述结论加深了对稻瘟病菌抗药性的认识,对稻瘟病的防控具有指导意义。

