番茄泛素结合酶变体基因鉴定及表达分析
赵秋芳,马海洋,马智玲,魏长宾,陈 曙
(1.中国热带农业科学院南亚热带作物研究所,广东 湛江 524091;2.海南省热带作物营养重点实验室,广东 湛江 524091;3.农业农村部热带果树生物学重点实验室,广东 湛江 524091)
【研究意义】番茄为茄科番茄属一年生或多年生蔬菜作物,富含维生素、胡萝卜素及番茄红素等营养物质,是我国重要的蔬菜作物,同时也是研究果实成熟和植物逆境胁迫的模式植物。番茄在生长过程中常受到不利生长环境的影响,如病原微生物侵染、干旱、盐、高温、冷害等生物和非生物胁迫,对番茄生产造成严重危害。前期研究表明泛素结合酶变体(UEV)参与DNA损伤,激素信号和非生物胁迫等多种生物学功能。对番茄UEV家族基因进行全面的生物信息学、组织特异性表达及非生物胁迫条件下的表达进行分析,有利于深入了解UEV家族基因的功能,并对番茄抗逆基因挖掘和抗逆育种具有重要意义。【前人研究进展】泛素是一种含有76种氨基酸的小分子蛋白,在真核生物中高度保守[1]。蛋白泛素化是指泛素分子在一系列特殊的酶作用下,将细胞内的蛋白质分类,从中选出靶蛋白,并对靶蛋白进行特异性修饰的过程。蛋白泛素化过程主要通过泛素活化酶(E1,Ub-activating enzyme,UBA)、泛素结合酶(E2,Ub-conjugating enzyme,UBC)和泛素连接酶(E3,Ub-ligase)三种酶来实现[2]。Lys48泛素链是26s蛋白酶体降解途径中起靶向作用的主要类型[3]。Lys63泛素链是第二种丰富的形式,其作用主要作为信号靶向蛋白质[4]。UBC13是目前已知的参与催化目标蛋白形成非典型的Lys63-linked的多聚合泛素链的E2蛋白,而这一过程的实现必须依赖于一个UEV与UBC13形成异质二聚体[5-6]。在拟南芥中,UBC13基因参与了DNA损伤[7]、顶端优势[8]、铁代谢[9]、免疫[10]、生长素信号[11]、响应低温和病原菌侵害[12],而这些过程必须依赖UEV蛋白来实现,因此UEV参与许多重要的生命过程,具有重要的意义。UEV(Ubiqutin E2 enzyme variants)蛋白在序列和结构上与E2s相似,也存在150个左右的氨基酸组成的保守UBC结构域,但是缺少半胱氨酸活性催化位点[13],因此作用与E2s有所不同。在酵母和动物中,UEV1在DNA损伤修复,激酶活化和识别等许多生物过程中具有重要作用[5,14]。第一个被鉴定的UEV1基因是在酵母芽细胞中被鉴定出来的MMS2,MMS2参与酵母的DNA损伤[15]。单细胞真核生物基因组只有一个UBC13和UEV基因[15],而高等真核生物基因组通常包含多个UBC13和UEV的同源基因,表明它们可能赋予不同的生物学功能[16-18]。拟南芥中有4个UEV1基因,4个基因均可以补充酵母mms2缺失突变体,而UEV1D缺失植株对DNA损伤剂的耐受性大大降低[16]。水稻中存在4个UEV1基因,OsUEV1s的表达能够拯救酵母mms2突变体,使其免于DNA损伤剂造成的死亡[17]。短柄草存在3个UEV1基因,3个BdUEV1s可与BdUBC13s结合,在体外催化Lys63-linked多聚泛素化,而且能在功能上弥补mms2酵母突变体DNA损伤耐受中的缺陷[18]。COP10是植物中研究较为清楚的UEV蛋白,研究发现COP10作为植物光形态建成的负调控因子,通过与DNA损伤结合蛋白DET1和DDB1相互结合形成复合物COP10-DET1-DDB1,催化关键光形态建成转录因子HY5的降解,进而参与调控拟南芥叶片的感光性及光周期过程[19-20]。【本研究切入点】UEV作为植物中特殊的E2-like蛋白,在植物DNA损伤,光形态建成等方面发挥重要作用。番茄作为重要的蔬菜和模式植物,其有关UEV基因的研究尚未见报道。【拟解决的关键问题】本研究从番茄基因组鉴定SlUEV基因,分析其理化性质、基因结构、保守结构、进化关系,明确其组织表达差异及其在高盐、干旱、高温和低温胁迫下的表达模式,以期为研究SlUEV基因功能和抗逆调控作用奠定基础,同时也为番茄抗逆基因挖掘和抗逆育种提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 番茄材料 试验所用番茄品种为Heinz 1706,种子由中国科学院遗传与发育生物学研究所提供。
1.1.2 组织样品采集 在番茄开花后,分别采集根、茎、叶、花样品,液氮速冻后,-80 ℃保存备用。分别在花后30、40、46和50 d采集番茄幼果、绿熟果、转色果、红熟果放入液氮速冻后,-80 ℃保存备用。
1.1.3 番茄非生物胁迫处理 番茄种子采用10%次氯酸钠溶液消毒10 min,用无菌蒸馏水冲洗5次,放在无菌滤纸上,25 ℃的黑暗中发芽4 d。种子萌发后,在直径13.5 cm的塑料盆中珍珠岩基质种植,在(28±2)℃、光照14 h、暗10 h的温室中生长2周后,选取生长一致的幼苗进行胁迫处理。干旱胁迫:将幼苗放置在15% PEG 6000溶液培养;高盐胁迫:将幼苗放置在200 mmol/L NaCl溶液培养;低温胁迫:将幼苗放置在4 ℃培养箱培养;高温胁迫:将幼苗放置在37 ℃培养;无处理幼苗作为对照。分别在处理0、1、6、24 h后采集样品。所有采集样品用液氮速冻,-80 ℃保存备用。
1.2 试验方法
1.2.1 番茄UEV基因的鉴定 拟南芥全基因组数据库(TAIP)中8个拟南芥UEV蛋白序列为探针,在番茄基因组数据库(https://solgenomics.net/)和Phytozome12.0(https://phytozome.jgi.doe.gov/pz/portal.html)blastn番茄UEV基因候选成员,并利用SMART对候选基因进行保守结构域检验,具备UBCc结构域且不存在半胱氨酸活性位点的蛋白确认为番茄UEV蛋白,同时在Phytozome12.0(https://phytozome.jgi.doe.gov/pz/portal.html)获得其CDS、氨基酸序列及染色体位置等信息。
1.2.2 番茄UEV基因的生物信息学分析 利用GSDS 2.0(http://gsds.cbi.pku.edu.cn/)在线工具绘制番茄UEV基因结构图,分析其外显子和内含子结构。运用在线工具Plant-mPloc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)对番茄UEV蛋白进行亚细胞定位。利用SMART(http://smart.embl-heidelberg.de/)分析番茄UEV蛋白的保守结构域,并用TBtools绘图。利用MEME(http://meme-suite.org/tools/meme)在线工具对番茄UEV蛋白的保守基序进行预测,参数中预测数目设置为5,长度设置为6~50,其他参数均为默认设置。利用ClustalX(1.83)将拟南芥和番茄UEV蛋白序列进行同源序列比对,并利用MEGA 6.0软件,采用相邻连接法(Neighbor-Joining,NJ)构建拟南芥、番茄UEV蛋白的系统进化树,校验参数Bootstrap重复为1000次,其他参数均为默认值。
1.2.3 番茄UEV基因的表达 采用植物RNA提取试剂盒(华越洋生物科技有限公司产品)提取番茄不同组织及胁迫处理样品的总RNA,样品RNA经检测质量和浓度后,利用M-MLV(Rnase H-)逆转录酶(TaKaRa公司)反转录得到cDNA模板,稀释备用。番茄UEV基因引物采用Primer Premier 5.0软件进行设计,实验所用引物由广州艾基生物技术有限公司合成,引物序列信息详见表1。实时荧光定量PCR反应在Roche LightCycler480中进行,实时荧光定量PCR试剂盒为SYBR Green Realtime PCR Master mix(TaKaRa公司),反应体系及反应程序详见参考文献[21]。番茄UEV基因的相对表达量采用2-ΔΔCt方法进行计算,表达量上调2倍或者下调1/2以上认为存在差异表达[22]。
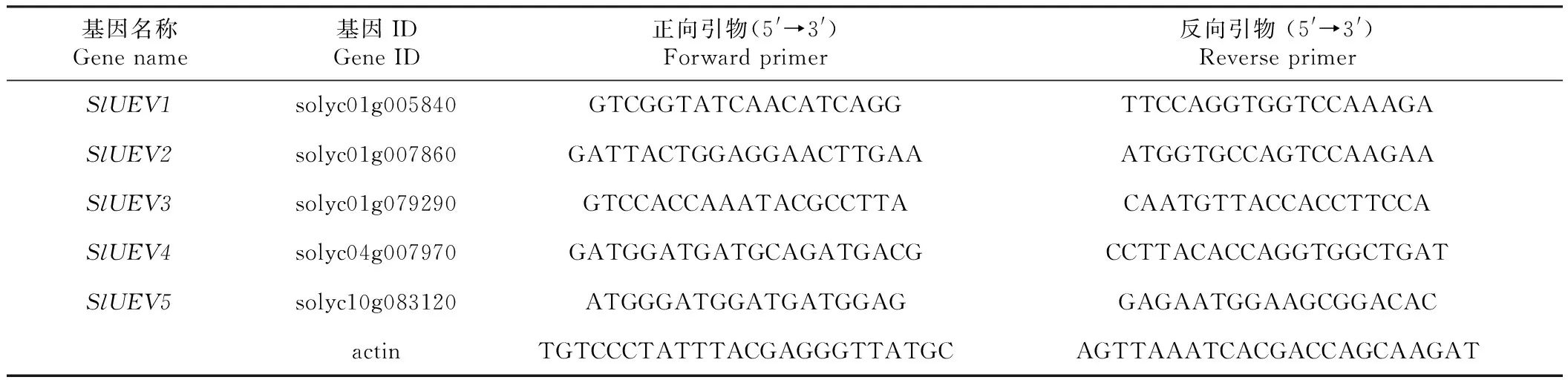
表1 番茄UEV基因实时荧光定量PCR引物Table 1 Primer sequences used in quantitative real-time PCR analysis of UEV genes of tomato
2 结果与分析
2.1 番茄UEV基因鉴定
根据序列比对,筛选到5个番茄UEV基因,根据其在染色体上的位置分别命名为SlUEV1~SlUEV5(表2)。其中SlUEV1,SlUEV2,SlUEV3分布在1号染色体上,SlUEV4分布在4号染色体,SlUEV5分布在10号染色体。SlUEV的CDS长度在441~855 bp,氨基酸数目在146~284 aa,分子量在16.20~33.14 kD,等电点在5.12~8.52,亚细胞定位预测结果表明SlUEV均定位于细胞核中。基因结构分析发现SlUEV1、SlUEV2、SlUEV5均含有4个外显子,SlUEV4包含5个外显子,而SlUEV3仅含有1个外显子(图1)。
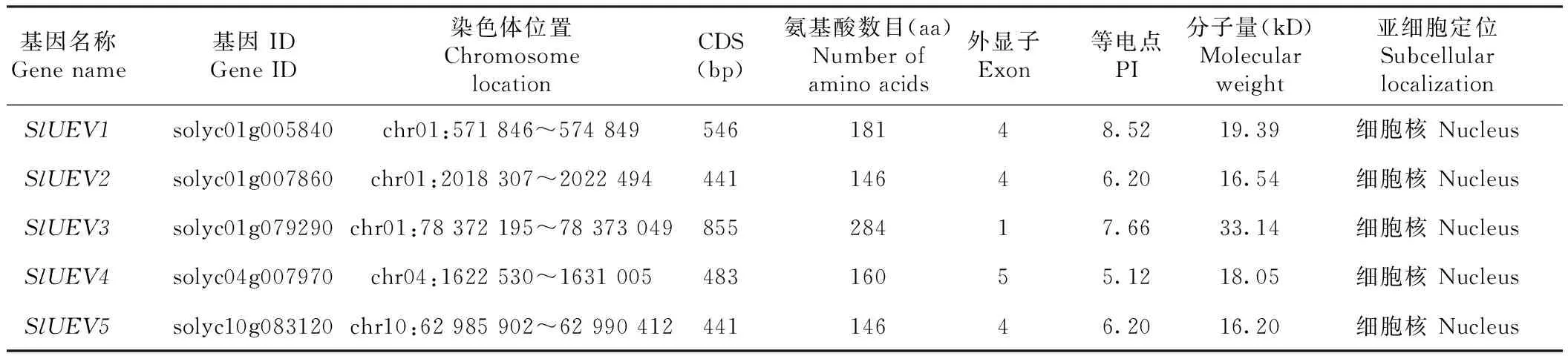
表2 番茄UEV基因的序列信息Table 2 Sequence information of UEV genes in tomato
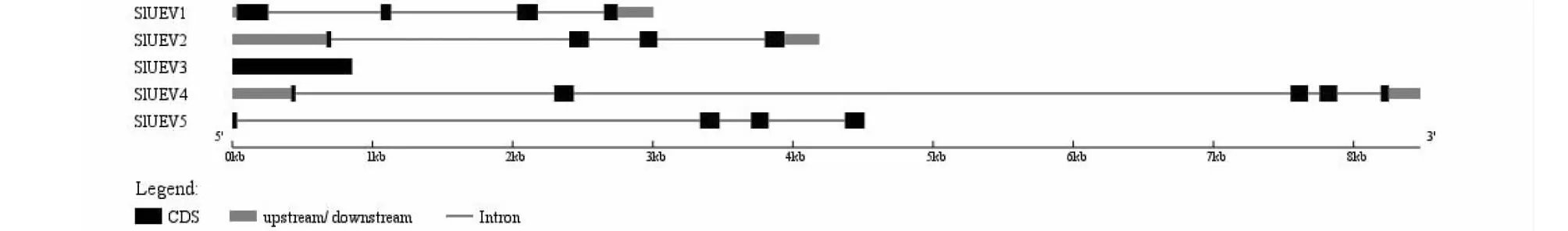
图1 番茄UEV基因结构Fig.1 Structure of UEV genes in tomato
2.2 番茄UEV进化树及蛋白结构域分析
对2个酵母UEV蛋白、8个拟南芥UEV蛋白和5个番茄UEV蛋白构建系统进化树(图2),结果表明SlUEV1与拟南芥AtCOP10为同源蛋白,属于COP10亚家族。SlUEV2、SlUEV5、SlUEV4属于UEV1亚家族,其中SlUEV2和SlUEV5相似度较高,且与AtUEV1C和AtUEV1D为同源蛋白;SlUEV4与AtUEV1A和AtUEV1B聚在一起,同源性高。SlUEV3属于单个分枝,说明植物UEV家族在单子叶和双子叶植物中有所不同。
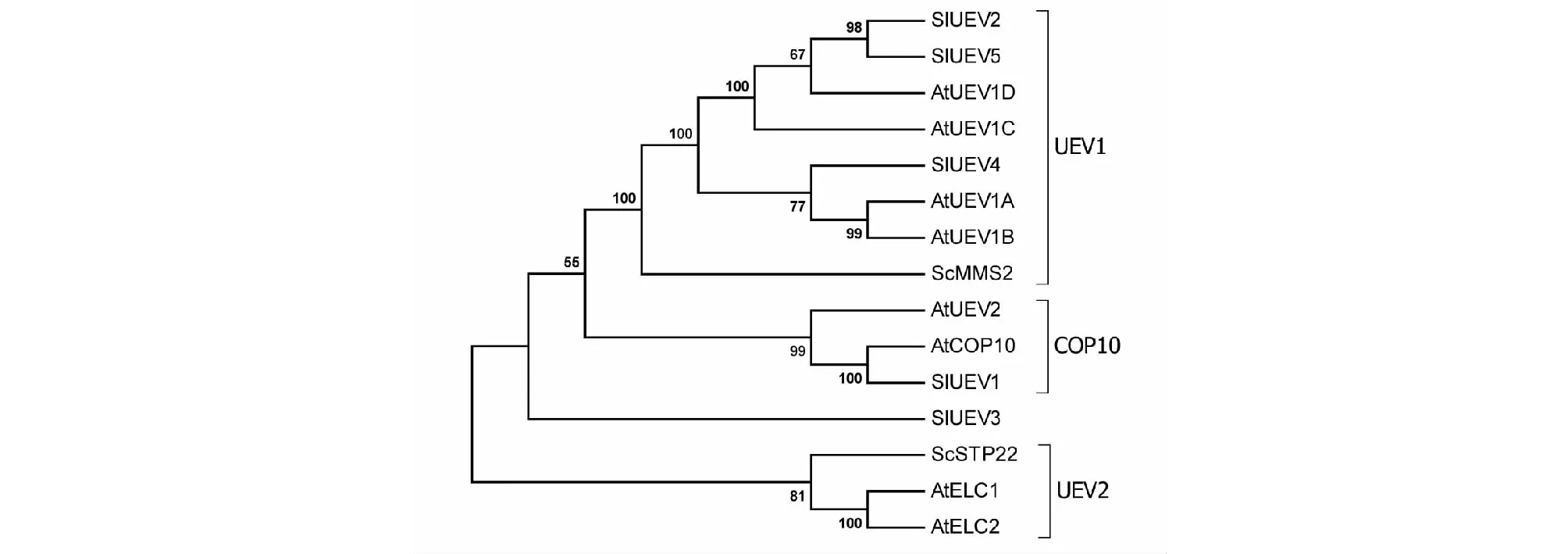
图2 番茄、酵母和拟南芥UEV蛋白进化树Fig.2 Phylogenetic tree of UEV proteins in tomato, yeast and Arabidopsis thaliana
前人研究表明泛素结合酶E2蛋白均拥有一个高度保守的UBCc结构域,N端和C端的大小和结构上存在很大差别,根据是否具有N端和C端延长链,将E2s蛋白分4大亚类,ClassⅠ仅含有UBC/UEV结构域,ClassⅡ包含UBC/UEV结构域和C端延长的蛋白序列,ClassⅢ包含UBC/UEV结构域和N端延长的蛋白序列,ClassⅣ包含UBC/UEV结构域、N端和C端延长的蛋白序列[23]。番茄UEV蛋白的UBCc保守结构域如图3所示,其中SlUEV1属于ClassⅡ家族,SlUEV2、SlUEV4、SlUEV5均属于ClassⅠ家族,SlUEV3属于ClassⅣ家族。与拟南芥的UBCc保守结构域比较发现,同一进化树分枝中的UBCc位置相似,均属于相同亚家族,这也说明UEV家族的进化过程中非常保守。保守基序分析发现:SlUEV2、SlUEV4、SlUEV5存在保守基序数目和分布也非常相似,均存在保守基序1、2、3,另外SlUEV4还存在保守基序5。SlUEV1存在保守基序1和4,SlUEV3存在保守基序1、4、5(图4)。
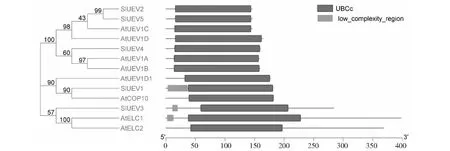
图3 番茄和拟南芥UEV蛋白的UBCc保守结构域Fig.3 The UBCc conserved protein domain of UEV proteins in Arabidopsis and tomato.

图4 番茄UEV蛋白保守基序Fig.4 Motif of UEV proteins in tomato
2.3 番茄UEV基因组织表达
5个SlUEV基因在番茄不同组织中的表达模式有差异(图5)。其中SlUEV1在番茄茎中的表达量最高,在根中表达量较低,另外SlUEV1在花和果实发育期的表达量也较高。SlUEV3在花中的表达量最高,在花中特异表达,预示其可能在番茄花发育过程中发挥作用,且SlUEV3在番茄果实成熟过程中表现表达差异,在红熟果中的表达量显著增加,预示其可能在果实成熟中发挥作用。SlUEV4在番茄果实成熟的各个阶段均有较高表达量,预示SlUEV4可能参与番茄果实的发育过程。SlUEV2和SlUEV5在番茄不同组织间无差异表达,呈现组成性表达。
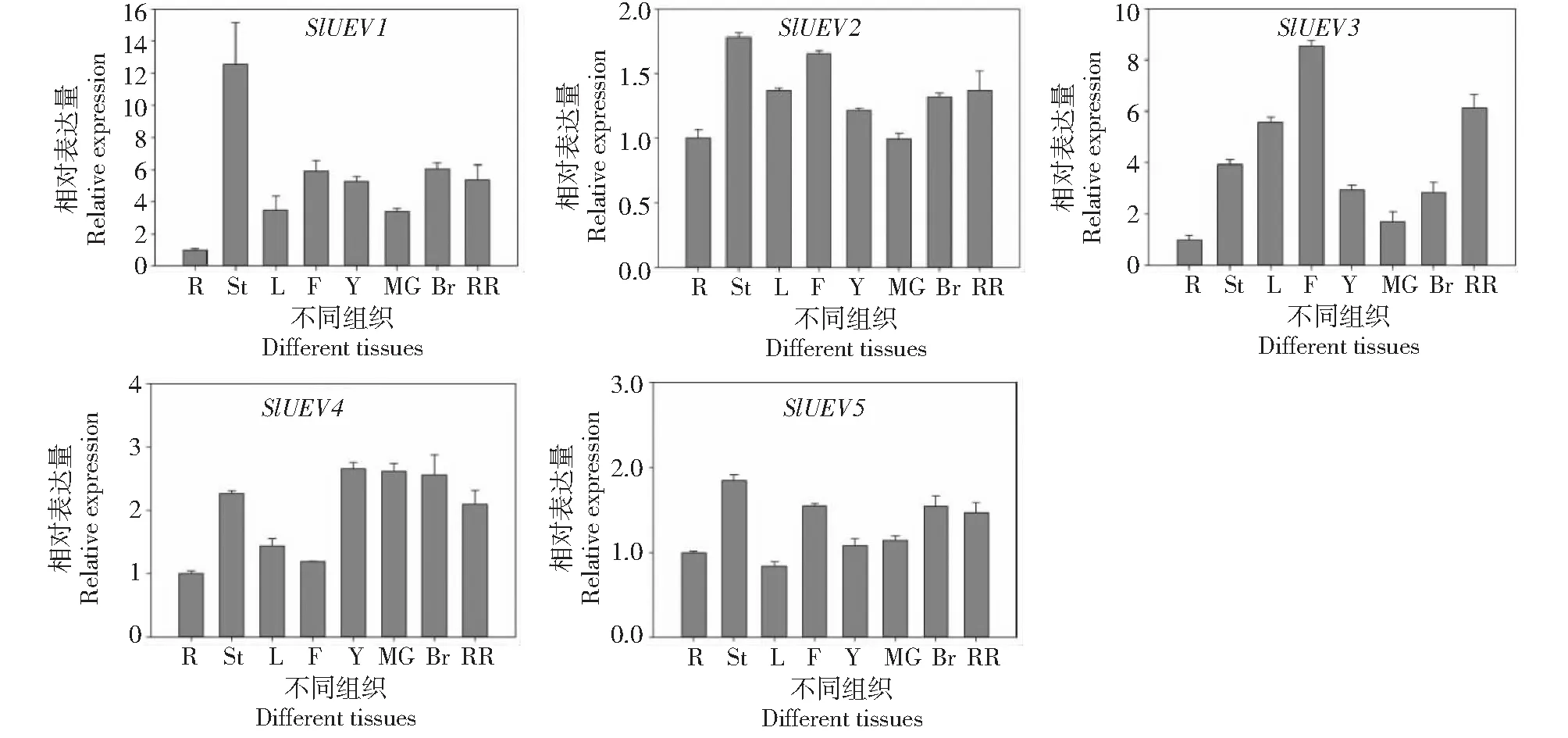
R:根;St:茎;L:叶;F:花;Y:小果,MG:绿果;Br:转色果,RR:红熟果R: Root; St: Stem; L: Leaf; F: Flower; Y: Young fruits; MG: Green fruits; Br: Breaker fruits; RR: Red ripe fruits图5 番茄UEV基因在番茄不同组织部位的表达Fig.5 Differential expression levels of UEV genes in different tissues of tomato
2.4 番茄UEV基因在非生物胁迫下的表达
对番茄幼苗进行高盐、干旱、低温、高温的非生物胁迫试验,结果(图6)表明:番茄UEV基因对干旱处理的响应最为敏感,其中SlUEV1的表达量在干旱处理6和24 h分别为0 h的5.5和4.4倍;SlUEV2的表达量在干旱处理6 h为0 h的2.74倍;随着干旱处理时间的延长,SlUEV3的表达量呈上升趋势,在干旱处理1、6、24 h分别为0 h的3.40、6.02、7.87倍。SlUEV5在干旱处理6 h的表达量为0 h的2.38倍,而干旱处理下,SlUEV4基因的表达量无差异。盐胁迫下SlUEV1表达量无差异,而SlUEV2和SlUEV5分别在盐胁迫处理6 h出现下调表达,SlUEV3和SlUEV4分别在盐胁迫处理24 h时出现上调表达。冷胁迫处理下SlUEV1和SlUEV3基因的表达量呈现先升高后降低的趋势,但是与0 h的表达量相比无差异;SlUEV2和SlUEV5在冷胁迫下基因表达无差异;冷胁迫下SlUEV4基因的表达量呈现先升高后降低的趋势,且在1 h表达量为0 h的2.05倍,呈差异表达。高温胁迫条件下SlUEV2、SlUEV4和SlUEV5表达量呈现下降趋势,且在24 h表达量最低,差异均在2倍以上,呈差异表达。SlUEV3表达量在高温胁迫下有略微升高,但与0 h的表达量无差异。SlUEV1表达量在高温胁迫24 h下降至0 h的0.44倍,呈差异表达。
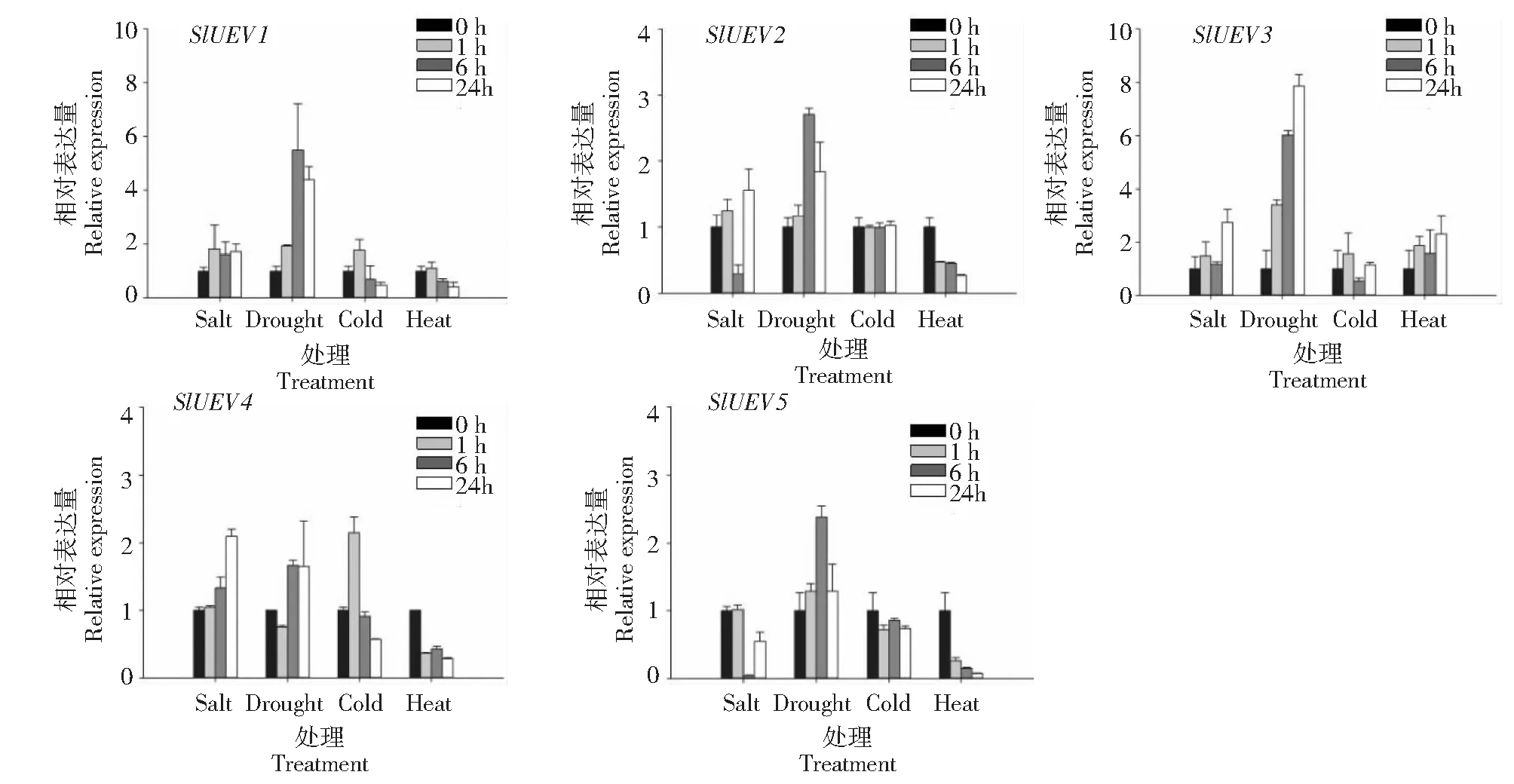
图6 番茄 UEV 基因在高盐、干旱、低温和高温胁迫下的表达分析Fig.6 Analysis of expression levels of the UEV genes in tomato under salt, drought, cold and heat stresses
3 讨 论
泛素结合酶变体(UEV)蛋白在性质和结构上与泛素结合酶(E2)相似,但由于缺乏催化的半胱氨酸残基,它们无法与泛素形成硫醇酯键连接,因此其在生物体中的作用也与E2不同。研究表明UEV与UBC13组成形成稳定的异源二聚体来介导Lys63-linked多聚泛素化。单细胞真核生物基因组通常包含单个UEV基因,而在高等植物中发现了多种同源基因,且在不同物种中的UEV基因数目存在差异。在酵母中仅存在1个UEV基因,而在拟南芥和水稻中存在8个UEV基因,其中4个UEV基因可以与UBC13形成稳定的异源二聚体。高粱[24]和龙眼[22]和可可[25]中分别存在7、3和6个UEV基因。本研究从番茄中鉴定到5个UEV基因,进化树分析可以分为3类,SlUEV2、SlUEV5、SlUEV1属于UEV1亚家族,且SlUEV2、SlUEV5间的同源性较高,其保守结构域和保守基序也相似。SlUEV4属于COP10亚家族,SlUEV3与拟南芥的UEV蛋白并未聚在一起,表明植物UEV家族在单子叶和双子叶植物中有所不同。
基因在不同组织的表达模式影响基因功能的发挥。水稻中OsUEV1B和OsUEV1C在不同组织中的表达水平较高且较为一致,OsUEV1A转录水平较低,且表达量在各部位较为一致。OsUEV1D在不同组织中的表达差异较大,其中OsUEV1D在叶片的各部位表达量高,但在花粉和精子细胞中的表达量较低[17]。双穗短柄草中存在3个UEV1基因,组织表达分析发现BdUEV1C在2周大的叶片(L2)和8周大的穗(SP8)中的表达量增加,而BdUEV1A和BdUEV1B的表达量在各组织间呈组成型表达,表达量较为一致[18]。番茄UEV基因组织表达分析发现5个SlUEV基因在不同组织的表达量存在差异,SlUEV1在番茄茎中的表达量最高,而SlUEV3在花中的表达量最高,SlUEV4在果实发育期的表达量明显高于其他生育时期,SlUEV2、SlUEV5属于同源基因,它们在番茄不同组织中呈现组成性表达。综上所述番茄UEV基因可能在番茄组织的不同发育时期起到不同的调节作用。
植物由于它们的固着性,不断地受到不同类型的胁迫,如紫外线照射下的DNA损伤、盐和干旱胁迫等,这些胁迫严重损害植物的生存,降低作物产量。研究表明:UEV基因参与泛素化过程,而泛素化过程往往与植物的应激反应有关。前期研究表明UEV可以应答非生物胁迫,但是在不同作物中UEV基因对非生物胁迫的应答模式不尽相同。如Jia等[24]发现高粱中存在7个UEV基因,分别命名为SbUBC2、SbUBC12、SbUBC14、SbUBC29、SbUBC32、SbUBC37、SbUBC40。其中SbUBC2、SbUBC12、SbUBC14在盐胁迫下显著上调表达,SbUBC29、SbUBC40在干旱处理下显著下调,SbUBC2、SbUBC14在干旱处理下显著上调,其中SbUBC40在盐胁迫和干旱胁迫处理下表达量均上调10倍以上,表明SbUBC40可以强烈响应干旱和盐胁迫。Jue等[22]研究发现龙眼中仅存在3个UEV基因,命名为DlUBC4、DlUBC6、DlUBC9,其中DlUBC6在非生物胁迫下表达量无显著变化,而DlUBC4、DlUBC9在高温处理下显著上调表达,而对冷胁迫无明显应答。非生物胁迫处理发现3个双穗短柄草BdUEV1基因表达量均受冷胁迫诱导上调表达,而高温和干旱胁迫下BdUEV1的表达量显著上调,暗示该基因受高温和干旱胁迫诱导[17]。本研究结果表明:番茄UEV基因对干旱胁迫较为敏感,干旱胁迫时SlUEV1、SlUEV2、SlUEV3和SlUEV5均显著上调表达,而SlUEV4在干旱胁迫下无显著变化,说明番茄UEV基因表达受干旱胁迫诱导。而高温和低温胁迫下,UEV基因表达量变化较小,表明番茄UEV基因可能不响应环境中的温度变化。SlUEV2、SlUEV5高盐胁迫下在6 h时显著下调表达,表明这些基因对盐胁迫负响应。
4 结 论
从番茄基因组数据库中鉴定到5个UEV家族基因,分别分布在1、4、10三条染色体上,系统进化树分析将其分为3个亚家族。多个SlUEV基因在番茄不同组织表达存在差异。SlUEV1,SlUEV2,SlUEV3和SlUEV5基因受干旱胁迫诱导上调表达,推测其在番茄适应干旱胁迫过程中起着重要作用,对SlUEV2、SlUEV5高盐胁迫时显著下调表达,推测其负调控番茄盐胁迫,对温度胁迫响应较小。本研究为深入开展SlUEV基因在植物生长和逆境胁迫响应中的功能研究提供理论基础。

