铁蛋白自噬在癌症发生发展中作用的研究进展*
闻照凤 , 李延莉 ,2△
(1安徽医科大学基础医学院病理解剖学教研室,安徽 合肥 230032;2安徽医科大学第一附属医院病理科,安徽 合肥 230022)
铁蛋白自噬是细胞内的铁蛋白被核受体辅激活因子4(nuclear receptor coactivator 4,NCOA4)特异性识别后通过自噬体运输至溶酶体中进行降解释放游离Fe2+的过程。铁蛋白自噬通过调节细胞内的铁含量,进而参与细胞生长、增殖、分化、凋亡等多个重要生理过程,因此必须受到严格的调控,以避免在上述生理过程中出现铁稳态失衡。如在红细胞生成过程中,铁蛋白自噬不足会导致细胞内铁含量过低诱发贫血;而铁蛋白自噬过度则会导致细胞内铁含量过高引起铁死亡,铁死亡是细胞内过多游离Fe2+通过Fenton 反应产生大量活性氧(reactive oxygen species,ROS)引起脂质过氧化物累积,破坏细胞膜引起的不同于凋亡的细胞程序性死亡方式,其特征是胞内出现ROS 的大量堆积。近年,铁蛋白自噬逐渐成为研究热门,并且研究表明铁蛋白自噬在癌症的发生发展中起重要作用。因此,本文主要阐述铁蛋白自噬的概念、过程与调控,并就铁蛋白自噬在癌症发生发展中的研究进展进行综述,以期为临床上以铁蛋白自噬过程为靶点治疗癌症提供参考资料。
1 铁蛋白自噬的概念
自噬是指真核细胞内的病原体、衰老或损伤的细胞器等被自噬体吞噬后运送至溶酶体中降解的过程,其目的是维持细胞内的稳态[1]。铁蛋白自噬是自噬的一种特殊类型,在铁蛋白自噬过程中,NCOA4选择性识别细胞内的铁蛋白并将其运送至溶酶体中降解释放游离Fe2+。铁蛋白是细胞内储存铁的蛋白复合体,由包含铁蛋白重链1(ferritin heavy chain 1,FTH1)和铁蛋白轻链(ferritin light chain,FTL)在内的24 个亚基组成,每个铁蛋白可结合高达4 500 个Fe3+[2];铁蛋白将铁以稳定的 Fe3+储存起来,防止细胞内产生过多的游离Fe2+,并在细胞内可利用铁降低时释放储存的铁来维持细胞内铁稳态。铁蛋白主要通过蛋白酶体和溶酶体2条途径来实现Fe2+释放[3-4],其一就是 Mancias 等[5]于 2014 年通过定量蛋白组学证实的由NCOA4 介导的铁蛋白通过溶酶体进行降解释放游离Fe2+的过程,即铁蛋白自噬(ferritinophagy)。
2 铁蛋白自噬的过程
在铁蛋白自噬过程中,NCOA4 作为一种选择性自噬货物受体,与铁蛋白特异结合,介导铁蛋白传递至自噬体,随后运输至溶酶体进行降解并释放游离Fe2+[6]。经定量蛋白组学证实,NCOA4 是分子质量为70 kD 的蛋白质,包含NCOA4α、NCOA4β、NCOA4-N末 端 和 NCOA4-C 末 端 四 个 部 分 ,NCOA4α 和NCOA4β 共享 N 端盘绕结构域和 C 端一小部分[7]。Mancias 等[6]证实 NCOA4 与铁蛋白的结合部位具体定位到 NCOA4α 与铁蛋白 FTH1 亚基,且 FTH1 R23是两者结合必需的结构;当FTH1 R23 发生突变时,即使是在铁蛋白自噬激活状态下,NCOA4 与铁蛋白的结合也会受到抑制。另一项研究同样证实这种相互作用,并且表明FTH1 可以结合多达24 个NCOA4片段[8]。铁蛋白与NCOA4 结合后,通过自噬体运输最终到达溶酶体,在溶酶体中降解释放出游离Fe2+,进而参与细胞各种生理和病理过程。
3 铁蛋白自噬受细胞内Fe2+调控
铁蛋白自噬过程受到细胞内Fe2+水平的严格调控,Fe2+通过调节NCOA4 水平达到调控铁蛋白自噬的目的,且 Fe2+与 NCOA4 水平呈负相关[9]。Mancias等[5]研究表明NCOA4 具有多个泛素化位点,与包含HECT 和 RLD 结构域的 E3 泛素蛋白连接酶 2(HECT and RLD domain containing E3 ubiquitin protein ligase 2,HERC2)具有高度亲和力。当细胞内Fe2+充足时,NCOA4 与 HERC2 结合稳定,促进 NCOA4 通过蛋白酶体降解,降低NCOA4 水平,抑制铁蛋白自噬过程,同时促进铁蛋白的累积;当细胞内Fe2+不足时,NCOA4 与 HERC2 的结合减弱,NCOA4 通过蛋白酶体降解的途径受阻,导致NCOA4 水平增加,进而促进铁蛋白自噬过程,见图1。另一项研究证实铁蛋白与NCOA4的结合位点和NCOA4与HERC2的结合位点相同[6]。尽管目前对NCOA4与铁蛋白相互作用和铁蛋白自噬调控的研究已取得一定成果,但仍存在问题需要进一步研究探索,如HERC2与NCOA4的结合和铁蛋白与NCOA4 的结合是否相互排斥?NCOA4 是否能够识别其它物质发生自噬?NCOA4如何识别铁?
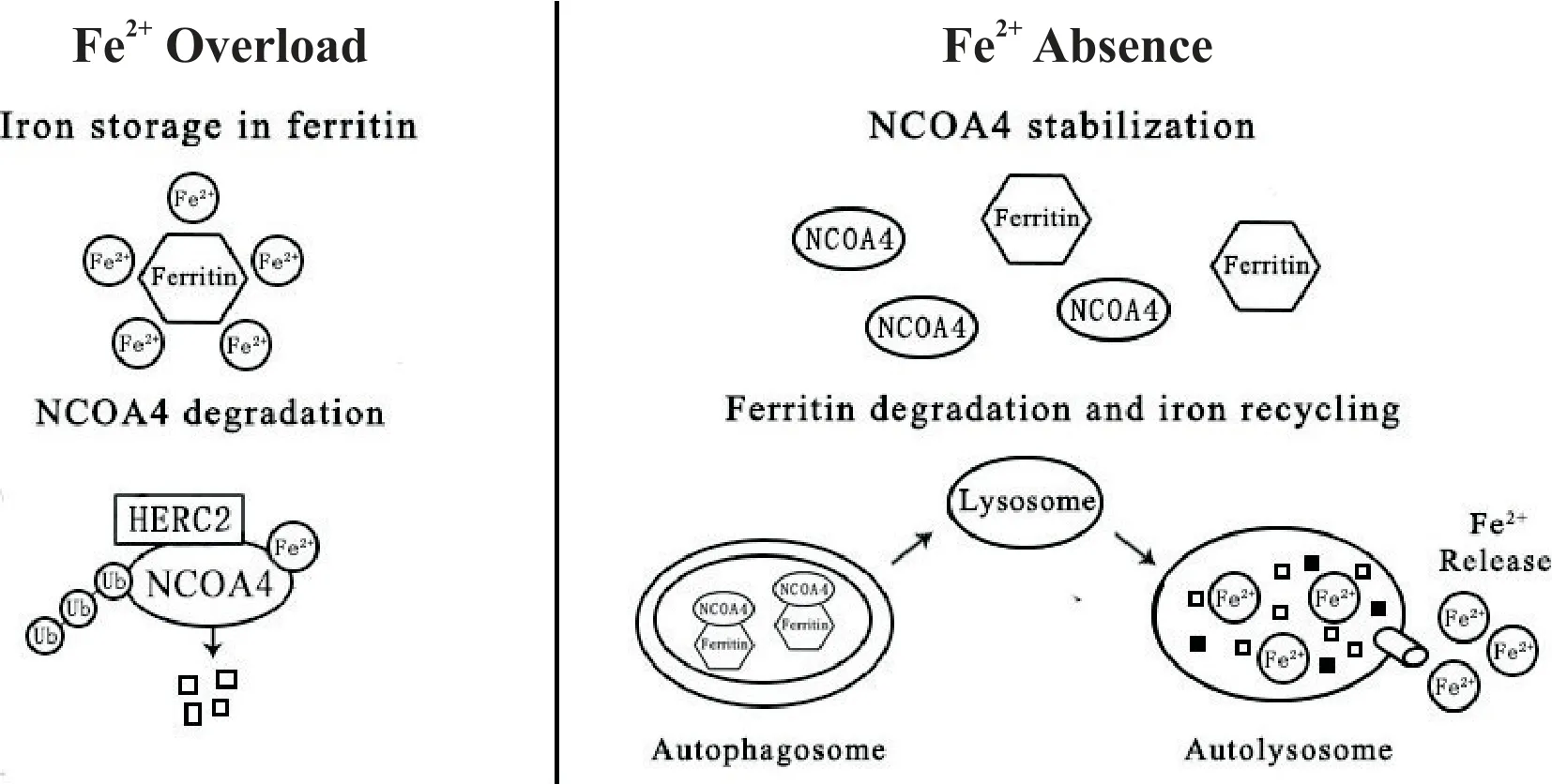
Figure 1. The regulation of ferritinophagy. The level of free Fe2+ regulates NCOA4-mediated ferritinophagy. When Fe2+ overload,NCOA4 binds with HERC2 for degradation and ferritinophagy is attenuated. When Fe2+ absence,ferritin binds to NCOA4 for degradation via autophagosome and lysosome. NCOA4:nuclear receptor co-activator 4;HERC2:HECT and RLD domain containing E3 ubiquitin protein ligase 2.图1 铁蛋白自噬过程受到细胞内游离Fe2+的调控
4 铁蛋白自噬与铁死亡的联系
Dixon等[10]在2012年首次报道铁死亡,这是一种不同于凋亡的细胞程序性死亡方式;Doll 等[11]证实铁死亡的特征是胞内出现大量依赖于游离Fe2+方式产生的ROS堆积。铁蛋白自噬通过调节细胞内游离Fe2+以及ROS的产生在铁死亡中发挥作用,而细胞内游离Fe2+又调控铁蛋白自噬过程。铁蛋白自噬过程启动后,细胞内的铁蛋白降解释放游离Fe2+,过多的Fe2+通过Fenton 反应在短期内产生大量ROS累积,这是铁死亡发生的重要环节[12]。
5 铁蛋白自噬在不同系统肿瘤中的研究进展
5.1 铁蛋白自噬在消化系统肿瘤发生发展中的研究进展 消化系统肿瘤的发病率一直较高,而且缺乏有效提高存活率的治疗手段,但是近年,对肿瘤的深入研究显示铁蛋白自噬在人肝癌、胃癌、胰腺癌细胞和鼠结肠癌细胞的发生发展中起作用,这为临床上消化系统肿瘤的治疗提供了参考。Huang 等[13]于2018年报道一种新型铁螯合剂DpdtC(di-2-pyridylketone dithiocarbamate)通过调控铁蛋白自噬过程抑制人肝癌细胞增殖,DpdtC 处理过的人肝癌细胞株HepG2和Bel-7402中铁蛋白含量降低,自噬标志物微管相关蛋白1 轻链3-II(LC3-II)和铁蛋白自噬受体NCOA4 含量升高;用自噬阻断剂3-甲基腺嘌呤(3-methyladenine,3-MA)阻断自噬过程能阻止铁蛋白的降低,所以DpdtC通过诱导肿瘤细胞发生铁蛋白自噬过程产生ROS进而抑制肿瘤细胞增殖。与以上结果一致,Feng 等[14]发现,DpdtC 在胃癌 MGC-803 细胞中可诱发铁蛋白自噬,进一步触发ROS/P53通路而抑制上皮-间充质转化(epithelial-mesenchymal transition,EMT),从而起到抑制MGC-803 细胞增殖的作用。EMT 是上皮细胞转化为间充质细胞的过程,与肿瘤的转移以及耐药有关,胃癌中存在EMT过程[15];经过DpdtC 处理的 MGC-803 细胞 EMT 受到抑制,上皮标志物E-cadherin 表达上调,间充质标志物vimentin 表达下调,同时 ROS 和 P53 含量增加;ROS 清除剂N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)、自噬阻断剂 3-MA 或 P53 抑制剂 pifithrin-α(PFT-α)的应用则使DpdtC引起的EMT抑制减弱。Xu等[16]的研究表明DpdtC 诱导胃癌细胞SGC-7901 和BGC-823 发生铁蛋白自噬,通过Fenton 反应产生的ROS 激活ROS/P53,同时使其下游AKT/mTOR 通路受到抑制,EMT 也受到抑制;P53抑制剂PFT-α、自噬阻断剂3-MA、ROS清除剂NAC 的应用均可减弱DpdtC 诱导的铁蛋白自噬、EMT 抑制和细胞增殖抑制,证实铁蛋白自噬是DpdtC抑制胃癌细胞增殖过程中的重要环节。
DpdtpA 与DpdtC 结构类似,有研究证实其也可通过调节铁蛋白自噬过程抑制肿瘤细胞增殖。利用DpdtpA 处理小鼠结肠癌细胞株CT26 细胞后,CT26细胞产生大量ROS 的同时伴有铁蛋白降低、NCOA4和LC3-II表达上调、EMT受到明显抑制,证实DpdtpA诱导小鼠结肠癌细胞株CT26 细胞发生铁蛋白自噬产生大量的ROS 参与抑制EMT 过程起到抑制肿瘤细胞增殖的作用[17]。同样,DpdtpA 作用于 HepG2 细胞引起细胞周期阻滞、凋亡和铁死亡的同时还检测到细胞中铁蛋白降低及NCOA4 和LC3-II 表达升高;利用小干扰RNA 降低HepG2 细胞NCOA4 的表达或者使用自噬阻断剂3-MA 阻断铁蛋白自噬途径后,DpdtpA 引起铁蛋白、NCOA4 和 LC3-II 的改变明显减弱,肿瘤细胞的凋亡和铁死亡也明显减弱,证实铁蛋白自噬在DpdtpA 抑制HepG2 细胞过程中起重要作用[18]。Guan 等[19]报道 DpdtbA 在胃癌细胞中可通过诱发铁蛋白自噬产生ROS 和Fe2+调控P53 和PHD2/hif-1α通路,抑制EMT过程进而抗肿瘤。
亚甲基丁二酸是由感染的哺乳动物巨噬细胞产生并分泌的一种物质,可以通过多种机制减少促炎细胞因子的产生[20],也可损伤线粒体导致代谢异常造成细胞死亡[21],有研究证明其可通过调节铁蛋白自噬抗肿瘤。Qu 等[22]证实超过生理剂量的亚甲基丁二酸使人胰腺癌细胞株PANC1 细胞发生铁死亡,伴有FTH1 表达降低,LC3-II 表达升高,提示铁蛋白自噬被激活;将PANC1 细胞中介导铁蛋白自噬的NCOA4和自噬相关的ATG5敲减后,用亚甲基丁二酸作用于该细胞,结果显示亚甲基丁二酸失去抑制PANC1 细胞增殖的能力;在裸鼠皮下移植NCOA4敲减的和未经过任何处理的PANC1 细胞,结果同样显示亚甲基丁二酸不能抑制NCOA4敲减组移植瘤的生长。Lin 等[23]的实验证实新型铁死亡诱导剂重楼皂苷B(saponin Formosanin C,FC)通过诱导NCOA4高表达、FTH1低表达的人肝癌细胞HepG2发生铁蛋白自噬触发铁死亡起到抑制肿瘤作用。
铁蛋白自噬过程不仅在抑制肿瘤细胞增殖的过程中起作用,有研究表明其也参与胰腺导管腺癌的发生发展及耐药过程。Shang 等[24]在胰腺导管腺癌细胞和组织中检测出与肿瘤细胞增殖、迁移、凋亡和癌症进展相关的蛋白质三基序蛋白家族11(tripartite motif-containing 11,TRIM11)高表达,通过建立TRIM11高表达和低表达的PANC-1细胞株进行细胞实验和动物实验,证实TRIM11 通过调控UBE2NTAX1BP1 信号通路抑制铁蛋白自噬过程,进而促进胰腺导管腺癌的发生发展及耐药。
5.2 铁蛋白自噬在泌尿系统肿瘤发生发展中的研究进展 泌尿系统肿瘤是严重危害男性健康的一类肿瘤,对其发生发展新机制及新治疗手段的探索一直未停止。Mou 等[25]通过癌症基因组库(The Cancer Genome Atlas,TCGA)和基因表达库(Gene Expression Omnibus,GEO)收集数据分析表明,肾透明细胞癌中NCOA4 蛋白表达降低,并且NCOA4 表达越低,肿瘤的恶性程度越高;单因素和多因素分析表明NCOA4表达高的肾透明细胞癌患者总体存活率较高;NCOA4低表达的肾透明细胞癌组织中浸润的免疫细胞数量也明显缺乏。另一项研究同样证实NCOA4介导的铁蛋白自噬与泌尿系统肿瘤密切关系,即使用高于生理水平的睾酮(supraphysiological levels of testosterone,SupraT)处理雄激素敏感的人前列腺癌细胞株LNCaP 细胞后,细胞内铁蛋白水平降低、铁蛋白与LC3B 阳性的自噬小体共定位,但是将LNCaP 细胞NCOA4敲减后,铁蛋白自噬和铁死亡过程均被抑制,证实NCOA4介导的铁蛋白自噬在SupraT抑制人前列腺癌细胞过程中起重要作用[26]。
5.3 铁蛋白自噬在神经系统肿瘤发生发展中的研究进展 铁蛋白自噬在神经系统退行性疾病中的研究较多,然而在神经系统肿瘤中的研究则甚少,目前报道出与铁蛋白自噬相关的神经系统肿瘤只有胶质瘤。胶质瘤是神经系统比较常见的原发性肿瘤,恶性程度和致死率均较高,所以亟待寻找其发生发展的新机制。新城疫病毒(Newcastle disease virus,NDV)能够诱导胶质瘤细胞发生铁蛋白自噬引起胶质瘤细胞铁死亡,将NDV感染的人胶质瘤细胞株U251细胞中介导铁蛋白自噬的基因NCOA4或自噬相关基因ATG5敲减,胞内ROS和Fe2+明显降低,U251细胞也不能发生铁死亡[27]。Hayashima等[28]在胱氨酸消耗引起胶质瘤细胞死亡的研究中同样证实了铁蛋白自噬的重要作用,在胱氨酸消耗后的胶质瘤细胞中,FTH1 降低、LC3-II 增多,但是溶酶体抑制剂巴弗洛霉素A1 的应用或者降低肿瘤细胞NCOA4表达抑制铁蛋白自噬均使胱氨酸消耗引起的FTH1 和LC3-II 发生的变化减弱,同时抑制肿瘤作用也减弱。
5.4 铁蛋白自噬在其它肿瘤发生发展中的研究进展 除消化系统、泌尿系统及神经系统肿瘤,有研究表明在人宫颈癌、甲状腺未分化癌和鼠乳腺癌细胞发生铁死亡过程中也涉及铁蛋白自噬。铁死亡诱导剂erastin 诱导人宫颈癌HeLa 细胞发生铁死亡,但是NCOA4敲减的HeLa 细胞对erastin 反应不敏感,且细胞内的铁蛋白未降低,证实erastin 诱导HeLa 细胞发生铁死亡是通过调控铁蛋白自噬过程实现的[29]。同样,维生素C 作为一种广泛的抗癌药物,在甲状腺未分化癌细胞中诱发铁蛋白自噬,导致Fe2+累积,通过Fenton 反应产生过量ROS,最终引起肿瘤细胞发生铁死亡而起到抑制肿瘤作用[30]。FPBC@SN 是一种靶向治疗肿瘤的pH 敏感的纳米分子颗粒药物,在细胞质酸性条件下分解为索拉非尼(sorafenib,SRF)和吲哚胺2,3-双加氧酶(肝脏外色氨酸代谢为犬尿氨酸的唯一限速酶)[31]的抑制剂 NLG919。Zuo 等[32]发现,FPBC@SN 可将SRF 传递至小鼠乳腺癌4T1 细胞中,上调NCOA4 的表达,激活铁蛋白自噬,释放游离Fe2+并通过Fenton 反应产生大量ROS,从而导致4T1细胞发生铁死亡。
以上研究均表明铁蛋白自噬的激活发生在抑制肿瘤的过程中,然而Zhao 等[33]通过细胞和动物实验证明了铁蛋白自噬的不同作用,骨肉瘤干细胞长期置于0.2~0.4 T 的静态磁场后,铁蛋白自噬被激活,其集落形成能力增强;建立小鼠骨肉瘤干细胞移植瘤模型后,将小鼠长期置于0.2~0.4 T 的静态磁场中,结果观察到肿瘤的体积和质量未发生明显变化,但是肿瘤表现出向肺部转移的偏好,所以一定强度的静态磁场通过激活铁蛋白自噬影响骨肉瘤干细胞的自我更新和肺部转移偏好。
6 结语
随着铁蛋白自噬研究的不断深入,越来越多的证据证明铁蛋白自噬在癌症发生发展过程中起重要作用,然而目前关于铁蛋白自噬起源、调控机制、涉及信号通路及其对疾病影响的研究仍然处于初步阶段,未来需要对铁蛋白自噬的分子生物学机制以及相关信号通路等进行深入研究,以期为临床上以铁蛋白自噬过程为靶点治疗癌症提供参考资料。

