能量失衡调节kisspeptin系统的可能机制*
徐 瑞, 曹友祥, 夏 秋
(1南京体育学院运动健康学院,江苏 南京 210014;2南京体育学院运动人体科学实验室,江苏 南京 210014;3上海体育学院运动科学学院,上海 200438)
能量稳态是维持生殖功能正常的重要前提。不论是能量过剩的正能量平衡状态还是能量缺失的负能量平衡状态都会对生殖功能产生影响。肥胖会导致女性出现多囊卵巢综合征,男性发生睾丸病变、精子活力降低以及不育等问题;禁食、营养不良则会导致促性腺激素分泌低下、不育症以及女性出现下丘脑性闭经等[1-2]。对于发育期儿童青少年来说,能量失衡更是诱发青春期启动提前/延后的主要原因[3-4]。下丘脑中的Kiss-1 神经元作调控哺乳动物青春期启动和维持生殖功能稳态的关键因子,在能量平衡影响生殖功能稳态这一过程中扮演着能量感受器的角色[5-6]。
下丘脑中的由Kiss-1基因编码的kisspeptin 蛋白是含有145 个氨基酸的神经肽,带有一个精氨酸-苯丙氨酰胺末端基团。kisspeptin能够被切割成更短的生物活性肽:kisspeptin-54、kisspeptin-14、kisspeptin-13 和 kisspeptin-10[7]。目前在各类实验中多以 kisspeptin-10 作为 kisspeptin 全长活性代表[8-9]。下丘脑中的kisspeptin 通过与位于促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)神经元细胞膜上的特异性受体G 蛋白偶联受体54(G-protein-coupled receptor 54,GPR54)结合后刺激GnRH 神经元去极化分泌GnRH,并作用于垂体促进黄体生成素(luteinizing hormone,LH)和卵泡刺激素(folliclestimulating hormone,FSH)释放[10-11]。除控制性腺激素释放和分泌外,下丘脑中kisspeptin 系统的表达水平也受到受机体能量状态的影响[12]。下丘脑弓状核(arcuate nucleus,ARC)中的Kiss-1 神经元能够接收各类能量代谢激素/因子的刺激信号[13],从而影响kisspeptin 系统的表达水平、调控LH/FSH 的释放和生殖器官功能[14-17],解释了机体能量失衡与生殖功能发生关联的原因。随着生殖功能异常发生率逐年升高,近年来国内外学者对各种能量代谢激素/因子影响kisspeptin 系统的分子机制进行了广泛的研究。因此,本文将对近年来能量平衡调节kisspeptin 系统的可能机制进行汇总,以期为后续的研究提供参考。
1 能量平衡与kisspeptin系统概述
下丘脑kisspeptin 系统对能量变化十分敏感。禁食或饮食热量限制导致的负能量平衡会使成年雄性小鼠下丘脑中Kiss-1和GPR54mRNA 表达水平降低、GnRH/LH分泌水平减少,使发育期大鼠出现青春期启动延迟[18-20]。此外,寒冷作为负能量平衡的一种也会影响哺乳动物下丘脑kisspeptin 系统的表达。从出生开始暴露于4 ℃寒冷环境下的将布氏田鼠下丘脑中Kiss-1基因表达量低于正常环境下生活的田鼠,并伴有睾酮浓度降低及生殖器官发育延后现象[21]。因此,负能量平衡会抑制下丘脑中Kiss-1基因表达从而抑制GnRH/LH 的分泌,而外源性注射kisspeptin 则能够扭转由于负能量平衡导致的大鼠青春期延后现象[22]。在机体处于高脂饮食、能量过剩等正能量平衡状态下,下丘脑中Kiss-1基因表达水平升高。高脂饲养会使成年大鼠和青春期前母猪下丘脑Kiss-1和GPR54mRNA 表达水平显著增加[23-24],且青春期母猪还会出现子宫和卵巢重量增加并发生青春期性早熟[24]。我们团队前期对发育期雄性大鼠进行高脂喂养后也观察到其下丘脑中Kiss-1 蛋白和基因表达水平升高,并出现血清睾酮降低、睾丸精子数量减少现象。不仅出生后高脂饮食会诱导哺乳动物下丘脑中kisspeptin 系统表达水平发生变化,孕期大鼠母体的高脂饮食也会导致子代下丘脑kisspeptin 系统水平增加,并使子代大鼠青春期启动提前[25]。因此,机体的能量平衡状态直接影响下丘脑中的Kiss-1mRNA 表达水平,并通过 Kiss-1-GnRH-LH/FSH 路径影响哺乳动物的生殖器官的结构和功能(图1)。
但是,能量失衡是如何作用于下丘脑Kiss-1 神经元并完成对生殖器官的调控?瘦素(leptin)、胰岛素(insulin)、食欲刺激素(ghrelin)、AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)等代谢激素/因子在连接能量平衡与kisspeptin 系统中扮演重要角色[26-30]。此外,下丘脑中Kiss-1 神经元还能够接受到促食性刺鼠相关肽(agouti-related peptide,AgRP)、阿黑皮素原(proopiomelanocortin,POMC)等其他神经细胞的刺激信息,各类能量代谢激素/因子也可能通过这些关联神经元间接影响kisspeptin 系统的表达水平。
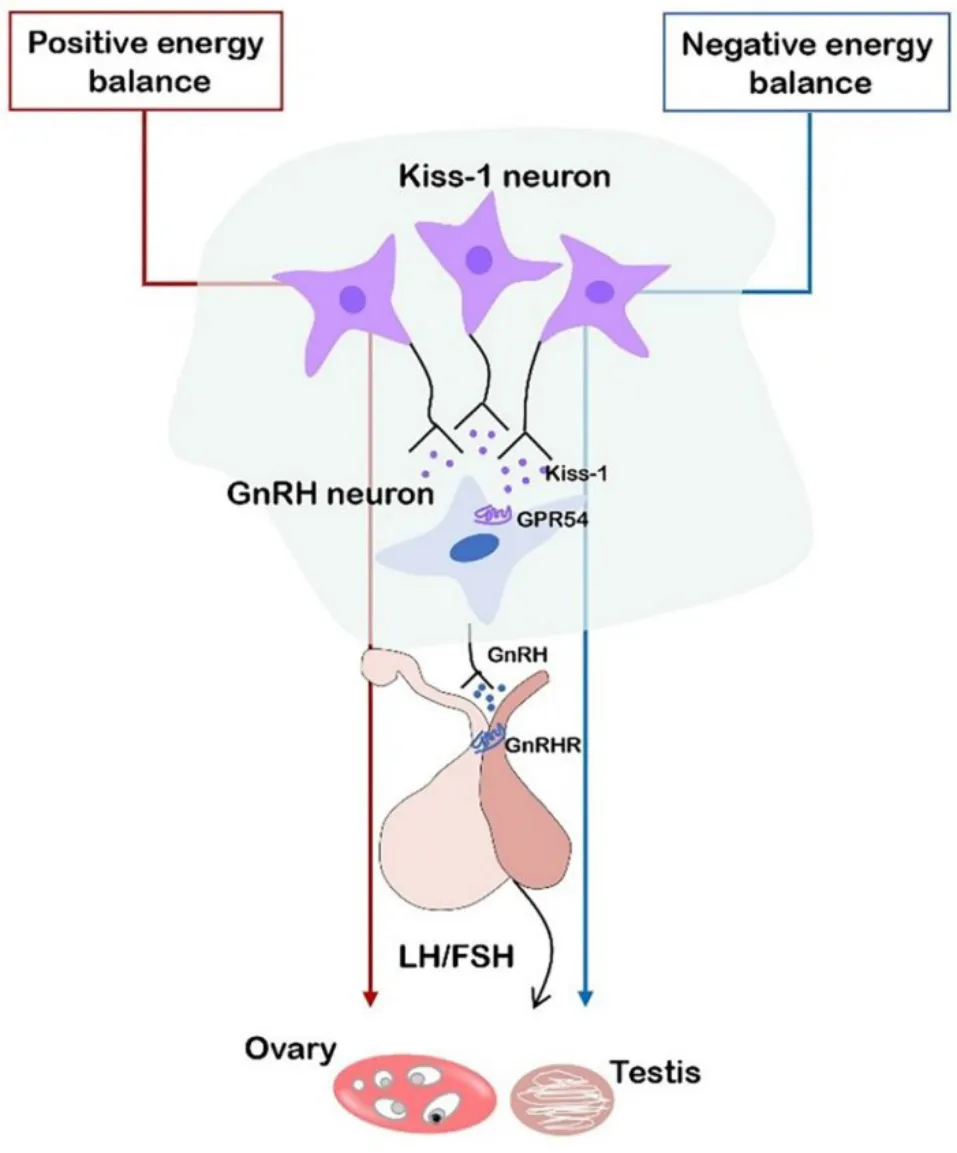
Figure 1. Positive/negative energy balance regulates luteinizing hormone(LH)/follicle-stimulating hormone(FSH)secretion and reproductive organ function via Kiss-1 neurons. GPR54:G-protein-coupled receptor 54;GnRH:gonadotropin-releasing hormone.图1 正、负能量平衡通过下丘脑Kiss-1神经元调节LH/FSH分泌和生殖器官功能示意图
2 各代谢激素/因子对下丘脑kisspeptin 系统的调控和影响
能量失衡后,机体代谢激素/因子表达水平首先出现变化,通过血液循环至下丘脑kisspeptin 系统并引起后续一系列反应,从而完成能量失衡对下丘脑-垂 体 -性 腺 轴(hypothalamic-pituitary-gonadal axis,HPG轴)的调控作用。
2.1 瘦素对kisspeptin 系统的调控作用 由脂肪组织分泌的瘦素在调节体重、维持能量平衡中起重要作用[31]。瘦素水平与HPG 轴关系密切,敲除leptin基因后哺乳动物会出现生殖功能障碍[32-33]。在下丘脑中瘦素需要与特异的受体——瘦素受体(leptin receptor,LepR)结合才能发挥其生物学效应[32],但LepR 在下丘脑中表达于Kiss-1 神经元而非GnRH 神经元[34],因此瘦素能够直接作用于 kisspeptin 系统。瘦素的分泌水平与下丘脑kisspeptin 表达水平呈正相关,瘦素分泌受到抑制后大鼠下丘脑中Kiss-1和GnRHmRNA 和蛋白表达水平降低[34-35],而向禁食 72 h的发育期雌性大鼠外源性注射瘦素能够使血清LH和FSH水平升高[35]。
Kiss-1 神经元上的LepR 正常表达是kisspeptin系统能够对瘦素刺激产生应答的前提。缺乏leptin或LepR基因会导致下丘脑Kiss-1mRNA 表达水平降低[23],尤其是特异性敲除 Kiss-1 神经元上的LepR基因(Kiss1-CreLepRnull模型)后,Kiss-1神经元数量显著减少[36]。部分研究认为高脂饮食干预会降低kisspeptin 系统的表达水平也可能是因为Kiss-1 神经元上LepR 受到抑制,使Kiss-1 神经元无法接收到瘦素的刺激信号所致。Chang 等[27]报道,10 周高脂饮食诱导的成年肥胖小鼠血清中瘦素水平增加,但下丘脑中LepR和Kiss-1mRNA 表达水平均出现降低,而当进行中等强度运动干预后,瘦素抵抗得到缓解并增加Kiss-1和GnRHmRNA 表达水平。这提示正能量平衡状态虽然会通过瘦素水平增加而促进下丘脑中kisspeptin 的mRNA 和蛋白表达,但是长期、过度脂肪堆积会导致瘦素抵抗,通过抑制LepR 表达来阻断瘦素对kisspeptin 系统的作用。短期的高脂干预则会促进kisspeptin 系统的表达,我们团队对雄性大鼠进行5 周的高脂饲料喂养后,大鼠下丘脑中的kisspeptin 蛋白表达水平升高。Venancio 等[37]对 21 日龄雌性小鼠给予短期(7 d 或11 d)高脂饮食后,观察到瘦素水平增加且通过信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)路径促进kisspeptin 表达,并使雌性小鼠阴道开口时间提前。总之,能量平衡经瘦素调控kisspeptin系统时受高脂饮食干预的影响。
2.2 脂联素(adiponectin,APN)对kisspeptin 系统的调控作用 APN 是由脂肪细胞分泌的另一种蛋白质激素,与体重变化呈负相关[38];APN 升高会抑制GnRH/LH 分泌[28,39-40]。APN 也 能够参与调控 kisspeptin 系统的表达[41]。Wen 等[42]通过对 GT1-7 细胞注射APN 后检测到Kiss-1mRNA 表达水平降低,向大鼠中枢注射APN 后kisspeptin 蛋白表达水平也出现降低。前期研究认为,APN 可能与AMPK 协同刺激Kiss-1 神经元,APN 在与受体AdipoR 结合后能够通过促进AMPK 磷酸化来抑制Kiss-1 神经元活动继而降低Kiss-1mRNA 的表达[38,43]。在高脂饮食诱导肥胖小鼠模型中,小鼠下丘脑中APN与AMPKmRNA表达水平的变化趋势高度一致,中等强度运动干预能够使肥胖小鼠血清APN水平升高同时抑制下丘脑Kiss-1mRNA 表达[44]。这提示运动干预这一负能量平衡机制能够通过促进APN 和AMPK 的表达来矫正肥胖诱导的kisspeptin 系统过表达现象。目前有关APN 影响kisspeptin 系统的研究主要集中于在负能量平衡条件下APN 与AMPK 的协同作用于Kiss-1 神经元,而AMPK 也是在下丘脑中调节kisspeptin 系统的关键能量代谢因子,在后文中进行探讨。
2.3 胰岛素对kisspeptin 系统的调控作用 胰岛素是由胰岛β 细胞分泌的代谢激素,主要参与调节血糖稳定,机体葡萄糖稳态也是维持正常生殖功能的前提[45]。胰岛素的异常表达与哺乳动物生殖相关疾病的发生高度相关,与正常月经女性相比患下丘脑闭经的女性会出现GnRH 释放的脉冲频率低,同时伴有低胰岛素水平现象[46],胰岛素功能异常的1 型糖尿病患者会出现青春期启动延迟[47]。Kovacs 等[48]报道,低胰岛素环境会抑制GnRH 分泌,而向糖尿病模型大鼠中枢注射胰岛素则能够使其LH 分泌水平恢复正常的。
在下丘脑Kiss-1 和GnRH 神经元上均有胰岛素受体(insulin receptor,InsR)的表达,但是特异性敲除GnRH 神经元上的InsR基因后小鼠的青春期启动和性成熟未受影响,而敲除Kiss-1 神经元上的InsR基因后小鼠会出现青春期启动延迟和GnRH 分泌降低现象[49],因此胰岛素是通过Kiss-1 神经元来调控HPG 轴的。胰岛素能够通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶 B(protein kinase B,PKB/Akt)信号通路激活Kiss-1 神经元上的瞬时受体电位通道(transient receptor potential channels),使下丘脑中的Kiss-1 神经元产生动作电位,刺激 kisspeptin 合成增加[50]。此外,kisspeptin系统与胰岛素相关衍生指标也高度相关。kisspeptin蛋白表达水平与葡萄糖刺激胰岛素分泌指数呈负相关[29],糖化血红蛋白较高的肥胖青春期男孩血清kisspeptin 水平也高于正常男孩[51],说明 kisspeptin 系统也可能是糖代谢影响生殖功能的桥梁,但具体生物学机制有待探究。
与LepR相类似,InsR在胰岛素调节kisspeptin系统的过程中也扮演重要角色。当过度能量累积导致机体出现胰岛素抵抗后,能量信号传递被阻滞,出现正能量平衡状态下kisspeptin表达降低的情况。虽然Kiss-1 神经元上的InsR缺失会抑制GnRH 的分泌,但对哺乳动物成年期的生殖功能影响不大[49],故胰岛素不是能量失衡影响生殖功能的主要能量代谢激素,在InsR缺失条件下有其他代偿路径对kisspeptin系统进行调控。当前有关胰岛素与kisspeptin及生殖功能的研究主要集中于肥胖和糖尿病患病人群,属于正能量平衡状态,负能量平衡状态是否通过胰岛素及其相关衍生指标影响kisspeptin系统有待进一步探索。
2.4 ghrelin 对kisspeptin 系统的调控作用 ghrelin是一种由消化道分泌的促进食欲的肽类激素,既参与控制食欲和调节能量代谢,也能够影响HPG轴,能量失衡后血清ghrelin 浓度与促性腺激素释放水平高度负相关[52],向中枢外源性注射ghrelin 在诱导进食行为的同时也会抑制 GnRH 和 LH 的分泌[53-54]。ghrelin 的受体——生长激素促分泌素受体(growth hormone secretagogue receptor,GHSR)在下丘脑中与kisspeptin 蛋白共表达[55],使 ghrelin 能够影响 Kiss-1神经元的表达继而影响GnRH/LH 分泌[54]。在负能量平衡状态下ghrelin 与kisspeptin 表达水平高度负相关[56];禁食或运动能够使ghrelin 水平升高并抑制kisspeptin 蛋白表达[57-58];外源性注射 ghrelin 使成年雌性大鼠下丘脑Kiss-1mRNA 表达水平降低[58]。除直接抑制kisspeptin 的表达水平外,ghrelin 升高还能够抑制kisspeptin-10 对LH 的刺激作用,阻隔kisspeptin 对 LH/FSH 的控制[59]。然而在能量稳态条件下,青春期异常的儿童青少年血浆kisspeptin 与ghrelin 无显著相关关系[60-61]。推测在能量失衡,尤其是禁食、饮食热量限制、运动等负能量平衡状态下ghrelin才会对kisspeptin系统产生影响。
2.5 AMPK 对kisspeptin 系统的调控作用 除激素外,代谢因子表达水平也受能量状态影响。其中AMPK 与Kiss-1 神经元关系最为密切。在下丘脑中AMPK 能够整合多种激素、肽和神经递质信息[62],直接激活Kiss-1神经元细胞膜上的L型钙离子通道,与kisspeptin 蛋 白 共 表 达[63-64]。 向 大 鼠 外 源 性 注 射AMPK 激 动 剂 AICAR(5-aminoimidazole-4-carboxamide ribonucleotide)会使其下丘脑中Kiss-1 神经元数量降低,血液中LH 和FSH 水平下降,而注射AMPK 抑制剂compound C 导致大鼠下丘脑中Kiss-1的mRNA表达水平增加2倍[42]。
AMPK 是以异源三聚体形式存在的蛋白,包括α催化亚基及 β 和γ 调节亚基,其中α 亚基是激活AMPK 的关键位点[65]。运动、饥饿等能量负平衡状态通过使下丘脑AMPK 的α 亚基磷酸化来激活AMPK[64],使大鼠下丘脑中 AMPK 磷酸化水平增加,导致LH 水平降低和青春期阶段性成熟时间延后现象[30,66]。AMPKα缺失后,能量平衡变化对 kisspeptin系统及生殖功能的影响被阻断。利用Cre-loxP 技术特异性敲除小鼠Kiss-1 神经元上的AMPKα后,能量状态变化虽能够对小鼠体重产生影响,但不会对小鼠青春期启动时间和生殖器官重量产生影响,禁食刺激也不会影响成年雌性小鼠的发情期[64],证明AMPK 在能量平衡调节生殖功能过程中扮演至关重要的角色。此外,AMPK 还可能与APN、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等代谢激素/因子协同发挥作用,但AMPK 与瘦素、胰岛素等代谢激素的相互作用目前尚无研究涉及。当前动物实验研究也多是探讨负能量平衡刺激AMPK以抑制kisspeptin系统,而高脂饮食、肥胖等正能量平衡状态是否主要通过抑制AMPK 来促进kisspeptin系统的表达,有待进一步验证。
2.6 mTOR 对kisspeptin 系统的调控作用 除AMPK 外,能量失衡也能通过mTOR 影响kisspeptin系统以影响生殖功能。与AMPK 相反,禁食等负能量平衡条件会抑制mTOR 表达,正能量平衡条件则增加mTOR 表达[67]。向青春期雌性大鼠外源性注射mTOR 激活剂 L-亮氨酸后,下丘脑Kiss-1mRNA 和血清LH 水平显著增加,长期注射L-亮氨酸能够缓解由于负能量平衡条件带来的促性腺激素减退状态,而注射mTOR 抑制剂则会使发育期大鼠青春期启动延迟[68]。然而目前mTOR 作用于kisspeptin系统的具体信号路径尚不明确。mTOR 也是PI3K 相关激酶家族的成员,是PI3K/Akt 通路的下游因子,如前文所述,胰岛素可能通过PI3K/Akt 信号通路调控kisspeptin系统,那么mTOR 因子是否参与其中?有研究认为在下丘脑中mTOR 和AMPK 在调控kisspeptin 系统过程中可能存在交互作用,mTOR 也可能通过与AMPK协同完成对kisspeptin系统的调控作用[69]。
综上所述,能量失衡能够经过代谢激素/因子作用于下丘脑kisspeptin系统,进而影响GnRH/LH 的分泌和释放,调控生殖功能。但大部分激素对kisspeptin系统的控制和影响不是完全独立的,当单个激素及受体受到抑制,其他激素可能发挥代偿作用以维持哺乳动物生殖功能的稳态;或是多种激素/因子协同发挥作用,共同完成对kisspeptin系统的调控。
3 能量平衡经Kiss-1 神经元上级神经元对kisspeptin系统的调控
在下丘脑中Kiss-1 神经元不是独立于其他神经元存在的,它与参与控制食物摄入和能量代谢的两对互相拮抗神经元——厌食性神经元POMC/可卡因苯丙胺调节转录物(cocaine-and amphetamine-regulated transcript,CART)和促食性神经元AgRP/神经肽Y(neuropeptide Y,NPY)在下丘脑中共表达,建立神经联系[70-71]。POMC/CART 和 AgRP/NPY 神经元也是能量平衡变化的感受器,在接收能量代谢刺激后将信号传导至Kiss-1神经元,调控kisspeptin系统(图2)。
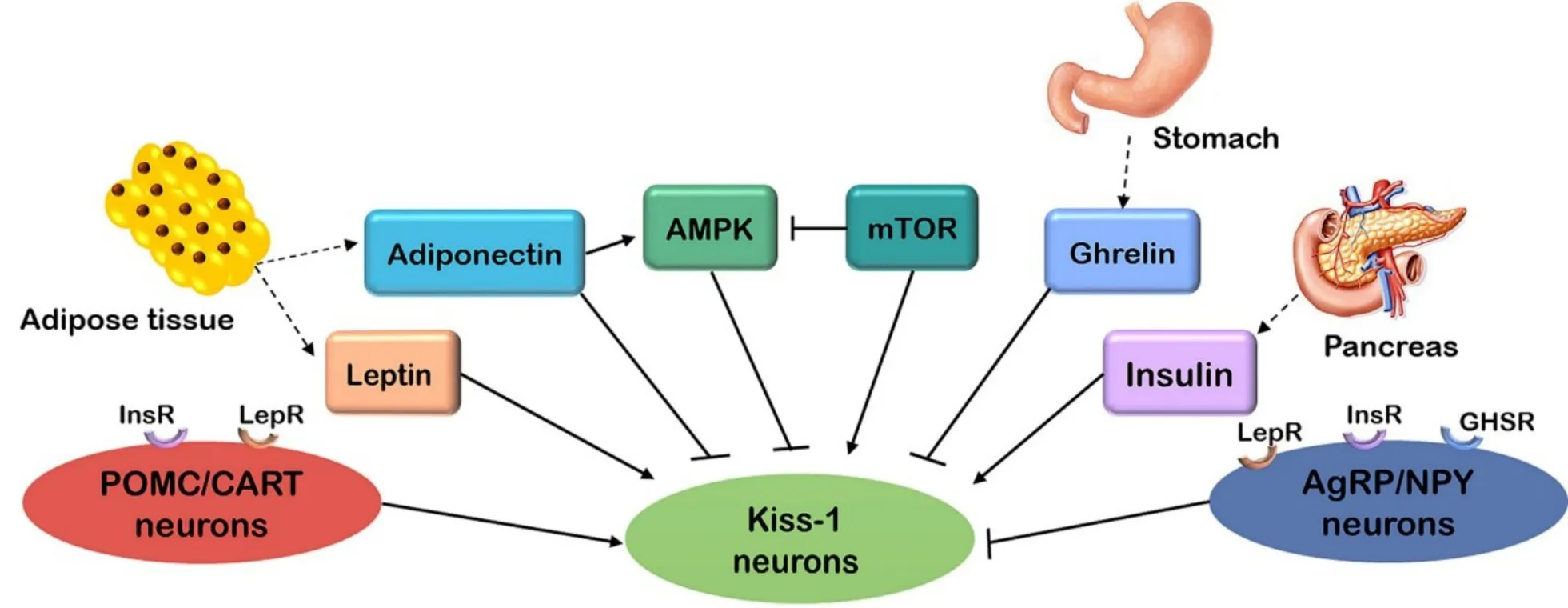
Figure 2. Energy metabolic hormones/factors directly,or indirectly act on Kiss-1 neurons via proopiomelanocortin(POMC)/cocaineand amphetamine-regulated transcript(CART)and agouti-related peptide(AgRP)/neuropeptide Y(NPY)neurons. InsR:insulin receptor;LepR:leptin receptor;AMPK:AMP-activated protein kinase;mTOR:mammalian target of rapamycin;GHSR:growth hormone secretagogue receptor.图2 能量代谢激素/因子直接或经POMC/CART和AgRP/NPY神经元间接作用于Kiss-1神经元
3.1 能量平衡经POMC/CART 神经元对kisspeptin系统的调控和影响 POMC/CART 是下丘脑中调控中枢饱腹感的厌食性神经元,能让机体产生饱腹、厌食情绪从而停止进食,起到控制体重和维持能量稳态的作用[72-73]。POMC/CART 神经元在接收能量失衡信号后通过作用于与其相邻的Kiss-1 神经元,参与调控哺乳动物的 HPG 轴[74-75]。在 Kiss-1 神经元上能够表达由POMC 分泌的α-促黑素细胞激素(α-melanocyte-stimulating hormone,α-MSH)的对应受体——黑皮质素受体(melanocortin receptor,MCR),使Kiss-1 神经元能够收到 POMC 神经元的刺激信号[76-77]。POMC或MCR缺失会对生殖功能产生影响:敲除POMC和(或)MCR基因后小鼠出现肥胖和成年期生育能力降低现象[78-79];对于发育期大鼠来说,缺失MCR基因会抑制其下丘脑Kiss-1基因的转录,出现青春期启动延迟[51,71]。
在 POMC 神经元上有 LepR 和 InsR 表达,能量失衡主要是通过瘦素和胰岛素作用于POMC 神经元[80]。在肥胖等正能量平衡刺激下,瘦素、胰岛素等表达水平增加,刺激POMC 神经元分泌α-MSH 水平增加[81],从而使 Kiss-1 神经元上的 α-MSH 蛋白表达增加,被POMC神经纤维支配的Kiss-1神经元数量增多,最终导致 kisspeptin 蛋白表达量增加[82]。CART也能够直接作用于Kiss-1 神经元使其去极化,禁食等负能量平衡降低下丘脑中POMC和CARTmRNA表达水平,并抑制Kiss-1和GnRHmRNA 的表达[83-85]。因此,POMC/CART 神经元是连接机体能量平衡与Kiss-1神经元的重要“桥梁”。
3.2 能量平衡经AgRP/NPY 神经元对kisspeptin 系统的调控和影响 AgRP/NPY 是下丘脑中调控中枢饥饿感的促食性神经元,被激活后会促进摄食行为。AgRP/NPY 神经元上也能表达 LepR、InsR 和 GHSR,直接接受瘦素、胰岛素和ghrelin 等能量代谢激素的刺激[86-88]。与POMC/CART 神经元作用相反,在下丘脑中AgRP 和NPY 神经元与Kiss-1 神经元相连接形成抑制性突触神经连接[70,76]。AgRP/NPY 神经元激活能够抑制Kiss-1 神经元的突触后电流,从而抑制Kiss-1 神经元活动[89]。因此 AgRP/NPY 激活后会抑制kisspeptin 系统的表达,使哺乳动物出现发情周期延迟和生育能力下降,出现不孕症等现象[89-90]。
综上所述,能量平衡变化能够通过瘦素、胰岛素、ghrelin 等代谢激素作用于POMC/CART 和AgRP/NPY 两对神经元间接促进/抑制kisspeptin 系统的表达。同时,也有研究发现POMC/CART 和AgRP/NPY神经元与Kiss-1 神经元之间并非单向联系,神经元之间能够发生交互作用。Fu等[91]使用膜片钳检测下丘脑中电位变化后证实kisspeptin 蛋白能够激活POMC 神经元,使下丘脑中POMC 蛋白表达水平增加;AgRP 能够以旁分泌形式抑制α-MSH,与POMC互相调节维持能量稳态[92];Kiss-1 神经元在刺激POMC 神经元的同时也会抑制 AgRP/NPY 神经元[12]。故 POMC/CART 神经元、AgRP/NPY 神经元和 Kiss-1神经元三者是以网络形式存在,在能量失衡后可能相互影响,具体作用路径有待进一步研究。但也可以间接证实kisspeptin 系统不仅与生殖功能和能量代谢关系密切,也有可能通过POMC/CART 和AgRP/NPY两对神经元调节食欲,控制能量摄入。
4 小结与展望
能量失衡对kisspeptin 系统的调控作用是复杂的,诸多代谢激素/因子和神经元参与其中。为保证机体生殖功能稳态,代谢激素/因子可能通过协同或相互代偿调控下丘脑中Kiss-1 神经元。就当前研究来看,能量激素/因子在直接或间接作用于kisspeptin系统时可能存在条件性,正负能量平衡状态可能经过不同的代谢激素/因子影响kisspeptin 系统。此外,能量失衡也可通过POMC/CART 和AgRP/NPY 神经元影响kisspeptin 系统,在能量失衡与生殖功能异常之间,是否存在食欲控制问题,在未来研究中仍等待去进一步探究和证实。此外,由于肥胖导致kisspeptin 系统异常所诱发的青春期性早熟或生殖功能障碍是当前医学与体育健康研究领域关注的主要问题之一。如何利用饮食热量控制、运动等手段经过kisspeptin系统扭转由于能量过剩带来的生殖健康危害?它们之间的剂量-效应关系如何?这些问题有待进一步探究。

