黄芪甲苷通过调控AMPK/ULK1信号通路减轻高糖诱导的大鼠H9c2细胞损伤*
秦依然, 申 程, 尉希清△, 张金国△
(1山东大学齐鲁医学院,山东 济南 250012;2济宁医学院附属医院心内科,山东 济宁 272029)
糖尿病是一种以高血糖为特征的慢性疾病,其患病率在全球范围内不断上升[1]。其中糖尿病心肌病(diabetic cardiomyopathy,DCM)的发生具有较高的发病率和死亡率,其发病机制尚不清楚[2]。近年来研究表明,高糖(high glucose,HG)与自噬关系密切[3]。HG 可诱导心肌细胞发生氧化应激反应、线粒体功能障碍、细胞凋亡从而导致细胞代谢异常和受损细胞器的堆积[4]。自噬是一个高度保守的过程,将废弃的蛋白质或细胞器运送到溶酶体中,以实现细胞的新陈代谢需要和特定细胞器的更新[5-6]。已有研究证实自噬的激活对心肌细胞具有保护作用[7],因而自噬诱导在疾病治疗中可能具有广阔前景。
黄芪甲苷(astragaloside IV,ASIV)是黄芪的主要药理提取物,已有2 000 多年的使用历史[8]。大量研究表明ASIV 在心血管系统中具有多种药理作用,包括抗氧化应激、抗炎、抗细胞凋亡、调节钙平衡、免疫调节和心脏保护作用[9-11]。ASIV 在 2 型糖尿病大鼠模型中能减轻线粒体能量代谢异常,减少细胞凋亡和心肌肥大,减轻心肌损伤[12]。亦有研究表明,ASIV 具有调控细胞自噬的作用[13]。AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)作为细胞能量传感器与自噬关系密切,可以直接磷酸化Unc-51 样激酶 1(Unc-51-like kinase 1,ULK1)发挥作用[14]。然而,ASIV 是否能通过 AMPK/ULK1 信号通路调控自噬,目前尚未见报道。本项工作建立HG损伤的 H9c2 细胞模型,探索 ASIV 对 HG 损伤 H9c2 心肌细胞自噬的影响及AMPK/ULK1通路调控机制,为治疗DCM提供参考资料。
材料和方法
1 细胞
大鼠H9c2心肌细胞购自中国科学院细胞库。
2 主要试剂
ASIV 购自南京春秋生物工程有限公司(纯度≥98%);微管相关蛋白轻链3B(microtubule-associated protein light chain 3B,LC3B)、beclin-1、p62、AMPK、p-AMPK、ULK1、p-ULK1 和 β-actin 抗体均购自 CST;山羊抗兔Ⅱ抗购自ABclonal;Compound C 购自MCE;CoraLite 488 偶联山羊抗兔 IgG 购自 Proteintech;BCA蛋白浓度测定试剂盒、LDH 检测试剂盒、RIPA 裂解液和抗荧光淬灭封片液均购自碧云天生物技术公司;CCK-8检测试剂盒购自Dojindo。
3 主要方法
3.1 细胞培养 用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM 培养液培养H9c2细胞,放置在37 ℃、5% CO2的环境中,每2~3 d 更换新鲜培养液,待细胞铺满瓶底约90%时,传代或冻存。
3.2 实验分组 将H9c2 细胞分为含5.5 mmol/L 葡萄糖的低糖对照(control)组、葡萄糖浓度为33.3 mmol/L 的 HG 组[15]、HG+ASIV 组和 HG+ASIV+Compound C 组 。 ASIV 和 Compound C 浓度分别为 100 μmol/L 和5 μmol/L。Compound C 浓度依照药物说明书确定。ASIV 及Compound C 预处理H9c2 细胞30 min后加入葡萄糖,各组分别培养72 h。
3.3 CCK-8 法检测细胞活力 将H9c2 细胞以适宜密度接种于96 孔板,细胞贴壁后进行相应处理,到达特定干预时间后,每孔加入10 μL CCK-8 试剂,培养箱中孵育2 h,测定450 nm 处吸光度,计算细胞活力并确定最佳ASIV干预浓度。
3.4 LDH 浓度测定检测细胞损伤 将H9c2 细胞以适宜密度加入96 孔板,细胞贴壁后进行相应处理,到达特定干预时间后,按照试剂盒说明书进行操作,在490 nm 和600 nm 处进行双波长测定,确定细胞损伤最小时的ASIV浓度。
3.5 Western blot检测蛋白水平 细胞干预结束后,加入RIPA 裂解液进行充分裂解,离心,取出上清,测浓度。按照每组30 μg蛋白上样,80 V电泳30 min后加至120 V电泳70 min,300 mA转膜90 min,封闭,加入Ⅰ抗后4 ℃过夜,次日孵育Ⅱ抗1~2 h,使用ECL进行化学发光显色,ImageJ软件分析蛋白灰度值。
3.6 免疫荧光检测LC3B 荧光强度 各组细胞干预完成后,加入4%多聚甲醛固定20 min,PBS 清洗;0.2%曲拉通X-100 通透10 min,PBS 清洗;10%山羊血清封闭30 min,加入5%山羊血清配置的Ⅰ抗,4 ℃过夜后PBS 清洗,使用5%山羊血清配置的Ⅱ抗避光孵育1 h,PBS 清洗,滴加适量抗荧光淬灭封片液(含DAPI)于载玻片,置于荧光显微镜下拍照。
3.7 透射电镜观察细胞自噬 将细胞用2.5%戊二醛固定液固定,切片后染色,使用透射电镜观察并拍片。
4 统计学处理
使用IBM SPSS Statistics 26 统计软件进行分析,GraphPad Prism 8 软件作图。数据采用均数±标准差(mean±SD)表示。正态分布的数据多组间比较采用单因素方差分析(one-way ANOVA),组间多重比较采用LSD法。以P<0.05为差异有统计学意义。
结 果
1 ASIV提高HG损伤的H9c2细胞活力
单独使用不同浓度ASIV刺激H9c2细胞72 h,不影响细胞活性,见图1A。HG 与不同浓度的ASIV 干预后,结果显示HG 组较对照组细胞活性显著降低(P<0.05);与HG组相比,不同浓度的ASIV均可提高HG 条件下的细胞活力(P<0.05),且呈浓度依赖性,100 μmol/L ASIV效果最佳,见图1B。
2 ASIV减轻HG诱导的H9c2细胞损伤
LDH 检测结果显示,与对照组相比,HG 组LDH释放增多(P<0.05);与 HG 组相比,ASIV 可以降低HG 条件下 LDH 的释放,当 ASIV 浓度为 50 μmol/L 和100 μmol/L 时,差异有统计学意义(P<0.05),且100 μmol/L时效果更为显著,见图2。选取100 μmol/L为ASIV最佳干预浓度进行后续实验。
3 ASIV对HG环境下H9c2细胞自噬的影响
Western blot 结果显示,与对照组相比,HG 组beclin-1 表达和LC3-II/LC3-I 比值显著降低(P<0.05),p62 表达显著升高(P<0.05);与 HG 组相比,HG+ASIV 组 beclin-1 表达和 LC3-II/LC3-I 比值显著上升(P<0.05),p62表达显著下降(P<0.05),见图3。

Figure 1. Effects of ASIV at different concentrations on the viability of normal H9c2 cells(A)or effects of ASIV at different concentrations on the viability of H9c2 cells stimulated by HG(B). Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs HG group.图1 不同浓度ASIV在有或无HG刺激时对H9c2细胞活力的影响

Figure 2. Effects of ASIV on LDH release in H9c2 cells. Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs HG group.图2 不同浓度ASIV对H9c2细胞LDH释放的影响
4 ASIV 对 HG 诱导 H9c2 细胞 AMPK/ULK1 信 号通路的影响
与对照组相比,HG 组H9c2 细胞中p-AMPK/AMPK、p-ULK1/ULK1 和 LC3-II/LC3-I 蛋白比值显著降低(P<0.05);与HG 组相比,HG+ASIV 组p-AMPK/AMPK、p-ULK1/ULK1 和 LC3-II/LC3-I 蛋白比值显著升高(P<0.05);与HG+ASIV组相比,HG+ASIV+Compound C 组 p-AMPK/AMPK、p-ULK1/ULK1 和 LC3-II/LC3-I蛋白比值均显著下降(P<0.05),见图4。
5 免疫荧光法检测自噬蛋白LC3B表达
与对照组相比,HG 组LC3B 绿色荧光表达明显减弱(P<0.05);与HG 组相比,HG+ASIV 组细胞核周围绿色荧光增多(P<0.05);与 HG+ASIV 组相比,HG+ASIV+Compound C 组 LC3B 荧光强度减弱(P<0.05),见图5。
6 ASIV对HG干预下自噬体数量的影响
透射电镜下观察,与对照组相比,HG 组内自噬体数目显著减少(P<0.05),可见较多线粒体及囊泡化扩张的内质网;与HG 组相比,HG+ASIV 组自噬体显著增多(P<0.05);给予Compound C 后,自噬体形成显著减少(P<0.05),见图6。

Figure 3. Effects of ASIV on the expression of autophagy-related proteins LC3-I,LC3-II,beclin-1 and p62 in H9c2 cells detected by Western blot. Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs HG group.图3 ASIV对H9c2细胞自噬相关蛋白LC3I、LC3-II、beclin-1及p62表达的影响
讨 论
DCM 是糖尿病的严重并发症,其发病率的不断增长威胁人类生命健康[16]。高血糖会引起多种病理生理改变,包括内皮功能障碍、活性氧增多、心肌纤维化、炎症反应增加和细胞死亡等,与DCM 的发病关系密切[17-18]。已有研究表明,HG 状态下心肌H9c2细胞凋亡和氧化应激增多,加重心肌损伤[19]。本研究使用HG 培养H9c2 细胞进行体外实验,结果显示HG 组细胞活力明显降低和LDH 释放增多提示细胞损伤模型构建成功。
ASIV 作为传统中药已被广泛用于各项体内体外研究。You等[20]研究表明,ASIV对HG诱导的人脐静脉内皮细胞损伤具有显著的保护作用。聂佩等[21]研究表明,ASIV 能抑制心肌H9c2 细胞凋亡,减轻氧化应激。Zhu 等[15]研究表明,ASIV 可以促进HG 环境下细胞自噬。以上研究提示ASIV 在各种细胞死亡方式及减轻HG 损伤中具有重要作用。本研究使用不同浓度的ASIV 处理HG 损伤的H9c2 细胞,结果显示,ASIV显著提高细胞活力,减少LDH释放。
自噬作为细胞死亡方式之一,在维持细胞稳态方面发挥关键作用。自噬过程中,胞液形式的LC3-I与磷脂酰乙醇胺结合形成LC3-II,然后被募集至细胞膜。LC3-I 到LC3-II 的转换被认为是自噬激活和自噬小体形成的标志[22]。beclin-1 是一种连接蛋白,在自噬启动中发挥重要作用。p62 通过直接结合LC3B 而选择性地整合至自噬体中,并通过自噬有效降解,其细胞总表达水平与自噬活性负相关[23]。然而,HG 环境下心肌细胞自噬的确切作用及其分子机制仍存在争议,其变化可能具有两面性。Yu 等[24]研究表明,H9c2 细胞暴露于HG 后,自噬发生抑制,胰高血糖素样肽1 激动剂通过激活自噬减轻葡萄糖毒性。Yao 等[25]通过体内和体外糖尿病模型,证明了HG 环境下心肌细胞自噬下调,而自噬的诱导减轻了糖尿病小鼠的心功能障碍。然而,Zhu等[15]体外模型显示,HG 条件下高水平的自噬会加重细胞损伤。Zhang 等[26]研究亦表明,HG 条件下过度活跃的自噬对心肌细胞起着不利作用。这些有争议的结果可能归因于不同的模型构建、葡萄糖水平及检测时间等。本研究结果显示,HG 处理H9c2 细胞72 h 后,自噬处于低水平状态,加入ASIV 后,可以逆转HG 诱导的自噬抑制,诱导心肌细胞发生保护性自噬。本研究通过对自噬标志蛋白的Western blot 定量分析,证实了维持一定水平自噬具有有益作用。
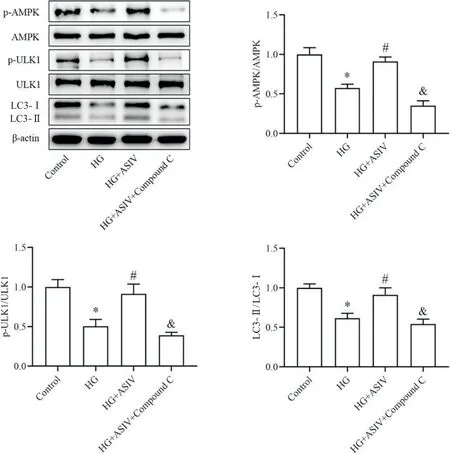
Figure 4. Effects of ASIV on the expression of AMPK/ULK1 signaling pathway-related proteins in H9c2 cells detected by Western blot. Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs HG group;&P<0.05 vs HG+ASIV group.图4 ASIV对H9c2细胞AMPK/ULK1通路相关蛋白表达的影响
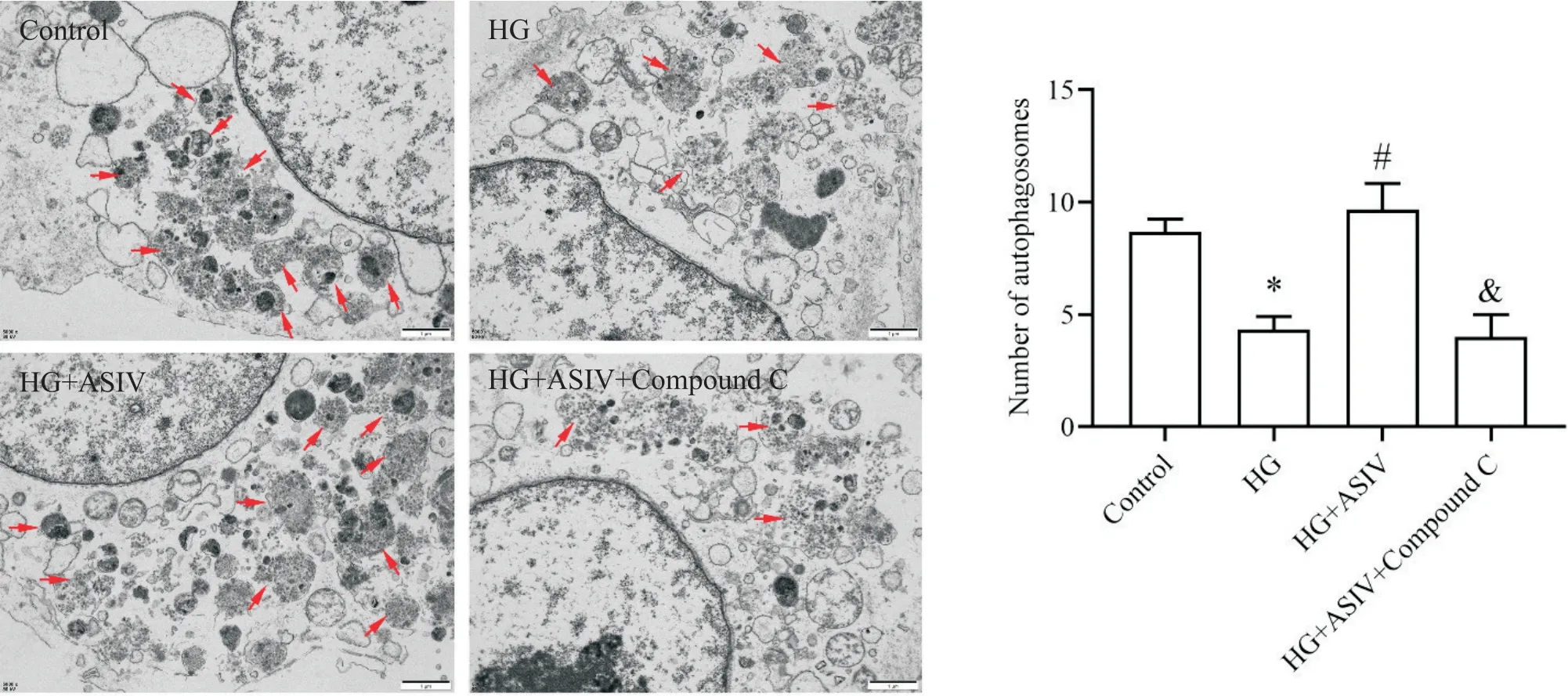
Figure 6. The autophagosomes in H9c2 cells under different intervention conditions were observed by transmission electron microscopy(scale bar=1 μm). Red arrow indicates autophagosomes. Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs HG group;&P<0.05 vs HG+ASIV group.图6 透射电镜下观察不同干预条件下H9c2细胞内的自噬体变化
AMPK 是一个关键的能量感受器,参与自噬、凋亡和蛋白合成等多种病理生理机制,被认为是调节心脏代谢的重要因素[27]。AMPK 通过磷酸化ULK1的 Ser317 和 Ser777 位点,激活 ULK1,直接促进自噬[28]。ULK1 是酵母自噬相关基因ATG1的同源物。活化的AMPK 还可以抑制哺乳动物雷帕霉素靶蛋白以降低ULK1 Ser757 位点的磷酸化,AMPK 进而磷酸化Ser317 上的ULK1,最终诱导自噬[29]。铁皮石斛多糖可通过AMPK/ULK1 信号通路减轻缺氧/复氧诱导的细胞损伤[30]。ASIV可通过抑制IKK/NF-κB通路减轻炎症,减轻HG引起的心肌细胞损伤[31]。但目前关于ASIV 调节AMPK/ULK1 信号通路减轻HG 环境细胞损伤的研究还未见报道。而本研究显示,HG 模型组AMPK/ULK1 的磷酸化水平被抑制,H9c2 细胞的自噬水平降低。ASIV 可以上调AMPK/ULK1 的磷酸化水平,恢复心肌细胞自噬水平。给予AMPK 抑制剂 Compound C 后,ASIV 上调 H9c2 自噬的作用被抑制,进一步证明了ASIV 通过AMPK 通路对H9c2 细胞在HG环境下促进自噬的作用。
综上所述,ASIV 可能通过激活AMPK/ULK1 信号通路调控自噬,减轻HG 条件下H9c2 细胞损伤。本研究通过构建体外模型为ASIV 在DCM 中的保护作用提供了参考资料。此外,调节自噬是否是预防糖尿病相关心血管疾病的有效策略,下一步拟在DCM动物模型展开进一步研究。

