Ghsr-/-小鼠黑质ATP敏感性钾通道亚基表达改变
吕吉荣,肖雪,焦倩,陈曦,杜希恂,姜宏
(青岛大学国家生理学重点(培育)学科,山东 青岛 266071)
生长激素促分泌素受体1a(GHSR1a)是一种广泛分布在下丘脑、垂体、腹侧被盖区、中缝核、海马和黑质致密部等区域的G蛋白偶联受体[1]。ghrelin是其唯一的内源性配体[2]。本实验室前期研究结果证实,ghrelin-GHSR1a可以通过改善线粒体功能,拮抗鱼藤酮和1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的多巴胺(DA)能神经元细胞的死亡[3-4]。同时,GHSR1a还具有本构型活性,即在缺乏配体或激动剂的情况下,受体仍能自发地维持激活并维持下游信号转导通路的活性[5-6]。已有研究结果表明,在小鼠脑内黑质立体定位注射GHSR1a拮抗剂可诱导DA能神经元中GHSR1a表达下调,并导致小鼠运动功能障碍[7]。
ATP敏感性钾通道(KATP通道)作为一种内向整流钾通道,由4个内向整流钾通道Kir6.X亚基(Kir6.1或Kir6.2)和4个磺酰脲受体(SUR)亚基组成,具有改善细胞内能量代谢水平和稳定内环境的作用[8-10]。近年来的研究表明,KATP通道的选择性激活可能参与了帕金森病(PD)中黑质DA能神经元的损伤[11-12]。PD病人尸检结果显示,脑内黑质残存的DA能神经元上虽然同时表达有SUR1、SUR2B和Kir6.2等3种不同类型的KATP通道,但只有SUR1mRNA水平显著升高,其余亚基表达均无改变[12]。本实验室前期研究结果证实,在3、6和9月龄的PD转基因小鼠黑质中KATP通道SUR1亚基的蛋白和mRNA表达水平均显著上调。亦有研究证实,ghrelin-GHSR1a可以通过激活KATP通道调节迷走神经节状神经核的兴奋性。而GHSR1a是否也参与调节疾病进展过程中KATP通道各亚单位的表达变化尚不清楚。因此,本研究选取3月龄GHSR1a敲除(Ghsr-/-)小鼠和同窝野生型(WT)小鼠,应用蛋白免疫印迹和实时荧光定量PCR方法对黑质的KATP通道各亚基蛋白及mRNA水平进行检测,为阐明GHSR1a与KATP通道在PD发病中的相互作用提供实验依据。
1 材料和方法
1.1 实验材料
1.1.1实验动物 所用Ghsr-/-小鼠均购自上海南方模式生物科技发展有限公司。Ghsr+/-小鼠与Ghsr+/-小鼠杂交得到下一代小鼠,通过基因鉴定得到Ghsr-/-小鼠及相应的同窝WT小鼠。本实验选用3月龄的Ghsr-/-雄性小鼠和同窝WT雄性小鼠作为研究对象,每组5只。小鼠在室温(23±1)℃、12 h昼夜循环光照的环境下进行饲养,可自由饮水与进食。所有动物实验操作均遵循医学伦理学原则。
1.1.2实验仪器及试剂 SUR1抗体、SUR2B抗体、Kir6.2抗体均购自美国Abcam公司;β-actin抗体购自中国Bioss公司;山羊抗鼠二抗、山羊抗兔二抗均购自美国Santa Cruz公司;SDS-PAGE分离胶缓冲液和SDS-PAGE浓缩胶缓冲液均购自美国Sigma公司;ECL发光液、PVDF膜购自美国Millpore公司;RIPA裂解液、过硫酸铵(APS)、四甲基乙二胺(TEMED)、BCA试剂盒、Loading buffer均购自中国碧云天公司;TRIzol试剂购自美国Invitrogen公司;逆转录试剂盒购自美国Thermo公司;SYBR Premix Ex Taq(2×)购自日本Takara公司。所用实验仪器包括电泳仪、电转仪、天能GIS凝胶图像处理系统、高速低温离心机、实时荧光定量PCR仪、分光光度计。
1.1.3实验液体配制 0.01 mol/L PBS:称取4.0 g Na2HPO4·12H2O、0.4 g NaH2PO4·2H2O以及9.0 g NaCl,用双蒸水定容至1 L。电泳缓冲液:称取Tris 1.51 g、甘氨酸7.20 g、SDS 0.50 g,使用双蒸水定容至1 L,调节pH值至8.3。转膜缓冲液:称取Tris 3.0 g、甘氨酸14.4 g,分别加入800 mL的双蒸水和200 mL的甲醇,调节pH值至8.3。TBST溶液:称取Tris 2.42 g、NaCl 8.00 g,用双蒸水定容至1 L,加入1 mL Tween-20,调节pH至7.5。封闭液:用TBST溶液配制的50 g/L脱脂奶粉。
1.2 蛋白免疫印迹法检测黑质SUR1、SUR2B和Kir6.2蛋白的表达
小鼠用异氟烷深度麻醉后,断头取脑。根据脑图谱,分别取出大脑双侧黑质区域,并置于预冷的1.5 mL EP管中,分别向EP管内加入100 μL的RIPA裂解液。在冰上用电动研磨棒充分研磨至管内脑组织完全溶解,再置于冰上裂解30 min。把裂解好的组织放入离心机中,在4 ℃下以12 000 r/min的速度离心20 min。离心后取出EP管,将上清液转移到新的EP管中,应用BCA法测定波长562 nm处的吸光度,绘制标准曲线,并计算出待测样本的浓度。配制100 g/L分离胶和50 g/L浓缩胶,按照样品上样量准确上样,蛋白经SDS-PAGE电泳后,湿转到PVDF膜上,转膜完成后,将PVDF膜置于50 g/L脱脂奶粉封闭液中,室温摇床孵育2 h;分别加入一抗SUR1(1∶1 000)、SUR2B(1∶1 000)、Kir6.2(1∶1 000)以及β-actin(1∶1 000),于4 ℃摇床上低速摇动孵育过夜;用1×TBST溶液漂洗3次,每次10 min;加入用1×TBST溶液配制的山羊抗兔二抗(1∶10 000)、山羊抗鼠二抗(1∶10 000),室温摇床孵育1.5 h;再用1×TBST溶液漂洗3次,每次10 min。将PVDF膜置于ECL显影液中孵育1 min,再将PVDF膜置于显影仪中显影并拍摄。用Image J 10.0分析软件对条带进行灰度值分析,以SUR1、SUR2B、Kir6.2与β-actin的比值作为目的蛋白的相对表达水平。
1.3 实时荧光定量PCR方法检测黑质中SUR1、SUR2B和Kir6.2的mRNA表达
用TRIzol提取小鼠黑质RNA,按照Thermo公司逆转录试剂盒操作说明,配制两步反应体系,先42 ℃变性60 min、25 ℃反转录5 min,然后升温至70 ℃、作用5 min使反转录酶失活,于4 ℃冷却,将mRNA反转录合成cDNA。采用SYBR Green染料法定量检测目的基因SUR1、SUR2B、Kir6.2及内参照基因GAPDH的表达,按照荧光定量PCR说明书配制PCR反应体系,采用两步法经过40个循环完成扩增,采用2-ΔΔCt法计算目的基因的相对表达量。PCR扩增引物及其序列见表1。
1.4 统计学分析
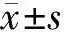
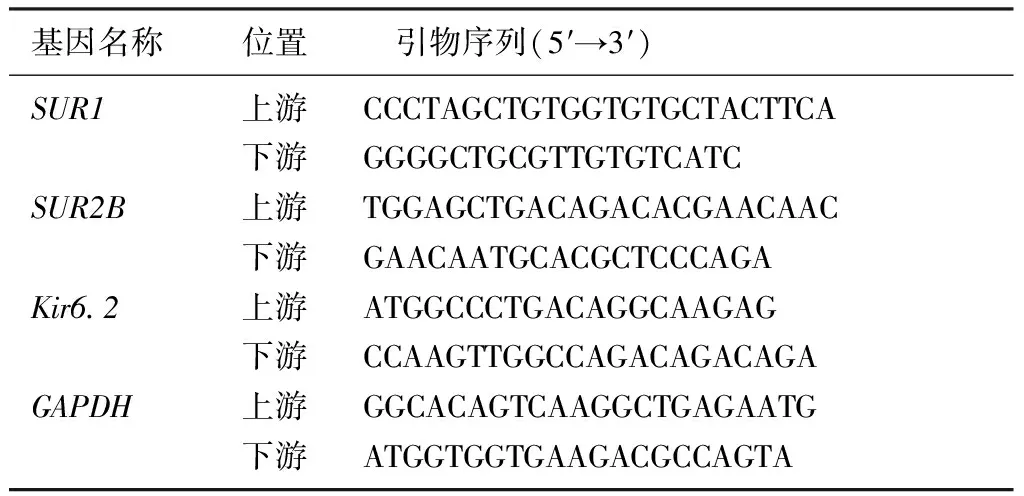
表1 PCR引物及其序列
2 结 果
2.1 Ghsr-/-小鼠黑质SUR1、SUR2B、Kir6.2的蛋白表达变化
Ghsr-/-组和WT组3月龄小鼠黑质KATP通道亚基SUR1蛋白表达水平分别为0.996±0.120和0.473±0.076(n=5),差异有统计学意义(t=3.389,P<0.05);SUR2B蛋白表达水平分别为0.899±0.142和0.798±0.118(n=5),差异无统计学意义(t=0.492,P>0.05);Kir6.2蛋白表达水平分别为0.827±0.081和0.728±0.065(n=5),差异亦无统计学意义(t=0.860,P>0.05)。
2.2 Ghsr-/-小鼠黑质SUR1、SUR2B、Kir6.2的mRNA表达变化
Ghsr-/-组和WT组3月龄小鼠黑质KATP通道亚基SUR1mRNA的表达水平分别为1.024±0.074和0.990±0.047(n=5),SUR2BmRNA的表达水平分别为1.012±0.082和1.212±0.421(n=5),而Kir6.2mRNA的表达水平分别为1.137±0.466和1.209±0.118(n=5),两组比较差异均无统计学意义(t=0.294~1.546,P>0.05)。
3 讨 论
GHSR1a和KATP通道都广泛分布于中枢神经系统[13-14]。GHSR1a主要通过与ghrelin结合发挥作用,但是其在缺乏配体激活时也能够对学习记忆、生长发育等发挥调节作用,这就是GHSR1a的本构型活性[15]。先前有研究结果表明,GHSR1a和多巴胺受体1型(DRD1)结合可以在中脑和海马的神经元亚群中共表达,且可在体外形成异源二聚体,从而进一步修饰G蛋白,扩增DA信号[16-18]。然而,在PD特异性诱导的多能干细胞来源的DA能神经元中GHSR1a的表达显著降低,提示GHSR1a与PD密切相关[19]。本实验选取Ghsr-/-小鼠作为实验对象,通过蛋白免疫印迹法检测到脑内黑质DA能神经元KATP通道SUR1亚基蛋白表达水平显著下调,而SUR2B、Kir6.2亚基蛋白表达均未发生明显改变。本研究同时应用实时荧光定量PCR方法检测了KATP通道各亚基mRNA表达水平变化,结果显示,Ghsr-/-小鼠黑质SUR1、SUR2B及Kir6.2的mRNA表达水平均未发生改变。我们推测这可能与GHSR1a基因敲除后DA能神经元内蛋白质降解异常有关,GHSR1a基因敲除一方面可能引起神经元内自噬的过度激活,另一方面可能引起蛋白泛素化水平异常,使蛋白降解增加。但具体机制还有待于进一步探讨。
SUR1是构成KATP通道的亚基之一,属于三磷酸腺苷结合盒转运体(ABC)蛋白家族,它主要调节KATP通道对ATP、腺苷和药物的敏感性[20-22]。本实验室前期研究证实,携带人A53T突变型α-syn的转基因PD模型小鼠黑质KATP通道的SUR1蛋白表达水平显著上调,而Kir6.2和SUR2B的表达无明显变化。另有研究结果显示,PD病人DA能神经元中SUR1的表达水平比正常人高2倍[23]。KATP通道SUR1亚单位的表达上调能够激活腺苷酸激活蛋白激酶,促进KATP通道的跨膜转运,进而促进其开放[24-25]。但是在PD发病过程中,SUR1的表达异常对于黑质DA能神经元具有何种作用尚不明确。到目前为止,KATP通道在PD中的作用还存在一定的争议。在PD发病早期,KATP通道的激活可以促进DA释放,从而保护神经元。然而,随着疾病的进一步发展,KATP通道会持续激活,造成DA能神经元损伤[26-27]。因此,由GHSR1a基因敲除介导的KATP通道SUR1亚单位表达变化的机制及其在PD中的作用还有待于进一步探讨。本文研究结果为GHSR1a与KATP通道在PD中的作用研究提供了理论依据。

