河流弧菌B7-1羧肽酶基因的克隆与功能鉴定
韦松松,谢晓东,陈帅君,黄海东,杨红澎,吴疆
河流弧菌B7-1羧肽酶基因的克隆与功能鉴定
韦松松,谢晓东,陈帅君,黄海东,杨红澎,吴疆通信作者
(天津农学院农学与资源环境学院,天津300392)
羧肽酶是一类外切酶,它能专一性地从肽链C末端逐一切下单个氨基酸,在生物体中多以酶原的形式存在。近年来无论是在生物界还是在医学行业,羧肽酶越来越引起人们的关注。本研究从细菌中提取全基因组,设计上下游引物进行编码羧肽酶基因的克隆,将扩增的羧肽酶基因转入到TOP10大肠杆菌中进行质粒扩增,然后在BL-21大肠杆菌中进行目的蛋白的表达,通过对其表达的羧肽酶进行定性定量分析,可以确定重组的包含的羧肽酶基因在大肠杆菌中成功表达。
基因;羧肽酶;酶活;Folin-酚法
羧肽酶是一类肽链外切消化酶,它可以专一性地从肽链C末端逐一切下氨基酸,使切下的氨基酸成为游离状态。根据羧肽酶活性中心含有的丝氨酸残基、金属离子、半胱氨基酸残基的不同,可将羧肽酶分为丝氨酸羧肽酶、金属羧肽酶以及半胱氨基酸羧肽酶[1]。
丝氨酸羧肽酶是一类属于α/β水解酶家族的酸性羧肽酶,其家族成员众多[2],主要存在于植物或真菌的液泡以及动物的溶酶体中[3]。在酸性环境下,丝氨酸羧肽酶具有末端蛋白水解酶、酯酶和脱酰胺酶的活性,可同时参与多肽和蛋白质的加工、修饰与降解等重要环节[4]。金属羧肽酶是一类在酸性或弱碱性条件下具有极大活性,能够帮助蛋白质消化的一类细胞外羧肽酶,分为羧肽酶A、羧肽酶B、甘氨酸羧肽酶、赖氨酸羧肽酶、谷氨酸羧肽酶(又名羧肽酶G)。半胱氨酸羧肽酶多存在于动物的消化道及心脏、肝等组织的细胞液中,对C-末端氨基酸具有广谱性,但是对C-末端Pro无活性,内切酶活性较低[5-6]。
羧肽酶常常被用于医药、食品、饲料加工等行业,且用量较大。在生物技术领域,羧肽酶可用于多肽的合成以及多肽氨基酸序列测定[7]。现阶段羧肽酶主要来源于动物胰脏,但数量有限且价格昂贵,因此,羧肽酶的应用受到了一定的限制。在微生物中提纯羧肽酶基因,并借助基因工程策略以微生物为宿主进行大量生产重组羧肽酶,来克服羧肽酶来源限制。本研究拟从河流弧菌B7-1菌株中克隆羧肽酶基因并对其活性进行研究,以期为羧肽酶基因工程生产提供参考数据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
(B7-1)细菌全基因组、大肠杆菌。
1.1.2 酶
Mix、Fast DigestH I、Fast DigestⅠ、Repligation Mix(2×)。
1.1.3 引物
克隆羧肽酶基因()所需引物:上游引物5'-atgaaatgccgttcaaaattatc-3'(下划线为H I酶切位点)、下游引物5'-cgattgcttgatcatgtccacc-3'(下划线为Ⅰ酶切位点)。
1.1.4 试剂与试剂盒
质粒小提纯化试剂盒、普通DNA纯化试剂盒、2×PCR Master Mix、DNA MarkerⅢ,TIANGEN公司;硫酸卡那霉素、Folin-酚蛋白定量试剂盒、L-Tyrosine和琼脂粉,北京鼎国昌盛生物技术有限责任公司;IPTG(异丙基-β-D-硫代半乳糖苷)、Tris(三羟甲基氨基甲烷)、EDTA Na2·2H2O(二水乙二胺四乙酸二钠),GENVIEW公司。
1.2 方法
1.2.1 基因克隆
PCR总体系为25 μL。以25 μL PCR产物为模板进行200 μL体系的扩增和产物纯化,扩增后进行琼脂糖凝胶电泳,对扩增的目的基因进行验证。
1.2.2 载体质粒pET28a提取
取5 mL培养12~16 h的菌液(pET-28a质粒),加入离心管中,按照质粒小提试剂盒操作步骤提取质粒。
1.2.3 基因与载体双酶切和连接
为使目的基因和载体准确连接,先对目的基因和载体进行双酶切,使其产生相同的黏性末端。酶切体系为200 μL,包括酶(H I、Ⅰ)各2 μL、10×Fast Digest Buffer 20 μL、目的基因pET-28a质粒载体50 μL、去离子水126 μL。37 ℃酶切3 h,并对酶切产物进行纯化回收,然后对回收产物进行琼脂糖凝胶电泳验证,验证完毕后进行保存。
连接体系10 μL,22 ℃放置20 min,获得连接产物。采用热激转化法将连接产物转入Top10感受态细胞中,并进行电泳验证是否连接成功。连接成功后提取质粒并用同样的热激转化法将质粒转入BL-21大肠杆菌细胞中进行重组蛋白表达。
1.2.4 目标蛋白的表达
1.2.4.1 目标蛋白表达诱导剂(IPTG)浓度确定
取6个250 mL摇瓶,编号1~6,于每个摇瓶中加入10 mL培养12 h的菌液,分别加入IPTG,使终浓度梯度从0.05 mmol/L到0.50 mmol/L,28 ℃ 160 r/min摇床震荡培养4 h。将培养好的菌液进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),以确定IPIG最佳浓度。
1.2.4.2 目标蛋白表达随时间变化试验
取1个250 mL摇瓶,加入100 mL菌液,每隔一定时间取出16 μL,加入4 μL SDS-Loading buffer,煮沸3 min,进行蛋白电泳,染色、脱色并拍照。
1.2.4.3 目标蛋白的分离纯化
将已转入BL-21的菌株扩大培养至200 mL,37 ℃培养12 h,加入最佳浓度的IPTG(0.2 mmol/ L),28 ℃诱导4 h,用His标签蛋白纯化试剂盒进行蛋白纯化。试验结束后,将流穿液与洗脱液进行SDS-PAGE凝胶电泳验证,方法参照1.2.4.1。
1.2.5 羧肽酶活性鉴定
1.2.5.1 羧肽酶定性验证
将目的菌株(未用IPTG诱导的基因工程菌株)与BL-21空菌分别稀释梯度为10-1、10-2、10-3(加上原菌共4个稀释梯度)。在超净工作台下,先在培养基上涂抹10 μL IPTG,待其风干后,向培养基中滴加不同浓度的稀释菌液,37 ℃恒温箱中过夜培养,待培养基中长出小菌落后,观察对比,拍照记录。
1.2.5.2 Folin-酚试剂测定酪氨酸含量
用脱脂奶粉配成1%酪蛋白溶液,取5支试管,其中1支试管中不加羧肽酶作为对照,另外4支试管标号1~4,分别代表反应1、4、6、10 min。每支试管取6 mL含1%酪蛋白的奶粉溶液和10 μL之前纯化的羧肽酶于37 ℃水浴锅中预热,使其在37 ℃下分别反应1、4、6、10 min,每支试管反应完全后立即放入沸水中煮沸3 min。用Folin & Ciocalteu酚试剂进行定量分析,方法参照试剂盒说明书。
2 结果与分析
2.1 CPP基因的克隆
图1中2、3、4孔是克隆的目的基因,由于已知的目的基因大小为2 001 bp,故根据购买的MarkerⅢ标准与图1中的3条目的基因大小进行对比验证,表明克隆的是目的基因。
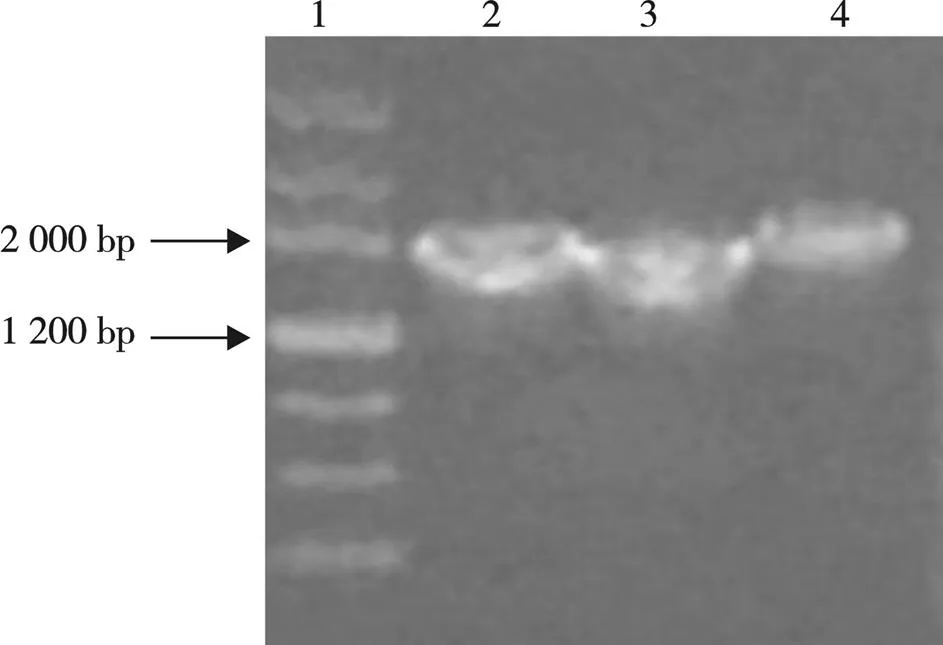
图1 CPP琼脂糖凝胶电泳图
2.2 pET-28a与CPP基因的双酶切回收
图2中第1个孔是Marker,第2个孔是pET-28a质粒酶切纯化回收,第3个孔是pET- 28a质粒双酶切(H I 、I),第4个孔是目的基因双酶切点样孔。经过与Marker对比,可见条带大小正确,表明质粒和基因双酶切成功。

图2 pET-28a质粒和目的基因酶切验证
2.3 CPP基因与载体的连接转化
对转化的BL-21进行菌液PCR验证,由图3可见有明显的条带,证明转化成功。
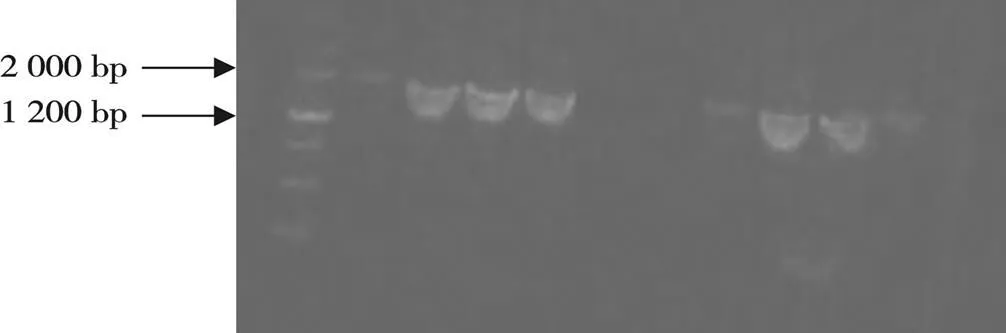
图3 重组质粒转化BL-21菌液PCR结果
2.4 CPP蛋白的诱导表达
对于此目的基因所编码的蛋白质,根据计算结果(2001/3×110=73 370 u≈73 ku,即在从上到下Marker带的第一和第二条带之间),在浓度验证图和时间验证图上都有正确的条带,见图4。在确定浓度时发现,CPP蛋白表达随诱导剂浓度大小变化范围不大,故在后续试验时选用IPTG浓度为0.2 mmol/L。在确定最佳时间时发现,在培养表达4 h时CPP蛋白表达效果较好。因此,在后续纯化回收蛋白时的最佳IPTG浓度为0.2 mmol/L,时间为4 h。

图4 不同IPTG浓度和诱导时间的电泳结果
注:a为IPTG浓度验证图;b为时间验证图
使用镍柱纯化目标蛋白(从左至右依次为蛋白Marker、BL-21全菌诱导、BL-21全菌非诱导、流穿液、洗柱液、洗脱液),从图5可以看出,全菌诱导液在相应位置有目标蛋白的表达,说明目标蛋白成功诱导表达,在洗脱液中看到纯化的目标蛋白条带,表明镍柱纯化成功。
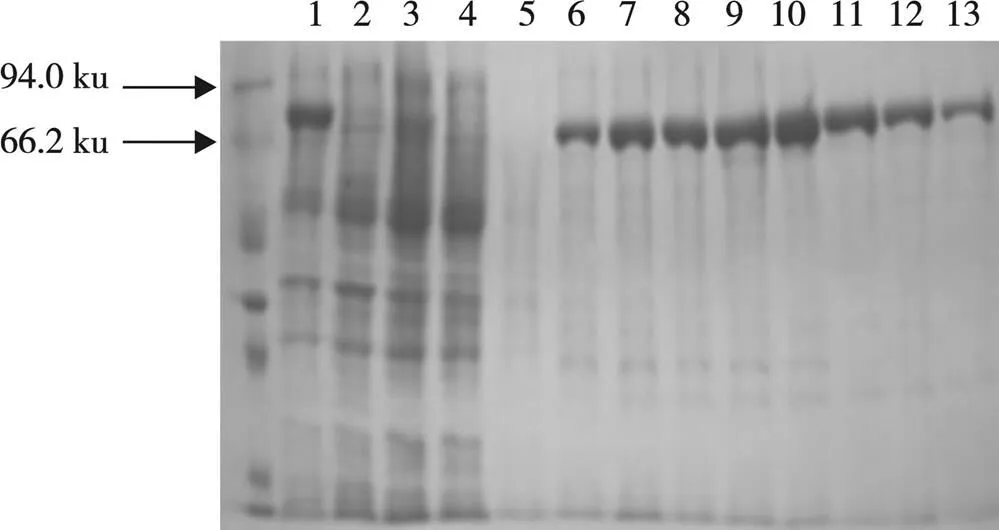
图5 目的蛋白纯化结果
注:1为全菌诱导;2为全菌非诱导;3为流穿液; 4为洗柱液;5~13为洗脱液
2.5 CPP催化活性的鉴定
由图6可见,平板左侧4个菌落从上到下依次为100、10-1、10-2、10-3浓度的BL-21空菌落,右侧与左侧浓度对应,是转化成功的BL-21菌株。
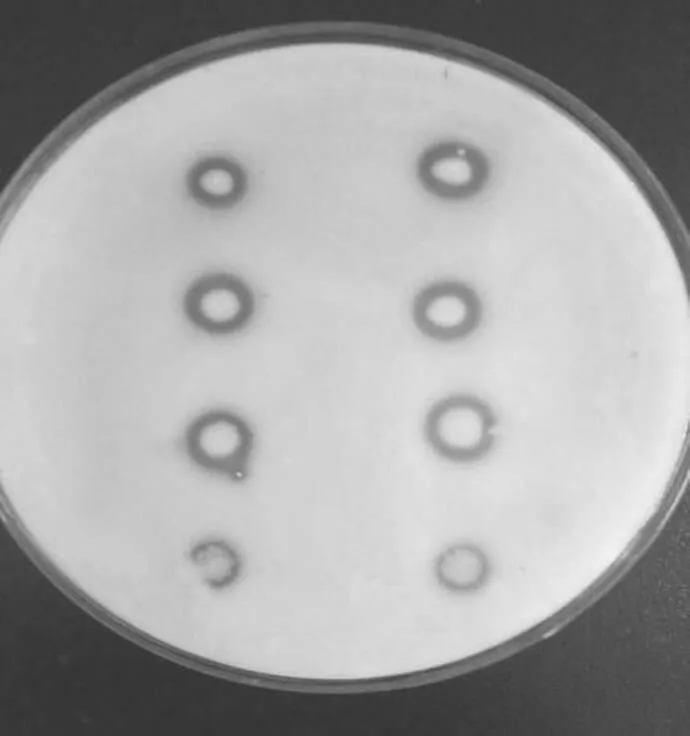
图6 羧肽酶催化活性鉴定结果
从表1中菌落外内直径差进行比对发现,未进行转化的空菌(左侧菌落)分解蛋白质的能力弱于带有目的基因的菌株(右侧菌落)。说明转化成功的BL-21菌株产羧肽酶能力强于BL-21空菌。
表1 不同菌液稀释度对蛋白水解圈的影响 cm
指标菌液稀释度 10010-110-210-3 左右左右左右左右 内径0.200.200.200.200.200.300.200.20 外径0.400.500.450.500.500.550.300.40 外-内0.200.300.250.300.300.250.100.20
2.6 反应时间对酶活的影响
在测量羧肽酶活力时,根据表2中的吸光度数值计算各个时间段的酶活。图7为酪氨酸标准曲线,通过计算可知在反应1 min时吸光度值为负,可能是因为反应时间不够充足,在以未加羧肽酶的试管为对照进行吸光度值测定时,数值为负,在4、6、10 min 时的值随着时间的增长而增加,此时符合酶的特性。
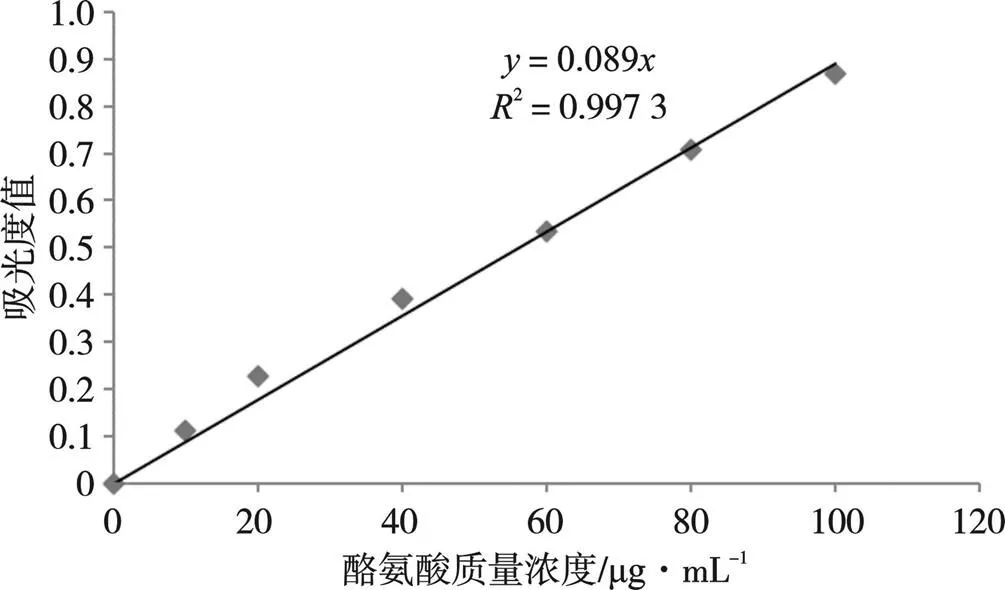
图7 Folin测酪氨酸标准曲线
表2 反应时间对样品酪氨酸吸光度值的影响
测定时间/min14610 吸光度值0.0000.0100.056 0.210 酪氨酸含量/μg∙mL-1-1.1246.29223.596 U-1.6806.29214.158
注:定义为10 μL羧肽酶在1 min产生1 μg酪氨酸;表中“-”表示未检测到数值
3 讨论与结论
羧肽酶基因在高等生物中分布非常广泛, 是一个庞大的水解酶基因家族。本研究从实验室分离得到的河流弧菌B7-1中克隆其羧肽酶基因,并连接至大肠杆菌表达载体pET-28a,利用IPTG诱导表达CPP融合蛋白。在纯化融合蛋白时,采用Ni2+层析柱进行亲和纯化,并用SDS-PAGE分析纯化结果,最后对纯化蛋白进行活性鉴定。
目前,大多数羧肽酶研究集中于其在动物疾病中的作用,也有研究表明羧肽酶基因及其启动子在植物抗逆境胁迫中发挥着重要功能[8]。本研究从河流弧菌B7-1羧肽酶的催化功能入手,鉴定了其催化蛋白水解的催化能力,为进一步对其进行深入研究与应用奠定了基础。在本试验过程中,测得在1、4、6、10 min下的酶催化活性,可以看出除了反应开始的1 min外,催化活性均随时间的增加而上升。由定量测定结果表明,转入羧肽酶基因的比未转化的具有更高的催化活性,从而明确了B7-1菌株羧肽酶基因的催化功能。
[1] BARRETT A J,RRAWLINGS N D,WOESSNER J F. Handbook of proteolytic enzyme[M]. San Diego:Academic Press,1998.
[2] 刘丽,王静,张志明,等. 玉米丝氨酸羧肽酶基因()的克隆及表达分析[J]. 作物学报,2013,39(1):164-171.
[3] KREM M. Molecular markers of serine protease evolution[J]. The EMBOJ,2001,20(20):3036-3045.
[4] 冯英,刘庆坡,贾佳,等. 拟南芥丝氨酸羧肽酶类蛋白家族的基因组学分析[J]. 遗传学报,2005,32(8):864-873.
[5] 吴静,闵柔,邬敏辰,等. 羧肽酶的研究进展[J]. 食品与生物技术学报,2012,31(8):793-801.
[6] 朱楚霞,肖铃娣,胡朝阳,等. 黄瓜丝氨酸羧肽酶类蛋白家族鉴定及表达分析[J]. 江西农业大学学报,2021,43(6):1395-1405.
[7] 张婷,肖瑞. 胞质羧肽酶家族的分布、结构与功能[J]. 生命的化学,2021,41(3):506-511.
[8] CHIU C H,CHENG H,TZEN J T C,et al. Molecular identification and characterization of agene associated with abiotic stress in tea plant,(L.)[J]. Plant Growth Regul,2016,79:345-353.
Cloning and functional identification ofB7-1 carboxylpeptidase gene
Wei Songsong, Xie Xiaodong, Chen Shuaijun, Huang Haidong, Yang Hongpeng, Wu JiangCorresponding Author
(College of Agronomy and Resource Environment, Tianjin Agricultural University, Tianjin 300392, China)
Carboxypeptidase is a type of exonuclease that can specifically cleave individual amino acids one by one from the c-terminus of a peptide chain. In recent years, carboxypeptidase has attracted more and more attention in both biological and medical industry. In this study, the whole genome was obtained from bacterial, and an upstream primer and a downstream primer were designed to amplify the target gene encoding carboxypeptidase. The amplified target gene was transferred into TOP10for recombinant amplification, and then the target protein was expressed inBL-21. Qualitative and quantitative analysis of the carboxypeptidase expression revealed that the recombinant strain containing the carboxypeptidase gene ofhad strong capability of expressing carboxypeptidase and strong expressed enzyme activity.
gene; carboxypeptidase; enzyme activity; Folin-phenol method
1008-5394(2022)02-0018-04
10.19640/j.cnki.jtau.2022.02.004
Q786
A
2020-11-25
国家级大学生创新创业训练计划项目(202010061011);天津市科技计划项目(20ZYCGSN00390)
韦松松(2000—),男,本科在读,主要从事植物基因工程方面的研究。E-mail:jcn30631191@126.com。
吴疆(1976—),男,副教授,博士,主要从事植物分子生物学方面的研究。E-mail:wujiangjack@tjau.edu.cn。
责任编辑:宗淑萍
——一道江苏高考题的奥秘解读和拓展

