康宁木霉固态发酵改善茶渣营养价值
崔艺燕,李家洲,田志梅,邓盾,鲁慧杰,刘志昌,容庭,马现永,2*
(1. 广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广东畜禽肉品质量安全控制与评定工程技术研究中心,广东广州 510640;2. 岭南现代农业科学与技术广东省实验室茂名分中心,广东茂名 525000)
茶(Camellia sinensis)是中国的传统饮料,是仅次于水的全球第二大最常用的饮料[1]。2019 年,全球茶叶产量约为650 万t[1]。中国茶渣的排放量约为每年16 万t[2]。大量茶叶废料在开放的环境中产生和丢弃,这些可再生的生物质资源给环境带来了巨大的压力,同时也浪费了茶叶中的生物活性成分。茶渣的资源化利用已成为亟待解决的问题。
实际上,茶渣中含有许多营养物质。干茶渣的主要营养成分包括粗蛋白质(crude protein,CP)、粗脂肪(ether extract,EE)、碳水化合物、粗纤维(crude fiber,CF)等[3-4]。此外,茶渣所含的生物活性化合物与普通茶相同,且含量相似[5]。茶渣富含功能物质,如多酚、生物碱、皂苷、多糖和有机酸[5-8],以及具有抗氧化、免疫调节、抗肥胖和抗糖尿病等活性[5,8]。动物研究表明,茶渣不仅能提高动物的免疫力,调节肌肉纤维类型,还能改善动物的消化能力、肉品质、抗氧化能力和肠道形态[9-11]。因此,茶渣是一种很有前途的饲料添加剂。但茶渣中含有皂苷、咖啡因等抗营养因子[8],适口性差,不适合作为饲料添加剂直接使用。选择绿色有效的生物技术改良茶渣,对于茶资源的可持续发展至关重要。
固态发酵是一种经济有效的生产技术,具有规模小、操作简单、生产成本低、不污染环境等优点。真菌的菌丝遍布表面,生长迅速,代谢活性高[12]。真菌可以产生代谢物并促进化合物的生物转化[13]。真菌分泌丰富的蛋白酶、纤维素酶等酶系,使大分子物质分解为葡萄糖、氨基酸等小分子物质,从而改善饲料品质。康宁木霉(Trichoderma koningii)常用于植物病原菌的生物防治中,在各种农业废弃物饲料转化中也较为常见。康宁木霉能够在不利的环境条件下繁殖,能够使用多种碳源和氮源[12]。研究发现,康宁木霉发酵桑叶(Morus alba)后的CP 含量高达31.27%,产蛋白酶活性高达107.173 U·mL-1[14]。康宁木霉也是分解高粱(Sorghum bicolor)秸秆CF 的优势菌种[15]。目前,茶渣的研究集中在有机肥[4,16]、蘑菇基质[17]、吸附重金属、处理废水[18]、制备砖[7]等方向,茶渣饲料化利用以直接饲喂反刍动物为主[3,9],对茶渣进行发酵处理的较少。同时,未见康宁木霉发酵茶渣的相关研究。因此,本研究目的是通过单因素和正交试验,筛选出康宁木霉茶渣发酵条件。利用康宁木霉固态发酵生产发酵茶渣,以提高茶渣的营养价值和功能成分,降低抗营养因子的含量。
1 材料与方法
1.1 试验材料
试验于2020 年1-10 月在广东省农业科学院创新大楼进行。茶渣由康师傅饮料有限公司提供,60 ℃干燥后,研磨成粉,过0.425 mm 筛。茶渣CP、EE、CF、中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)的含量分别为25.93%、2.67%、25.48%、45.45%和25.23%。康宁木霉从陈皮分离筛选所得,菌丝放射状生长,菌落背面浅黄色,孢子为黄绿色。
1.2 试验方法
1.2.1真菌扩增及孢子液的制备 马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基用作扩增培养基。将0.2 mL 2×108~3×108个孢子·mL-1孢子液涂布到PDA 培养基的表面,28 ℃培养5~7 d。为制备孢子液,首先用无菌刀片刮擦长满真菌的培养基表面。用5 mL 无菌水把真菌及表面培养基转移到15 mL 离心管中,加入3 颗玻璃珠,涡旋匀浆15 min。最后,采用无菌脱脂棉进行过滤,混合液过滤2 次得孢子悬浮液。使用血球计数板(XB.K.25,上海市求精生化试剂仪器有限公司)对孢子的浓度进行计数,使用浓度为1×107个孢子·mL-1。
1.2.2发酵培养基的制备 将40 g 茶渣混合物(相应基质比例)放入200 mL 培养瓶中,121 ℃灭菌20 min。冷却后,在无菌条件下,每个瓶中加入相应量的孢子悬浮液,用无菌玻璃棒将孢子悬液和底物搅拌50 次以上,最后用透气盖封口。
1.3 单因素试验
在自然pH 下,研究基质比例(茶渣∶玉米粉)、料液比(基质∶水)、接种量、温度和时间对茶渣发酵效果的影响。以CP、EE、还原糖、黄酮、皂苷和咖啡因含量为测定指标,选出较好的单因素水平,据此进行下一个单因素试验,每水平3 个重复。
1.3.1基质比例对发酵茶渣的影响 茶渣∶玉米粉比例设为6∶4、7∶3、8∶2、9∶1,料液比为4∶6,接种量为4%,温度为28 ℃,时间为8 d。
1.3.2料液比对发酵茶渣的影响 按1.3.1 确定的基质比例,料液比设为3∶7、4∶6、5∶5、6∶4、7∶3,其他条件同1.3.1。
1.3.3接种量对发酵茶渣的影响 按1.3.2 确定的料液比,接种量设为2%、4%、6%、8%、10%,其他条件同1.3.2。
1.3.4温度对发酵茶渣的影响 按1.3.3 确定的接种量,温度设为25、28、31、34、37 ℃,其他条件同1.3.3。
1.3.5时间对发酵茶渣的影响 按1.3.4 确定的温度,时间设为0、2、4、6、8、10、14、22 d,其他条件同1.3.4。
1.4 正交试验
为了获得发酵茶渣的优化组合,以基质比例(A)、发酵温度(B)、接种量(C)和发酵时间(D)为影响因素,进行L9(34)正交试验,设计依据为单因素试验结果。正交试验设计如表1 所示,每个因素设3 个水平,共9 组,每组3 个重复,试验中发酵pH 自然,料液比为5∶5。
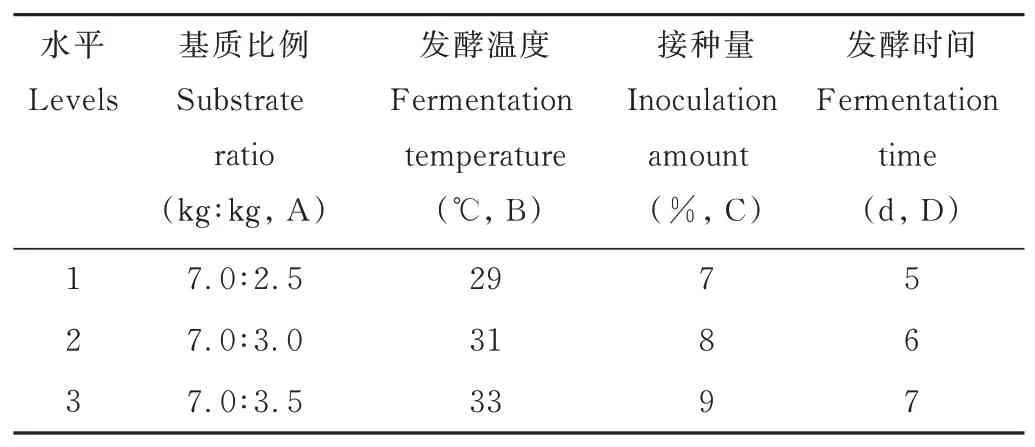
表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
1.5 验证试验及对比试验
根据正交试验得出的最优组合(A1B2C1D2 或A1B2C1D3),进行茶渣发酵(6 个重复)。比较最优条件下发酵茶渣和正交试验表中的各个指标,验证最优组合发酵茶渣效果优于正交试验各组合发酵。对比试验即比较茶渣混合物在最优条件下发酵前后的营养价值。
1.6 指标测定
发酵产物冷冻干燥,粉碎过0.425 mm 筛。CP 含量测定参照GB/T6432-2018[19],EE 含量测定参照GB/T6433-2006[20],还原糖含量采用二硝基水杨酸法测定(DNS 试剂,D7800,Solarbio;按照说明书测定),黄酮含量测定根据Wang 等[21]的方法,皂苷含量测定参照孙万里[22]的方法,咖啡因含量测定参照GB/T8312-2013[23]。
1.7 发酵效果评价
参照Wang 等[21]和Guarda 等[24]的方法,使用综合评分评估发酵效果。CP、EE、还原糖、黄酮、皂苷、咖啡因分别占比25%、20%、10%、15%、15%、15%。每个样品的总分是所有指标的总和。每个指标的平均值为平均分数,最佳结果定义为对应的最高分,最低结果定义为0 分,最佳/差结果与平均结果设置中间分(表2)。

表2 评分标准Table 2 Scoring criteria
1.8 数据处理
采用SPSS 19.0 软件进行数据分析。单因素试验、验证试验和对比试验结果采用单因素方差分析(one-way ANOVA),用Duncan 氏法进行多重比较。正交试验结果采用极差分析和一般线性模型进行方差分析。结果用平均值和均值标准误表示,P<0.05 为差异显著。
2 结果与分析
2.1 基质比例(茶渣∶玉米粉)对发酵茶渣的影响
由表3 可知,随着茶渣含量的增加,发酵茶渣的CP、皂苷、咖啡因含量增加(P<0.05),而还原糖含量则降低(P<0.05)。当基质比例为9∶1 时,发酵茶渣的CP 和皂苷含量最高(P<0.05)。基质比例对发酵茶渣的黄酮含量无显著影响(P>0.05)。基质比例为7∶3 的发酵茶渣综合评分最高。
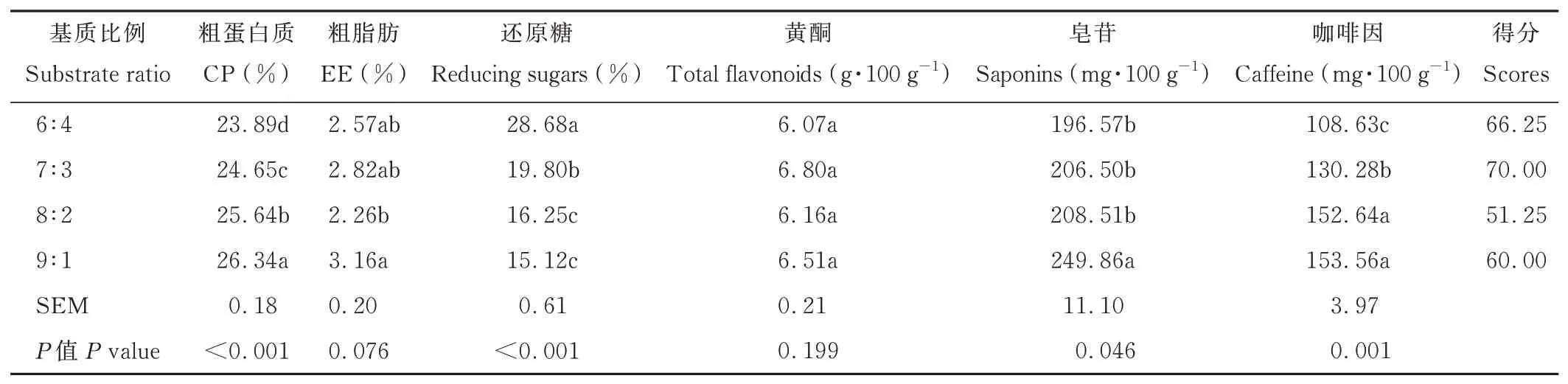
表3 基质比例(茶渣∶玉米粉)对发酵茶渣的影响Table 3 Effects of substrate ratio(tea dregs∶cornmeal)on fermented tea dregs(DM basis)
2.2 料液比(基质∶水)对发酵茶渣的影响
由表4 可知,EE 含量随着基质的增加而显著降低(P<0.05),而还原糖含量则显著增加(P<0.05)。料液比为4∶6 时,黄酮含量最高,随后是5∶5、6∶4、3∶7,7∶3 时最低(P<0.05)。料液比为3∶7 的茶渣皂苷含量显著高于其他比例(15.03%~24.27%,P<0.05)。料液比为7∶3 的茶渣咖啡因含量显著低于其他比例(10.95%~14.72%,P<0.05)。各组间CP 含量差异不显著(P>0.05)。料液比为5∶5 的发酵茶渣综合评分最高。

表4 料液比(基质∶水)对发酵茶渣的影响Table 4 Effects of solid-liquid ratio(substrate∶water)on fermented tea dregs(DM basis)
2.3 接种量对发酵茶渣的影响
由表5 可知,不同接种量对发酵茶渣CP、EE、皂苷和咖啡因含量无显著影响(P>0.05)。接种量为8%和10%的茶渣还原糖含量显著高于其他接种量(P<0.05)。接种量为2%、4%、8%的茶渣黄酮含量显著高于6%和10%的发酵茶渣(P<0.05)。接种量为8%的发酵茶渣综合评分最高。
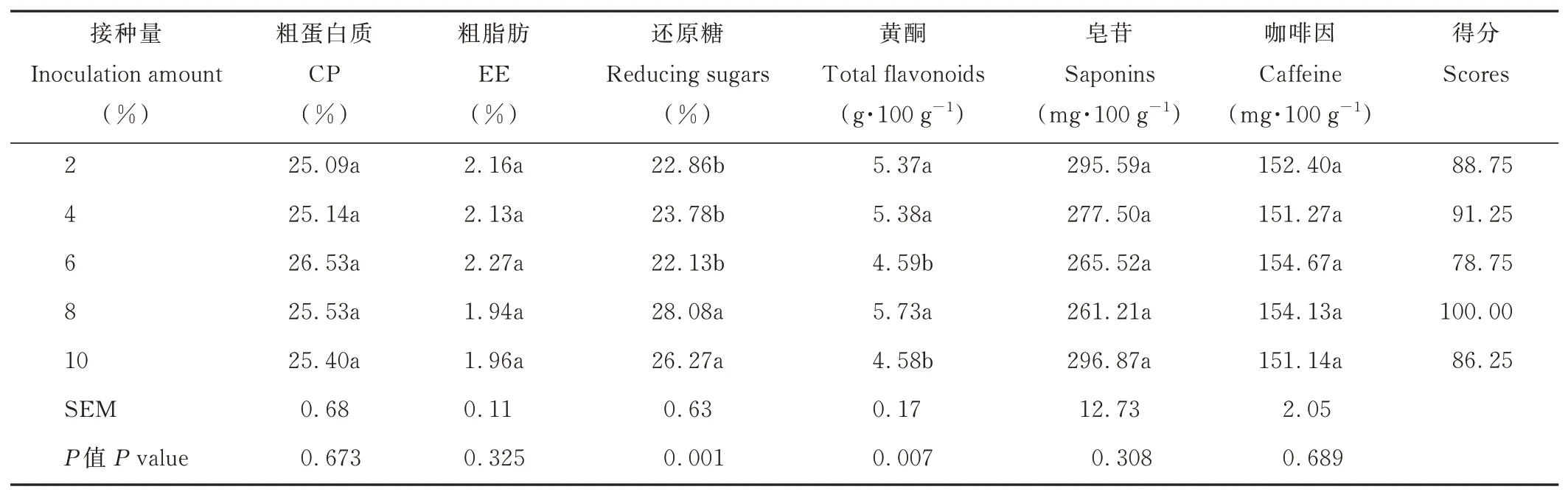
表5 接种量对发酵茶渣的影响Table 5 Effects of inoculation amount on fermented tea dregs(DM basis)
2.4 温度对发酵茶渣的影响
由表6 可知,当温度为31 ℃时,发酵茶渣的CP 含量显著高于25 和28 ℃(P<0.05),31~37 ℃的CP 含量无显著差异(P>0.05)。25 和31 ℃时,发酵茶渣还原糖含量显著高于其他温度(P<0.05)。25 ℃发酵茶渣的黄酮含量较其他温度显著提高24.81%~46.12%(P<0.05)。34 ℃的皂苷含量最低。31 和34 ℃时,咖啡因含量显著高于其他温度(P<0.05)。不同温度的发酵茶渣EE 含量差异不显著(P>0.05)。温度为31 ℃的发酵茶渣综合评分最高。
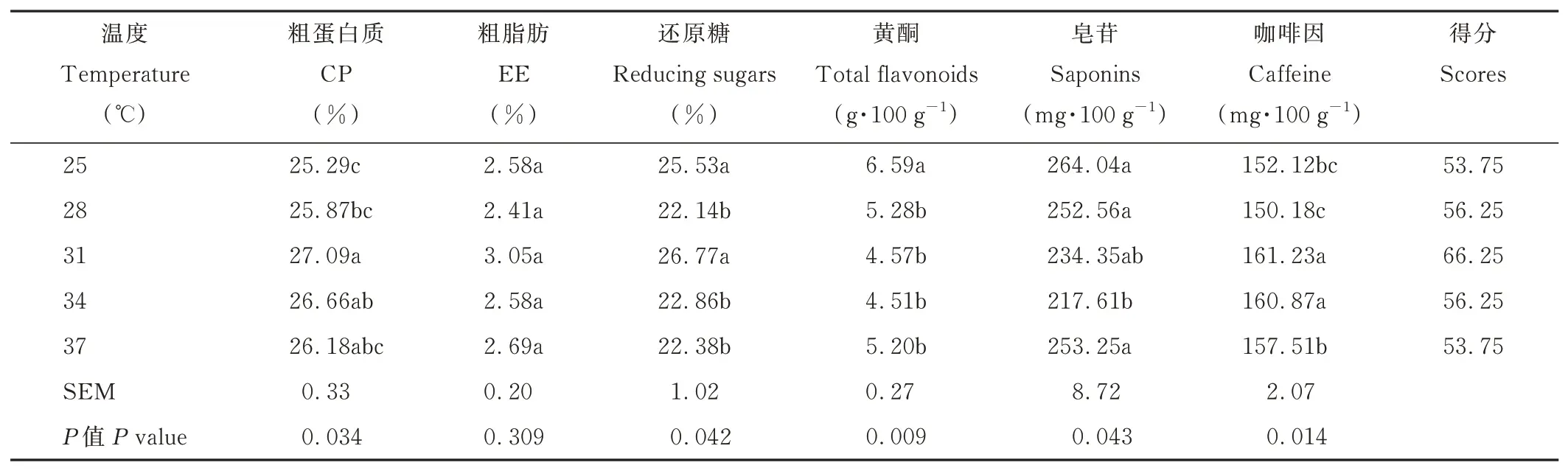
表6 温度对发酵茶渣的影响Table 6 Effects of temperature on fermented tea dregs(DM basis)
2.5 时间对发酵茶渣的影响
由表7 可知,随着发酵时间的增加,CP 和咖啡因含量增加。与未发酵茶渣相比,发酵22 d 的茶渣CP 和咖啡因含量分别显著提高34.15% 和45.60%(P<0.05)。发酵2 d 的茶渣还原糖含量较未发酵茶渣显著增加1039.13%(P<0.05),此后随着时间增加而显著减少(P<0.05),但均显著高于未发酵茶渣(P<0.05)。发酵6 d,黄酮含量显著提高并达到最高值(P<0.05),随发酵时间增加而逐渐降低。随发酵时间的增加,茶渣皂苷含量逐渐降低。与未发酵茶渣相比,22 d 的茶渣皂苷含量显著降低36.22%(P<0.05)。发酵时间对茶渣粗脂肪含量无显著影响(P>0.05)。发酵6 d 的茶渣综合评分最高。
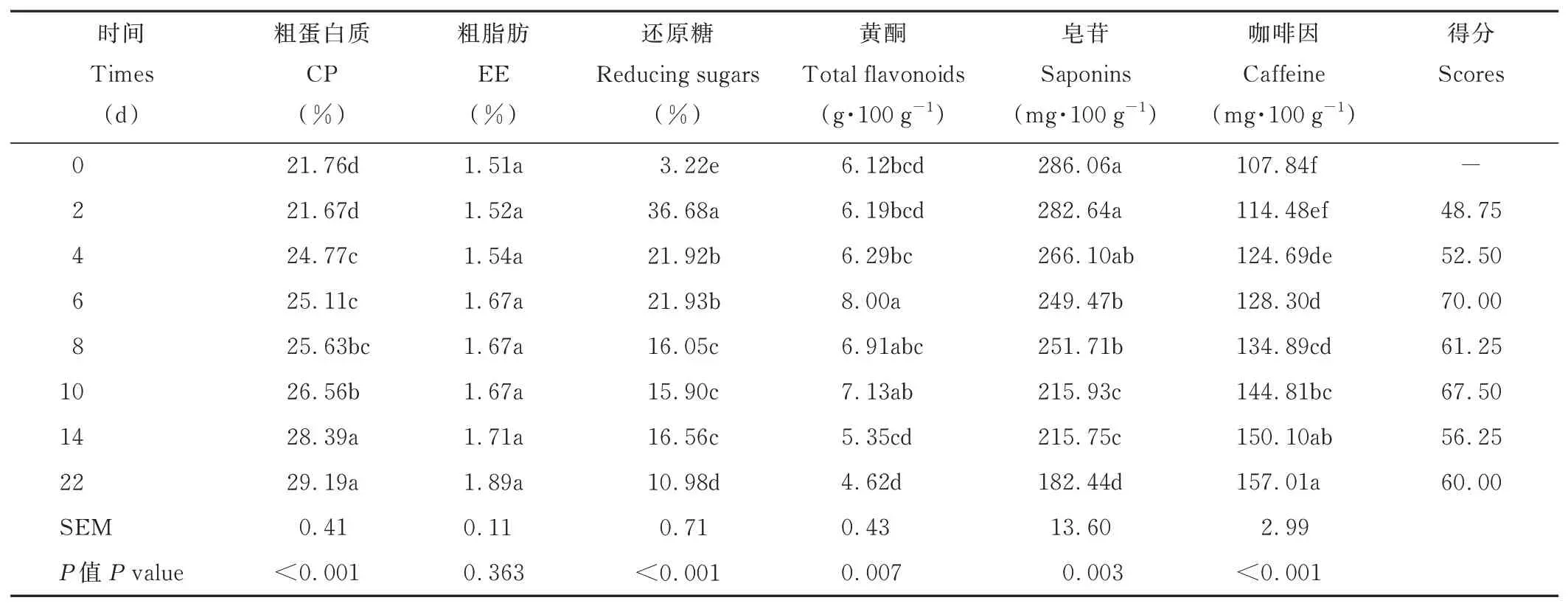
表7 时间对发酵茶渣的影响Table 7 Effects of time on fermented tea dregs(DM basis)
2.6 正交试验极差分析
通过极差分析法,比较表8 中极差(R)大小可知,对CP 含量影响因素大小排序为:发酵温度(B)、发酵时间(D)、基质比例(A)、接种量(C)。根据Ki值的大小判断最优水平,得到各因素对CP 含量的最优组合为A1B2C1D3。同理,对EE 含量影响因素大小排序为:A、C、B、D,EE 含量最优的组合为A3B1C1D3。还原糖、黄酮、皂苷、咖啡因的最优组合分别为A2B2C1D2、A3B1C2D3、A2B2C1D1、A1B1C1D1。根据综合得分最优组合A1B2C1D3,茶渣发酵最优方案为A1B2C1D3,即基质比例为7.0∶2.5,发酵温度为31 ℃,接种量为7%,发酵时间为7 d。
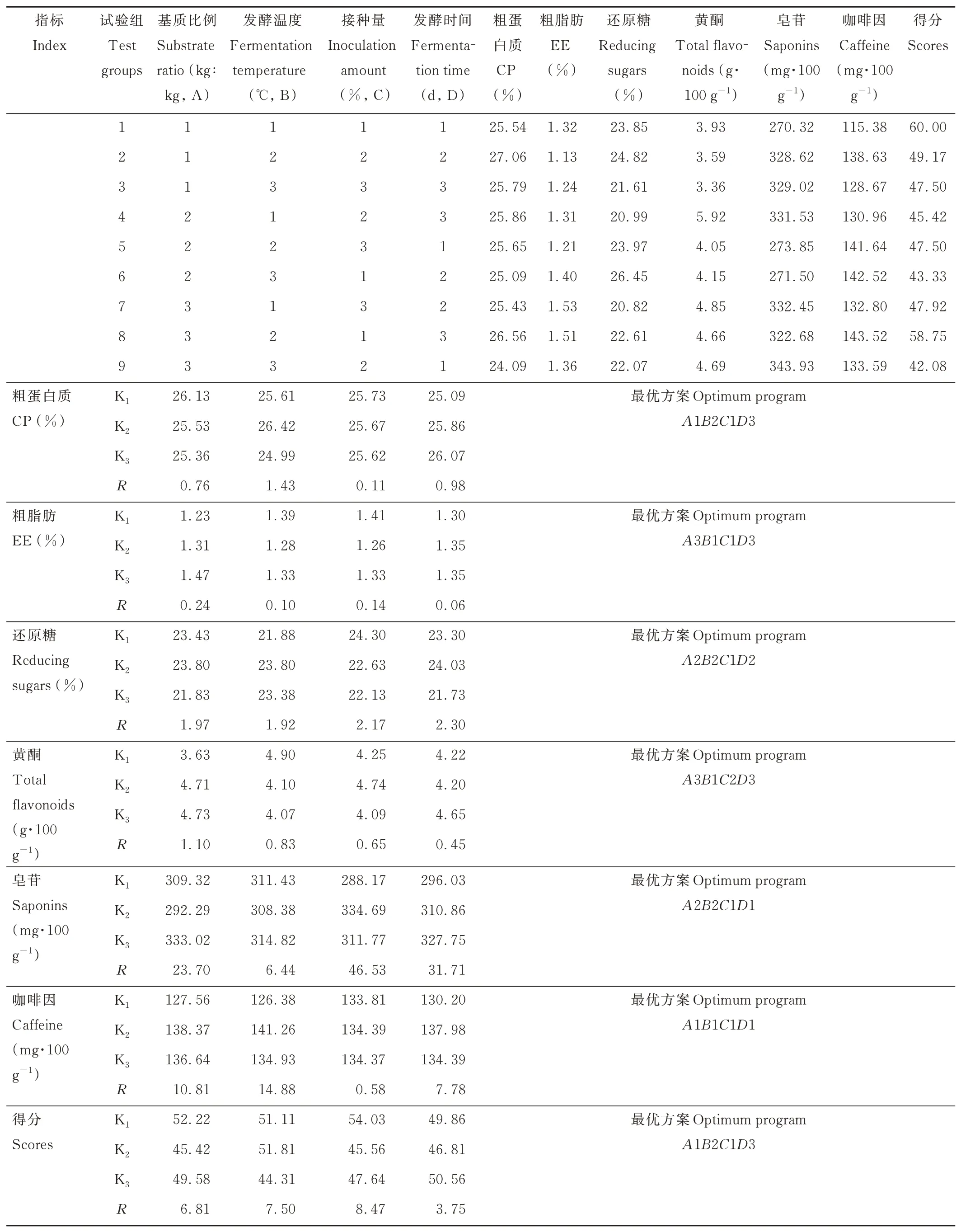
表8 正交试验极差分析Table 8 Range analysis of orthogonal test
2.7 正交试验方差分析
由表9 可知,基质比例(A)、发酵温度(B)、发酵时间(D)显著影响发酵茶渣CP 含量,说明因素A、B、D是影响发酵茶渣CP 含量的主要因素。根据F值得到,对CP 含量影响因素大小排序为:B、D、A、C。由表10 可知,对因素A分析,A1 的CP 含量显著高于A2、A3,因此选择A1。同理,因素B选择B2,因素D选择D2、D3。因素A、B、D对CP 含量的最优组合为A1B2CiD2 或A1B2CiD3。
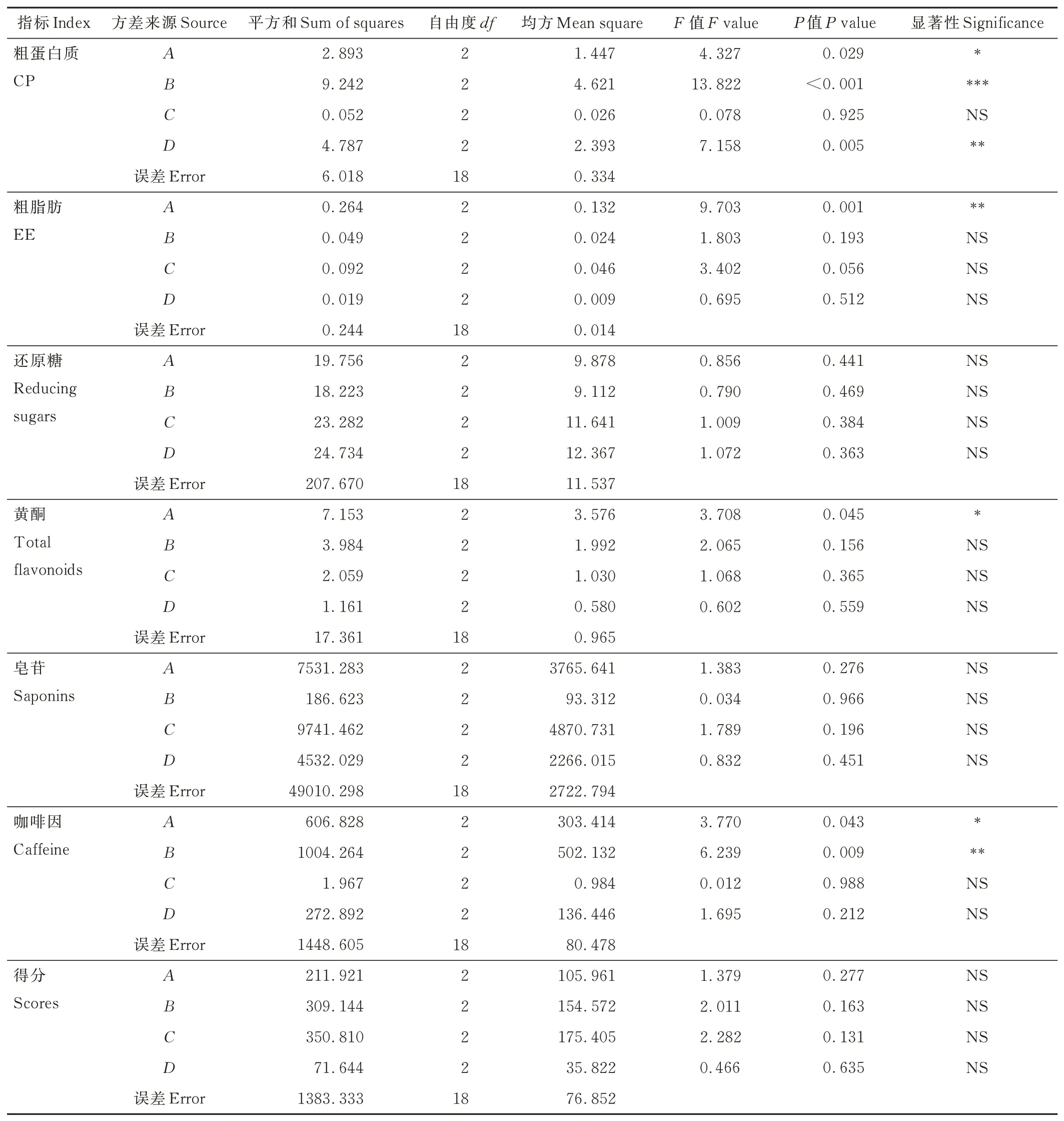
表9 正交试验方差分析Table 9 Analysis of variance of orthogonal test

表10 正交试验方差分析多重比较Table 10 Multiple comparison analysis of variance of orthogonal test
同理,因素A是影响EE、黄酮含量的主要因素,因素A、B是影响咖啡因含量的主要因素。对EE、黄酮、咖啡因含量的最优组合为A3BiCiDi、A2BiCiDi 或A3BiCiDi、A2B2CiDi 或A3B2CiDi。各 因 素 对 还 原糖、皂苷得分无显著影响。
上述组合中A1、A2、A3、B2、D2、D3 出现次数最多。根据成分重要程度,CP 含量最为重要,选择CP含量最优的组合A1B2CiD2 或A1B2CiD3 作为茶渣发酵最优方案。
2.8 验证试验
综合极差分析(A1B2C1D3)和方差分析(A1B2CiD2 或A1B2CiD3)结果,茶渣发酵的最优组合为A1B2C1D2 或A1B2C1D3。由于分析得到的最优组合不在表1 正交试验设计之内,因此对该组合进行了验证试验(表11)。测得发酵茶渣CP 和黄酮含量高于正交试验表最高CP 含量(27.06%)和黄酮含量(5.92 g·100 g-1),咖啡因低于正交试验表最低咖啡因含量(115.38 mg·100 g-1),EE 含量与正交试验表最高EE 含量(1.53%)接近,还原糖和皂苷含量在正交试验表的范围内。
由表11 可知,与未发酵茶渣相比,发酵茶渣A1B2C1D2 和A1B2C1D3 的CP、还原糖、黄酮、咖啡因含量均显著提高(P<0.001),皂苷含量显著降低(P<0.001),EE 含量与未发酵茶渣无显著差异(P>0.05)。发酵茶渣A1B2C1D2 和A1B2C1D3 的营养成分和活性物质含量无显著差异(P>0.05)。
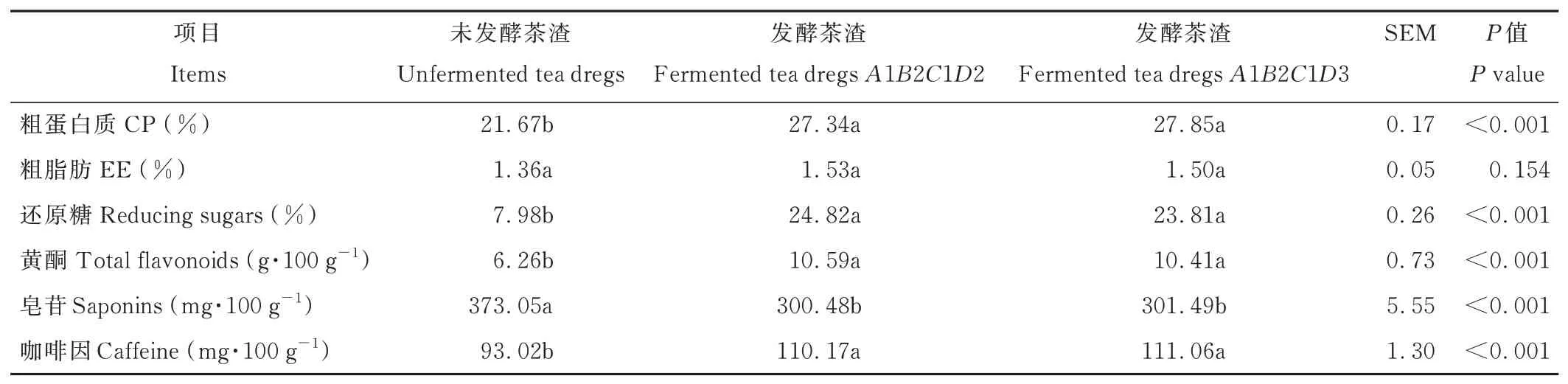
表11 发酵茶渣营养成分和活性物质Table 11 Nutrient components and active substance of fermented tea dregs(DM basis)
2.9 发酵对茶渣游离氨基酸的影响
由表12 可知,与未发酵茶渣相比,发酵茶渣(A1B2C1D2、A1B2C1D3)的异亮氨酸、亮氨酸、苏氨酸、赖氨酸、精氨酸、牛磺酸、丝氨酸、磷酸丝氨酸、天冬酰胺、谷氨酸、丙氨酸、酪氨酸、γ-氨基正丁酸、必需氨基酸、非必需氨基酸、总氨基酸、风味氨基酸的含量以及必需氨基酸/总氨基酸、风味氨基酸/总氨基酸显著提高(P<0.05 或P<0.001),氨含量和非必需氨基酸/总氨基酸显著降低(P<0.05 或P<0.001)。发酵茶渣(A1B2C1D2、A1B2C1D3)生成了苯丙氨酸、谷氨酰胺、β-丙氨酸、半胱氨酸、胱硫醚、鸟氨酸。与A1B2C1D2 发酵茶渣相比,A1B2C1D3 发酵茶渣的苏氨酸、牛磺酸、丝氨酸、磷酸丝氨酸含量显著降低(P<0.05 或P<0.001),赖氨酸、精氨酸、天冬氨酸含量显著提高(P<0.05 或P<0.001),两种发酵茶渣的其他氨基酸含量差异不显著(P>0.05)。
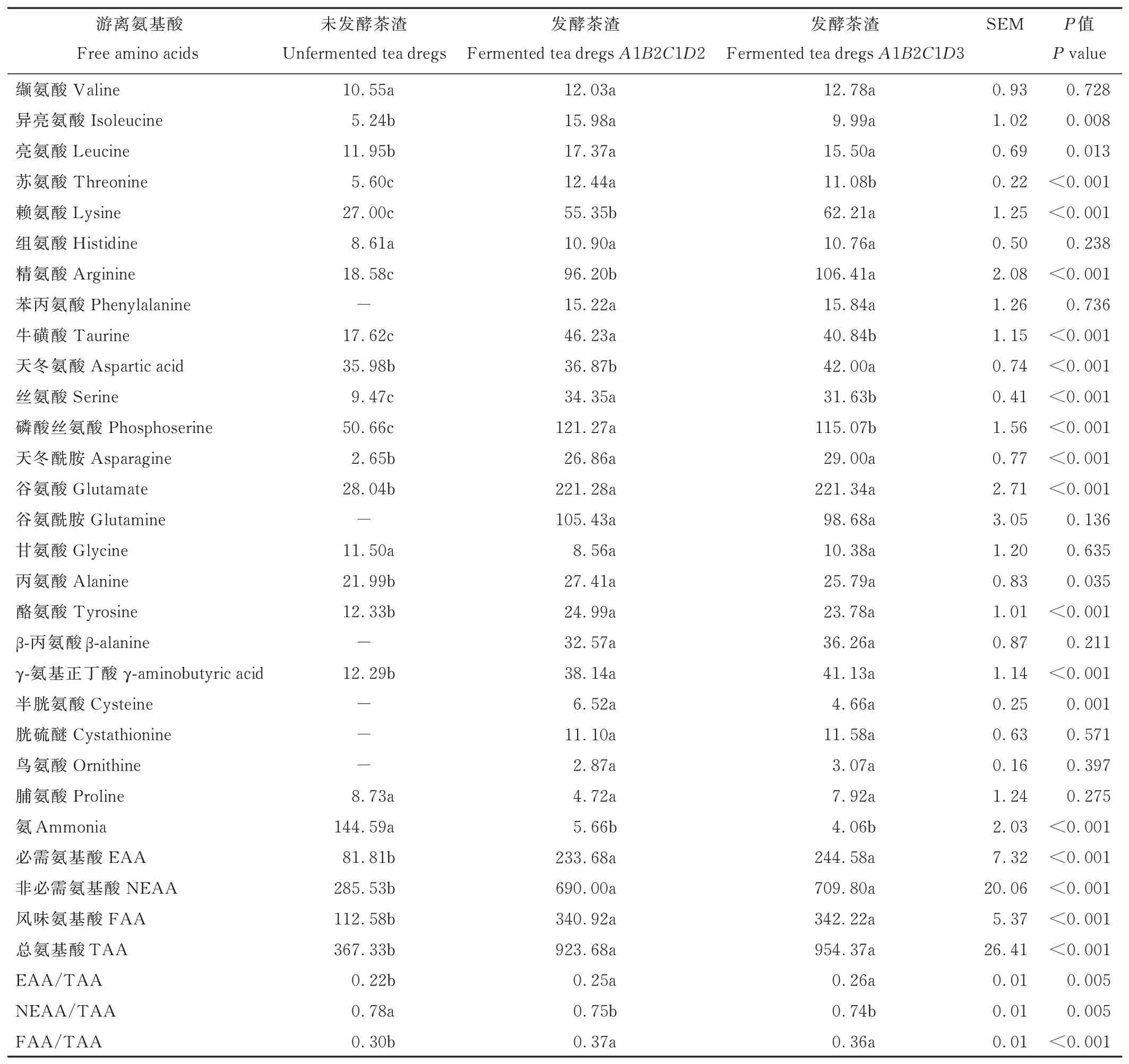
表12 发酵茶渣游离氨基酸Table 12 Free amino acids of fermented tea dregs(DM basis,mg·100 g-1)
3 讨论
3.1 基质比例对发酵茶渣的影响
不同的基质比例影响着微生物的代谢活动。通过正交试验得知,基质比例是影响发酵茶渣CP、EE、黄酮、咖啡因含量的主要因素。随着茶渣含量的增加,发酵茶渣的CP、皂苷、咖啡因含量增加,而还原糖含量降低。这是符合猜测的,茶渣的CP、皂苷、咖啡因含量较高,当茶渣添加比例增加,这些成分的含量也随之增加。还原糖含量降低主要是由于玉米粉添加比例的降低造成的。研究发现,发酵底物含糖量和生物质产量呈正相关[25]。玉米粉经过高温高压后,可产生大量还原糖。玉米粉添加量减少,发酵底物的还原糖含量随之减少。即玉米粉含量较高的发酵底物能够为康宁木霉提供更多的能量,有利于菌体生长。在相同条件下,孢子萌发生长需要消耗的还原糖含量相似,那么底物固有还原糖含量高,在被微生物消耗后余下的还原糖含量则高。另外,还原糖也来源于纤维素的降解。菌体代谢强,纤维素酶活性高,则产生的还原糖含量高。黄酮存在于茶渣中,在玉米粉中未检测到。猜测随着茶渣添加量的增加,黄酮含量应当提高,单因素试验结果表明基质比例对发酵茶渣的黄酮含量无显著影响。但是正交试验方差分析表明,基质比例是影响黄酮含量的主要因素,7∶3 与7.0∶3.5 的黄酮含量显著高于7.0∶2.5。这可能与康宁木霉对黄酮的代谢转化有关,目前缺乏相关研究。单因素试验中基质比为7∶3 的发酵茶渣综合评分最高,即以较少的玉米粉配合茶渣发酵,生产含量较高的CP 和还原糖以及含量较少的皂苷和咖啡因的发酵产物。
3.2 料液比对发酵茶渣的影响
水分对微生物生长、生物合成和代谢产物的产生及分泌具有重大影响[26]。据报道,在水分增加或减少的情况下,酶的产生会受到不利影响[27]。随着水分含量的增加,还原糖含量显著降低,这可能由于高水分导致纤维素酶产生减少,对纤维素降解能力减弱,导致还原糖的减少。另外,水分含量高会改变底物颗粒的结构,减少气体体积,减缓微生物生长[28]。康宁木霉是好氧菌,发酵基质水分高,则溶氧量较低,菌丝集中生长在发酵基质表面,内部菌丝较少或活力较弱,对纤维素降解不足,产生的还原糖含量则较低。料液比为7∶3 时,还原糖含量最高,而EE 含量是最低的,还原糖与EE 趋势是相反的,这也说明了微生物代谢产生不同代谢物的适合条件是不同的。EE 的成分不是单一的,脂肪、色素、脂溶性物质的合成代谢是十分复杂的,可考虑研究脂肪酸的组成、脂溶性物质的含量来探讨EE 的变化。结果表明,低水分有利于皂苷和咖啡因的降解,这可能与菌体生长速度较快和还原糖的大量生成有关。料液比为5∶5 的发酵茶渣综合评分最高,与以往研究一致,即霉菌的生长繁殖所需的水分含量为40%~50%[29]。
3.3 接种量对发酵茶渣的影响
接种量可能会明显影响发酵过程中的微生物生长速率[30]。较高的接种量可能会加快真菌的生长速度,但同时会增加营养物质的消耗速度[31],营养物质耗尽会减缓真菌的生长。接种量较小,延长了发酵过程所需的时间。在单因素和正交试验中,不同接种量对发酵茶渣CP、EE、皂苷和咖啡因含量无显著影响。可能由于接种量均处于一个较合适的范围导致本试验中接种量对这些指标无显著影响。8 d 的生长,所有培养基中康宁木霉均达到了最大生物量,对茶渣的代谢转化达到最高值。接种量为8%和10%的茶渣还原糖含量显著高于其他接种量,可能是由于孢子初始数量较高,加快了康宁木霉的生长和代谢,还原糖是生命活动中末端代谢物,初始阶段还原糖生成较多。二者没有差异主要是孢子数已达到了能转化利用的最大值,在底物一致的情况下,生长代谢强度不能继续增加。结果表明,接种量为6%和10%的发酵茶渣黄酮含量较低,暂未能解释不同接种量对黄酮含量的影响,可能是随机效应。
3.4 温度对发酵茶渣的影响
温度对微生物代谢有重要影响,温度过高过低均会抑制微生物的生长和代谢。发酵温度一般为25~32 ℃,与微生物的生长动力学密切相关[32]。康宁木霉的最佳生长温度是25~30 ℃,但是康宁木霉对外界条件的适应性相对较广,生长温度范围较广[33]。不同温度对真菌代谢物的生成或转化有重要影响,与最佳生长温度不一定一致。发酵温度为25~31 ℃时,CP 产量显著增加。正交试验中,发酵温度是影响发酵茶渣CP 含量的主要因素,31 ℃的CP 含量显著高于29、33 ℃的。这些结果表明,康宁木霉在31 ℃下能够提高茶渣CP 含量。康宁木霉发酵茶渣在25 和31 ℃能产生较高含量的还原糖。还原糖的含量是还原糖的产生和消耗的差值,除了纤维素的降解外,菌体生长旺盛也会产生和消耗还原糖[34]。在25 ℃,菌体生长慢,消耗的还原糖较产生的少,则还原糖含量高。31 ℃菌体生长快,产生和消化还原糖均较多,有可能其差值与25 ℃的还原糖含量一致,具体机制需要更深入的研究才能解释。25 ℃的黄酮含量最高,表明康宁木霉在较低温度时累积黄酮。也有可能是,在较高的温度条件下,菌体代谢加快,对茶渣黄酮的利用加强,黄酮被消耗,因此其他温度的黄酮含量较低。这需要更多的研究来验证这些猜测。康宁木霉在34 ℃降解皂苷的效果最佳,可能是降解皂苷的酶系在34 ℃时活力最高。咖啡因含量在31 和34 ℃时含量较高,说明康宁木霉在31~34 ℃时适合累积咖啡因。正交试验表明,发酵温度是影响发酵茶渣咖啡因含量的主要因素,31 ℃时咖啡因含量显著高于29 ℃。咖啡因工业可考虑通过优化条件对茶渣资源再利用生产咖啡因。温度过高或过低对康宁木霉的生命活动或产生一定的胁迫作用,对营养成分、功能成分的累积、合成效率有不同的效果。
3.5 时间对发酵茶渣的影响
发酵时间是影响茶渣营养价值的因素之一。康宁木霉发酵茶渣CP 含量随时间增加而增加,这与朱飞等[35]的研究结果一致,黑曲霉发酵茶渣CP 含量随时间的延长而提高。这可能是由于茶渣中菌体蛋白的不断累积所致。EE 不受发酵时间影响,可能是康宁木霉对茶渣中的EE 利用较少,也有可能是康宁木霉代谢与合成的EE 成分相互抵消,如康宁木霉的绿色孢子,色素可溶于乙醚。还原糖是许多生物过程和酶反应的最终产物,真菌代谢产生的纤维素酶可以催化纤维素转化为还原糖[36-37]。还原糖在第2 天达到最高值,与以往研究一致[34]。这是康宁木霉进入快速增长期,菌体生长迅速,代谢活性高的表现。菌体生长分泌各种淀粉酶、糖化酶将淀粉分解为低分子的还原糖,则还原糖含量提高。虽然,还原糖含量随时间延长较第2 天下降,但依然高于未发酵的茶渣。这与绿色木霉发酵甘草(Glycyrrhiza uralensis)药渣的还原糖含量先升后降的情况一致[38]。这说明,真菌发酵茶渣能产生大量的还原糖,为菌体的生长提供营养的同时,还改善了发酵茶渣的风味。黄酮含量在第6 天最高,此后下降。这说明菌体对黄酮的转化达最高值,随着康宁木霉的生长,黄酮又被吸收代谢。有研究表明,黑曲霉和绿色木霉发酵降低了桑叶茶黄酮含量[39]。随时间延迟,康宁木霉对黄酮的消耗高于产生速度,表现为发酵6 d 后,随时间延迟,黄酮含量降低。黄酮具有很强的抗氧化能力,这是改善动物肠道和免疫功能的主要特性之一[40-41]。微生物代谢降解抗营养因子被认为是最有前途的处理方法。高水平的皂苷会降低动物对营养的吸收,限制茶渣在饲料中的使用[42]。结果表明,随着时间的延长,茶渣皂苷含量降低。以往有研究表明,真菌能降解皂苷[43]。但未有文献表明康宁木霉能降解皂苷,暂不清楚降解机理。咖啡因是茶叶中含量最丰富的生物碱[5],其含量的提高降低了茶渣对动物的适口性。然而,适量的咖啡因具有抗氧化、抗糖尿病和减肥的作用[44]。结果表明,发酵茶渣的咖啡因含量随时间增加而提高。咖啡因作为一种中枢神经系统的兴奋剂[5],适量使用发酵茶渣可以刺激动物的中枢神经系统,促进血液循环。单因素试验中发酵6 d 的综合评分最高,可见茶渣发酵6 d 即可使用,同时6~10 d的评分接近,说明发酵茶渣在一定时间保存,营养价值不会降低。正交试验中,发酵6 和7 d 的CP 含量差异不显著,均显著高于发酵5 d。在实际生产中,选择发酵6 d 能减少生产成本,加快饲料的生产和应用。
3.6 发酵对茶渣营养成分和活性物质的影响
发酵后的茶渣CP 含量较高,原因可能是康宁木霉利用发酵基质的营养成分来合成菌体蛋白质,继而增加了CP 含量。与以往研究一致,即黑曲霉发酵能够提高茶渣的CP 含量[35]。CP 含量的提高,表明了茶渣经过微生物发酵可以作为动物饲料,这有利于推进废弃物饲料化利用的研究。还原糖含量的提高主要与康宁木霉的代谢有关,菌体生长产生各种酶将淀粉、纤维素等分解为还原糖[36-37]。还原糖具有甜味,能改善发酵茶渣的适口性。还原糖作为小分子物质,容易被动物消化吸收。还原糖含量的增高主要来源于纤维素的降解,从这个角度来说,发酵茶渣能被动物较好地消化利用。康宁木霉增加了茶渣的黄酮含量,与以往研究结果不一致。黑曲霉和绿色木霉发酵降低了桑叶茶黄酮含量[39]。这归因于康宁木霉与黑曲霉、绿色木霉酶系的不同、对营养物质代谢途径的不同。发酵茶渣黄酮含量提高,有利于增加饲料的抗氧化能力,增强动物氧化应激的抵抗力[40-41]。真菌能降解皂苷[43],本试验结果与此一致。皂苷含量的降低,有利于减少抗营养因子对动物生长的负面作用,可改善发酵茶渣的适口性。EE 含量与未发酵茶渣无显著差异,可能是康宁木霉利用与生产EE 达到平衡状态。
3.7 发酵对茶渣游离氨基酸的影响
游离氨基酸在蛋白质、脂肪和脂肪酸代谢、机体生长、免疫系统中起重要作用。必需氨基酸的含量与种类能反映出饲料的营养价值[45]。发酵茶渣中含有8 种必需氨基酸。康宁木霉发酵显著提高了茶渣各种必需氨基酸和总氨基酸含量,即发酵有利于改善茶渣的营养价值。康宁木霉合成代谢中分泌多种蛋白酶,分解茶渣混合物中蛋白质,产生游离氨基酸。在康宁木霉的生长中,合成了苯丙氨酸、谷氨酰胺、β-丙氨酸、半胱氨酸、胱硫醚、鸟氨酸(未发酵茶渣中未检测到)。经过发酵,茶渣中氨含量显著降低,可以推测康宁木霉利用茶渣中的氨合成、转化为游离氨基酸或蛋白质。游离氨基酸是重要的呈味物质[46]。发酵提高了茶渣的风味氨基酸含量和比例,能改善茶渣适口性。牛磺酸具有抗氧化、促生长、免疫调节等功能[47],γ-氨基正丁酸能减轻畜禽热应激[48]。牛磺酸和γ-氨基正丁酸含量的提高,增强发酵茶渣作为动物饲料添加剂的功效。发酵6 或7 d 的部分氨基酸含量不同,这与发酵时间有关。不同时间下,微生物的新陈代谢有所不同,产生的游离氨基酸量则有差异。总之,康宁木霉发酵改善了茶渣的游离氨基酸含量和种类,是一种潜在的有价值的动物饲料。
4 结论
试验表明,康宁木霉发酵茶渣(料液比为5∶5)的最佳条件是:基质比例为7.0∶2.5,发酵温度为31 ℃,接种量为7%,发酵时间为6 或7 d。康宁木霉发酵改善了茶渣的营养成分、活性物质以及游离氨基酸含量。

