脂肪酶Novozym 435催化合成羟基酪醇油酸酯
齐焱熠,陈 邦,赵鹏涛,刘 梁,孟永宏
(1.陕西师范大学 西部果品资源高值利用教育部工程研究中心,西安 710119; 2.西北大学 化学与材料科学学院,西安 710127)
羟基酪醇化学名为3,4-二羟基苯乙醇,是一种多酚类化合物,为无色或浅黄色油状物,主要以酯化物的形式存在于油橄榄中。大量研究表明,羟基酪醇具有预防糖尿病[1]、防止神经紊乱[2]、减少低密度脂蛋白氧化[3-4]、抗炎[5-7]、抗癌[8-10]、抗肿瘤[11-13]、抗动脉粥样硬化[14-15]和抗氧化[16-18]等多种功能。但是,羟基酪醇的油溶性较差,限制了其在食品、医药和化妆品领域的应用。目前,将羟基酪醇修饰为酯类衍生物是一种有效的策略,不仅可显著提高其油溶性,而且可提高其生物利用度[19-20]。Bouallagui等[20]以羟基酪醇和醋酸为原料合成了羟基酪醇醋酸酯,并研究了其抗氧化性。Yu等[21]首次从植物中分离出天然的羟基酪醇丁酸酯。Burattini等[22]研究了羟基酪醇月桂酸酯对过氧化氢引起细胞氧化损伤的影响。油酸是一种单不饱和脂肪酸,对软化血管有一定作用。油橄榄中含有丰富的羟基酪醇,尤其是在橄榄油副产物中其含量较高。然而,橄榄油副产物一般被直接丢弃,不仅造成资源浪费,而且污染环境。目前对羟基酪醇油酸酯合成的研究较少。因此,本研究以羟基酪醇和油酸为底物,通过筛选脂肪酶和优化反应体系,合成了羟基酪醇油酸酯,为橄榄油副产物的高值化利用提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
羟基酪醇(99%),陕西嘉禾生物科技股份有限公司;油酸(98%)、磷酸(分析纯),天津市天力化学试剂有限公司;2-甲基-2-丁醇(99%),麦克林公司,甲醇(色谱纯),天津市科密欧化学试剂有限公司);脂肪酶,具体信息见表1。

表1 脂肪酶的具体信息
1.1.2 仪器与设备
THZ-C恒温振荡摇床,苏州培英实验设备有限公司;1260高效液相色谱仪,安捷伦科技有限公司;RVC2-18CDplus真空离心浓缩仪,上海般诺生物科技有限公司;高分辨率液质联用仪、400 MHz核磁共振仪,德国布鲁克公司。
1.2 试验方法
1.2.1 羟基酪醇油酸酯的制备
参照文献[20]采用脂肪酶催化酯化法合成羟基酪醇油酸酯,其反应式如图1所示。

图1 脂肪酶催化羟基酪醇的酯化反应式
称取500 mg羟基酪醇于锥形瓶中,按一定摩尔比加入油酸,再加入一定体积的2-甲基-2-丁醇溶剂,加入一定量的脂肪酶(以整个反应体系的质量计),在一定温度、200 r/min的摇床中反应一定时间。反应结束后,将反应液离心分离去除脂肪酶,再置于真空旋转浓缩仪除去溶剂,得到羟基酪醇油酸酯粗品。反应过程中,取样测定反应液中羟基酪醇的含量,按公式(1)计算羟基酪醇转化率(Y)。
Y=(C0-C1)/C0×100%
(1)
式中:C0、C1分别为反应体系中反应前和反应后羟基酪醇的含量,mg/L。
1.2.2 羟基酪醇油酸酯的纯化
将羟基酪醇油酸酯粗品依次用2倍体积的饱和碳酸氢钠溶液和去除二氧化碳的纯水分别洗涤3次,除去过量的油酸、未反应的羟基酪醇和盐溶液,得到高纯度的羟基酪醇油酸酯。
1.2.3 羟基酪醇含量的测定
采用高效液相色谱法(HPLC)测定。HPLC条件[23]:Agilent 5 TC-C18(2)色谱柱(5 μm,250 mm×4.6 mm);流动相A为100%甲醇,流动相B为10%甲醇(磷酸调pH至3.0);梯度洗脱程序为0~10 min 10% A,10~40 min 30% A,40~50 min 40% A,50~55 min 50% A,55~65 min 100% A,65~75 min 10% A;检测波长280 nm;柱温35℃;流速1 mL/min;进样量5 μL。
首先配制一系列不同质量浓度的羟基酪醇标准溶液,进高效液相色谱仪进行分析,以羟基酪醇的质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。再将样品溶液进高效液相色谱仪进行分析,根据样品溶液中羟基酪醇的峰面积和标准曲线,计算样品溶液中羟基酪醇的含量。
1.2.4 质谱、核磁分析
将羟基酪醇油酸酯用色谱纯甲醇溶解,然后进行质谱分析。分析条件:阳离子模式,电喷雾离子源,毛细管电压4 000 V,质量扫描范围(m/z)100~1 100。
以氘代氯仿为溶剂,对羟基酪醇油酸酯进行溶解,然后进行1H NMR和13C NMR分析,分析时采用400 MHz扫描。
2 结果与讨论
2.1 羟基酪醇油酸酯制备的单因素试验
2.1.1 脂肪酶的选择
脂肪酶是催化甘油三酯进行水解和重新酯化的一类生物酶,不同来源的脂肪酶区域选择性不同,催化效率也不同。在醇酸摩尔比1∶2(羟基酪醇500 mg,油酸质量1.832 g)、脂肪酶添加量2%、2-甲基-2-丁醇用量2 mL、反应温度分别为37℃和50℃条件下,考察5种不同脂肪酶(Novozym 435、Lipozyme TL IM、Novozym 40086、LS-20和PPL)对羟基酪醇酯化反应的影响,结果见图2。
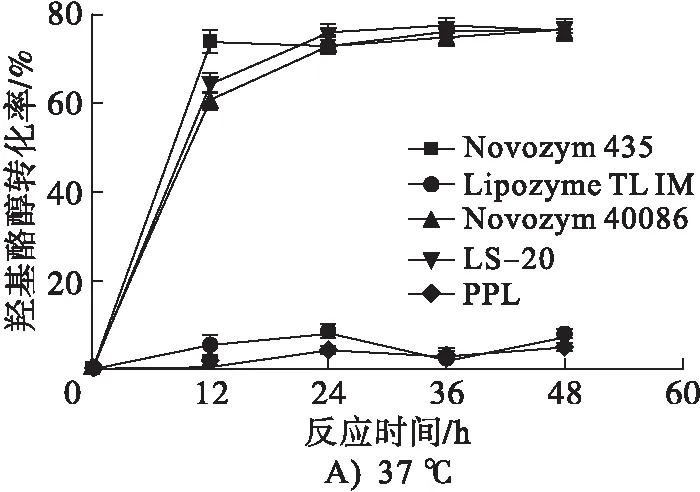
图2 不同脂肪酶对羟基酪醇酯化反应的影响
从图2可以看出,Novozym 435和LS-20在37℃和50℃时均表现出较高的催化活性,Lipozyme TL IM和PPL均表现出较低的催化活性,而Novozym 40086在37℃时表现出较高的催化活性,在50℃时则表现出较低的催化活性。在反应时间12 h条件下,对比了5种脂肪酶对羟基酪醇酯化反应的影响,结果见表2。

表2 反应12 h不同脂肪酶对羟基酪醇转化率的影响
由表2可见:在37℃时Novozym 435催化效率最高,羟基酪醇转化率达到78.32%;在50℃时LS-20 催化效率最高,羟基酪醇转化率达到76.90%;当无脂肪酶作为催化剂时,羟基酪醇转化率为0,说明在该反应体系中无催化剂作用反应是很难进行的。Novozym 435在37℃和50℃反应12 h的羟基酪醇转化率变化很小,说明在本试验条件下温度对Novozym 435影响不大。综合考虑,在后续的试验中,选择Novozym 435在37℃条件下进行反应。
2.1.2 溶剂用量的影响
在醇酸摩尔比1∶2(羟基酪醇500 mg,油酸1.832 g)、脂肪酶添加量2%、反应温度37℃、反应时间12 h条件下,考察2-甲基-2-丁醇用量对羟基酪醇酯化反应的影响,结果见图3。
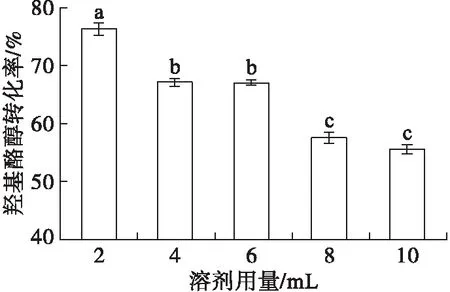
注:不同字母表示有显著性差异(p<0.05);下同
由图3可见,当溶剂用量从2 mL增加至10 mL时,羟基酪醇转化率逐渐降低,可能是因为溶剂过多会降低羟基酪醇和油酸的浓度,从而减少底物分子间的碰撞概率,导致羟基酪醇转化率下降。当溶剂用量为2 mL时,羟基酪醇转化率高达76.39%。试验发现,不加溶剂时,整个反应体系无法混匀,反应无法进行,这说明适量的溶剂有利于脂肪酶催化该反应体系。因此,选择2-甲基-2-丁醇用量为2 mL。
2.1.3 醇酸摩尔比的影响
在羟基酪醇500 mg、脂肪酶添加量2%、2-甲基-2-丁醇用量2 mL、反应温度37℃、反应时间12 h条件下,考察醇酸摩尔比对羟基酪醇酯化反应的影响,结果见图4。
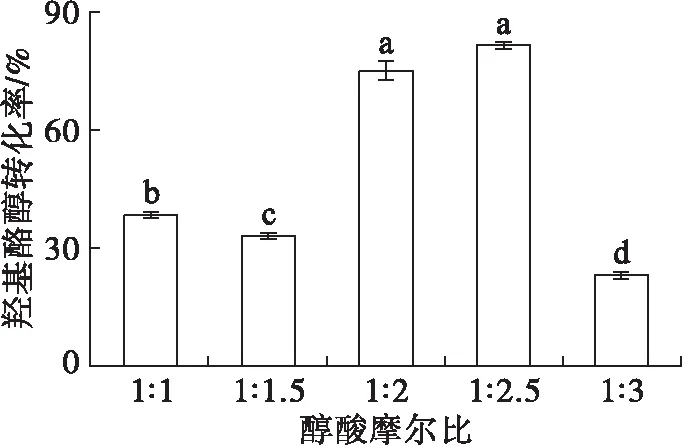
图4 醇酸摩尔比对羟基酪醇酯化反应的影响
由图4可见,在醇酸摩尔比为1∶1和1∶1.5时,羟基酪醇转化率分别为38%和35%左右,当醇酸摩尔比为1∶2.5时,羟基酪醇转化率高达81.39%,当醇酸摩尔比为1∶3时,羟基酪醇转化率降低。这是因为酯化反应是可逆反应,需要添加过量的脂肪酸使化学平衡向正方向进行,从而提高羟基酪醇转化率。但是,过高的油酸用量会减少羟基酪醇上的羟基与脂肪酶活性中心接触的机会。因此,选择醇酸摩尔比为1∶2.5。
2.1.4 脂肪酶添加量的影响
在醇酸摩尔比1∶2.5(羟基酪醇500 mg,油酸2.290 g)、2-甲基-2-丁醇用量2 mL、反应温度37℃、反应时间12 h条件下,考察脂肪酶添加量对羟基酪醇酯化反应的影响,结果见图5。
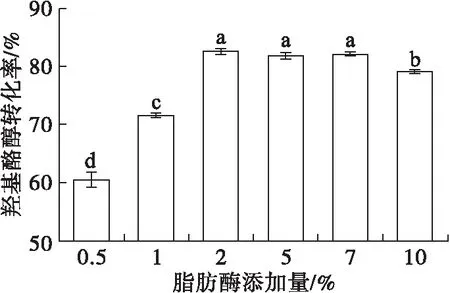
图5 脂肪酶添加量对羟基酪醇酯化反应的影响
由图5可见,在脂肪酶添加量为0.5%时,催化效率是最低的,羟基酪醇转化率仅有60.47%。随着脂肪酶添加量的增加,羟基酪醇转化率逐渐增加,在脂肪酶添加量为2%时达到最高,为83.15%,当脂肪酶添加量从2%增加至10%时,羟基酪醇转化率开始下降。脂肪酶添加量太少,酶活力不够,催化效率比较低;脂肪酶添加量过多,整个反应体系的黏度增大,脂肪酶活性位点与底物不能充分接触,导致羟基酪醇转化率降低。综合考虑,选择脂肪酶添加量为2%。
2.1.5 反应时间的影响
在醇酸摩尔比1∶2.5(羟基酪醇500 mg,油酸2.290 g)、脂肪酶添加量2%、2-甲基-2-丁醇用量2 mL、反应温度37℃条件下,考察反应时间对羟基酪醇酯化反应的影响,结果见图6。
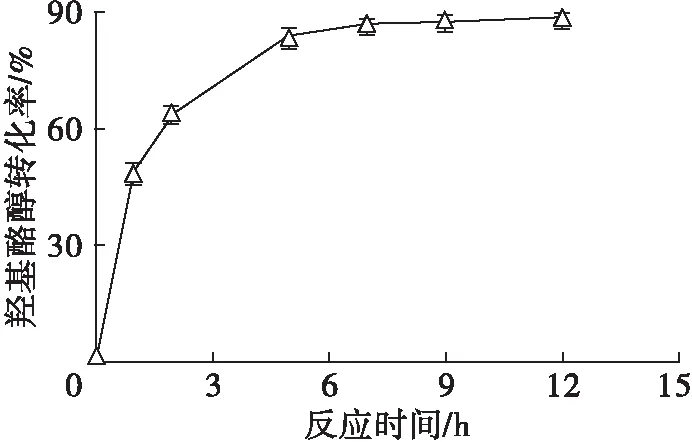
图6 反应时间对羟基酪醇酯化反应的影响
由图6可以看出,在反应时间0~5 h内,羟基酪醇转化率迅速升高,在反应时间7 h后变化较小。因此,选择反应时间为7 h。
2.2 羟基酪醇油酸酯制备的响应面试验
2.2.1 模型的建立与显著性检验
结合单因素试验结果,在Novozym 435为催化剂、反应温度37℃、反应时间7 h条件下,以醇酸摩尔比、溶剂用量、脂肪酶添加量为因素,以羟基酪醇转化率(Y)为考察指标,采用Box-Behnken试验设计,对羟基酪醇油酸酯的合成条件进行优化。Box-Behnken试验因素和水平见表3,Box-Behnken试验设计与结果见表4。

表3 Box-Behnken试验因素和水平
利用Design Expert软件,对表4中数据进行多元回归分析,获得二次多项回归方程:Y=82.75+28.14A+6.31B+4.89C+6.63AB+0.23AC-1.97BC-46.54A2-8.72B2-7.42C2。对回归模型进行方差分析,结果见表5。

表4 Box-Behnken试验设计与结果
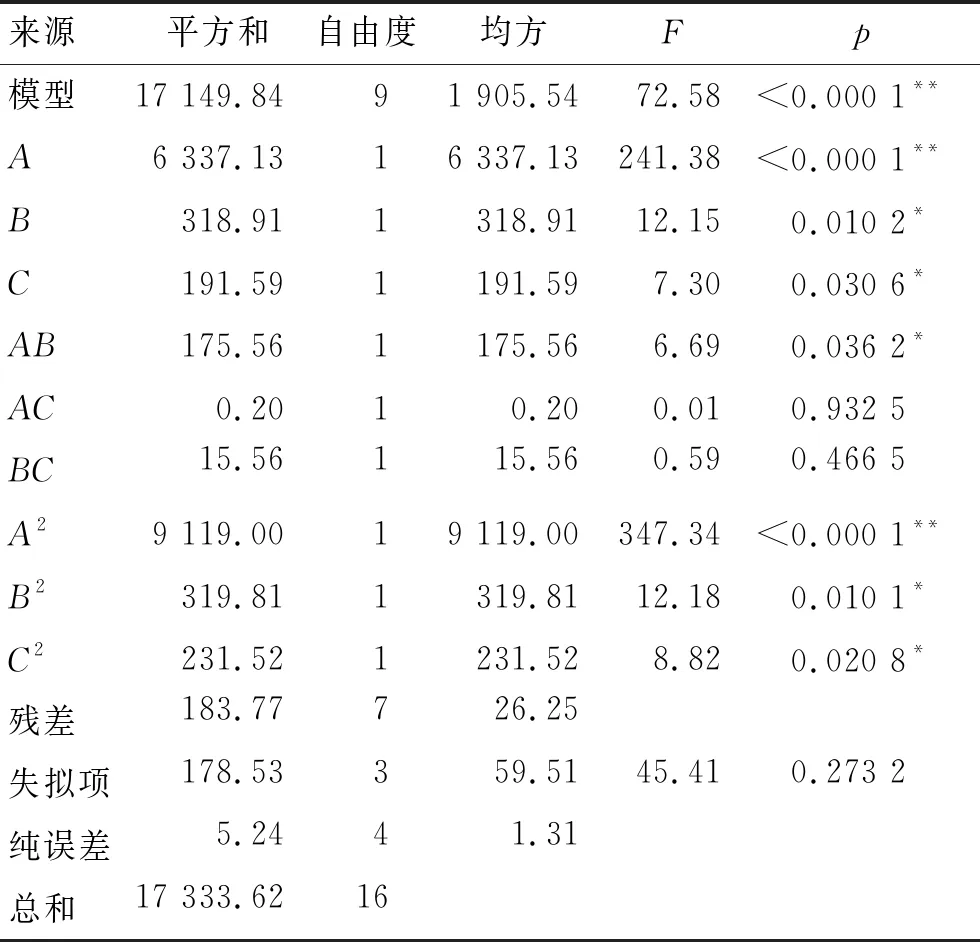
表5 方差分析

2.2.2 响应面分析
图7是通过二次回归模型拟合的各因素之间交互作用的响应面分析图。
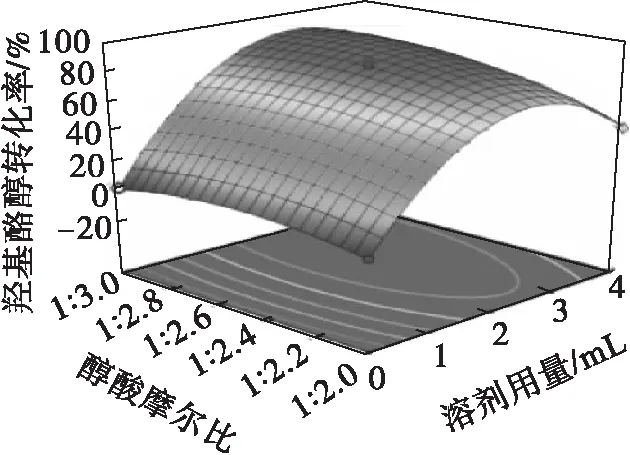
图7 各两因素交互影响羟基酪醇转化率的响应面图
响应面图的曲面越陡峭,两两因素的交互作用就越明显,相反,响应面图的曲面越平缓,两两因素的交互作用就越不显著。当等高线呈圆形时表示两因素交互作用不明显,而呈椭圆形或马鞍形时则表示两因素交互作用显著。由图7可知:各图均开口向下,凸形曲面,都存在极值;交互项AB(溶剂用量和醇酸摩尔比)影响显著(p<0.05),AC(溶剂用量和脂肪酶添加量)、BC(醇酸摩尔比和脂肪酶添加量)影响不显著(p>0.05);醇酸摩尔比对羟基酪醇转化率的影响小于溶剂用量,脂肪酶添加量对羟基酪醇转化率的影响小于溶剂用量、醇酸摩尔比,因此各因素对羟基酪醇转化率的影响大小依次为A(溶剂用量)>B(醇酸摩尔比)>C(脂肪酶添加量),该结果与方差分析结果相同,证明了模型可靠性高。
2.2.3 最佳工艺条件确定及验证试验
通过Box-Behnken试验设计可以得到理论最佳工艺条件为醇酸摩尔比1∶2.671、溶剂用量2.584 mL、脂肪酶添加量2.247%,此时羟基酪醇理论转化率为91.8%。结合实际操作的方便性,将最佳工艺条件修正为醇酸摩尔比1∶2.7(羟基酪醇500 mg,油酸2.474 g)、溶剂用量2.6 mL、脂肪酶添加量2.2%,在此条件下羟基酪醇实际转化率达到89.6%。
2.3 羟基酪醇油酸酯的纯化
按1.2.2方法对最佳条件下合成的羟基酪醇油酸酯粗品进行纯化。经测定,羟基酪醇油酸酯粗品中羟基酪醇含量为43.95 mg/mL,纯化后羟基酪醇含量仅为79.67 μg/mL,说明纯化产品中羟基酪醇含量可以忽略不计。
2.4 羟基酪醇油酸酯的表征
2.4.1 质谱分析
对纯化的羟基酪醇油酸酯进行质谱分析,得到羟基酪醇油酸酯的质谱图,见图8。

图8 羟基酪醇油酸酯的质谱图
由图8可知,羟基酪醇油酸酯m/z为439,与推测的产物一致,其分子式为C26H42O4。
2.4.2 核磁分析
对纯化的羟基酪醇油酸酯进行1H NMR和13C NMR分析。1H NMR(400 MHz,CDCl3)结果:δ6.76(1H,d,H-2′),δ6.67(1H,d,H-5′),δ6.59(1H,dd,H-1′),δ5.35(2H,m,H-9和H-10),δ4.20(2H,t,H-8′),δ2.78(2H,t,H-7′),δ2.29(2H,t,H-2),δ2.04(4H,m,H-8和H-11),δ1.54(2H,m,H-3),δ1.28(4H,m,H-7和H-12),δ1.23(14H,m,H-4~H-6和H-13~H-16),δ1.22(2H,m,H-17),δ0.94(3H,t,H-18)。13C NMR(101 MHz,CDCl3)结果:δ130.02、144.21、142.84、174.22(C,C-6′,C-4′,C-3′和C-1),δ129.89(CH,C-9/C-10),δ116.29、115.80、120.87(CH,C-5′,C-2′和C-1′),δ65.11(CH2,C-8′),δ34.43(CH2,C-7′),δ34.34(CH2,C-2),δ32.55(CH2,C-16),δ29.78(CH2,C-7/C-12),δ29.35~29.64(CH2,C-4~C-6/C-13~C-15),δ27.23(CH2,C-8/C-11),δ25.35(CH2,C-3),δ22.68(CH2,C-17)和δ14.10(CH3,C-18)。核磁分析结果说明,成功合成了羟基酪醇油酸酯。
3 结 论
本研究利用脂肪酶Novozym 435催化羟基酪醇与油酸酯化,通过响应面试验优化确定了合成羟基酪醇油酸酯的最佳工艺条件,在最佳条件下羟基酪醇转化率为89.6%。质谱和核磁分析表明,成功合成了羟基酪醇油酸酯。本研究为有效解决橄榄油加工过程中油橄榄果水、渣中羟基酪醇的高值利用,提供了坚实的技术支撑。

