板蓝根内生产纤维素酶细菌的分离鉴定
张 艳, 刘雪松, 薛沾枚, 郝敬友, 苏 景, 史同瑞
(1.黑龙江省农业科学院畜牧兽医分院,黑龙江齐齐哈尔 161005;2.哈尔滨绿达生动物药业有限公司,黑龙江哈尔滨 150039;3.黑龙江省动物疫病控制中心,黑龙江哈尔滨 150069)
为提高中草药药效,充分发挥其防治疾病的作用, 需要采用不同的方法对中草药材进行炮制处理。 提取是中草药炮制加工较为常用的方法,通过将中草药中的有效活性成分提取出来,不仅能够提高疗效、方便临床用药,而且还可以降低大量使用中草药而引起的毒副作用。中草药的传统提取方法有煎煮法、浸渍法、渗漉法、回流法等,这些方法虽然操作简单,但存在提取率低,容易破坏中草药中的有效成分,降低药物疗效等弊端(魏晓楠和郝铁成,2020)。 随着科学技术的发展,又研发了超临界流体萃取法、微波辅助萃取法、超声波提取法、酶工程提取法、半仿生提取法、超高压提取法等一些新兴的提取方法,并运用在中草药的提取生产中(薛峰等,2020;魏远等,2019;颜秀英,2018)。
中草药酶提取方法是基于生物酶解作用能够降解中草药的植物细胞壁, 从而使胞内的活性成分游离至介质中, 达到中草药活性成分高效提取的效果。生物酶中草药提取技术具有提取率高、无需特殊设备、成本低廉、安全绿色等独特优势。 应用高产酶微生物发酵中草药的酶提技术, 是现今中草药酶提领域的研究热点。 试验从板蓝根样品中分离筛选出1 株贝莱斯芽孢杆菌, 并测定了分离菌的生物学特性和产纤维素酶特性, 为其用于板蓝根的生物发酵提供理论依据。
1 材料与方法
1.1 试剂与药品 细菌总DNA 提取试剂盒、Ex Taq DNA 聚合酶、DL2000 DNA Marker,购自宝生物工程(大连)有限公司;板蓝根,购自购自河北凯达药业有限公司;生化反应管和药敏纸片,购自杭州天和微生物试剂有限公司;16S rRNA 引物,由生工生物工程(上海)股份有限公司合成。 试验所用其他常规试剂均为分析纯。
1.2 培养基 板蓝根琼脂:板蓝根粉100 g,葡萄糖20 g,琼脂15 g,牛肉汤1000 mL,pH 7.2;发酵培养基:羧甲基纤维素钠10 g,葡萄糖10 g,蛋白陈10 g,NaCl 5 g,KH2PO41 g, 蒸馏水1000 mL,pH 7.2;营养琼脂、营养肉汤和纤维素刚果红培养基,购自青岛海博生物技术有限公司。
1.3 试验仪器 电热恒温培养箱 (型号:DH4000II)、超净工作台(CJ-2S),购自天津市泰斯特仪器有限公司生;恒温培养摇床(型号:SPH-2102C),购自上海世平实验设备有限公司;立式压力灭菌器(型号:LDZX-75KBS),购自上海申安医疗器械厂;PCR 仪, 购自日本TaKaRa 公司;高速多功能中草药粉碎机(DFY-500),购自温岭市林大机械有限公司;PH 计(FE20),购自梅特勒-托利多仪器(上海)有限公司。
1.4 菌株分离与筛选 取新鲜板蓝根用水将表面冲洗干净, 再用无菌水浸泡2 ~3 h, 然后用75%乙醇漂洗30 s,无菌水漂洗1 min,2%次氯酸钠漂洗1 min,75%乙醇漂洗30 s,无菌水漂洗1 min,重复进行4 次; 取100 μL 最终清洗板蓝根的水涂营养琼脂,30 ℃培养2 d, 观察有无菌落的生长, 确认是否彻底消毒(高沙尔·卡依尔哈力等,2021)。 板蓝根样品干燥处理后剪碎,研磨,取0.1 g接种5 mL 营养肉汤,30 ℃、180 r/min 摇床培养16 ~18 h。 取培养液接种营养琼脂平板,置30 ℃环境培养18 ~24 h,取不同形态菌落接种营养琼脂纯化培养。 取纯化菌接种板蓝根琼脂和点种纤维素刚果红琼脂, 筛选既能在板蓝根琼脂生长又能在刚果红培养基形成较大透明圈的细菌。 测量透明圈直径(H)和菌落直径(C),计算H/C,初步对筛选菌的降解纤维素活力进行评价 (杨捷等,2012)。
1.5 筛选菌株的鉴定 应用细菌DNA 提取试剂盒提取细菌总DNA。采用细菌通用引物扩增16S rRNA, 上游引物:5'-GAGCGGATAACAATTTCACACAGG-3'; 下游引物:5'-CGCCAGGGTTTTCCCAGTCACGAC-3'。 PCR 反应体系: 总体积25 μL,其中Ex Taq 0.5 μL、10×Buffer 2.5 μL,模板1 μL,dNTPs 为0.5 μL,上下游引物各1 μL,ddH2O补足25 μL。 扩增条件:94 ℃4 min,94 ℃30 s,55 ℃40 s,72 ℃2 min,35 个循环,72 ℃10 min。反应结束后取3 μL 扩增产物进行琼脂糖凝胶检测, 反应产物送生工生物测序。 测序结果进行BLAST 比对,分析同源性,构建进化树。
1.6 筛选菌株生物学特性试验
1.6.1 形态及生化试验 取在37 ℃环境培养16、24、48 h 和72 h 的菌株菌液,涂片,革兰氏染色,镜检观察细菌形态。取筛选菌分别接种营养肉汤和营养琼脂,分别置37 ℃自然和5% CO2厌氧环境培养,考察菌株对氧的需求。 取培养18 ~20 h的菌液接种生化反应管,37 ℃培养观察细菌生化反应特性。
1.6.2 适宜生长温度测定 取筛选菌于37 ℃环境130 r/min 振荡培养18 h 的培养液, 应用无菌生理盐水调整菌液浓度为1.0×106cfu/mL,然后接种营养肉汤,分别置10、20、30、35、40、45、50、60、70 ℃环境130 r/min 振荡培养。 分别在培养18、24 h 和42 h 取样,以无菌肉汤作对照,测定各菌液的OD600值。以培养温度(℃)为横轴,OD600值为纵轴,绘制菌液含菌量曲线图。 试验设3 个重复。
1.6.3 适宜生长酸碱度测定 取菌液浓度为1.0×106cfu/mL 的菌液,分别接种pH 2、3、4、5、6、7、8、9 的营养肉汤,37 ℃、130 r/min 振荡培养。 在培养至18、24 h 和42 h 取样, 以无菌肉汤作对照,测定各菌液OD600值。 以pH 为横轴,OD600为纵轴,绘制菌液含菌量曲线图。 试验设3 个重复。
1.6.4 生长曲线绘制 取菌液浓度为1.0×106cfu/mL 的菌液,接种营养肉汤,于37 ℃、130 r/min振荡培养。 在培养4、8、12、16、20、24、30、36、42、48、56、68、80 h 和92 h 取样,以无菌肉汤作对照,测定各菌液的OD600值。 以培养时间(h)为横轴,OD600值为纵轴,绘制细菌生长曲线。 试验设3 个重复。
1.6.5 芽孢形成情况 取培养16、20、24、36、48、64、72 h 的菌液,分别用无菌生理盐水进行10 倍倍比稀释。分别取108、109和1010三个稀释度的菌液0.1 mL,涂营养琼脂平板,进行细菌计数。 剩余稀释菌液置80 ℃水浴作用10 ~15 min, 然后吸取0.1 mL 水浴后菌液,涂营养琼脂平板,计算芽孢形成率。
芽孢形成率/%=(形成芽孢的菌数/总菌数)×100。
1.6.6 药物敏感性试验 应用K-B 法测定分离菌株的药物敏感性。 取筛选菌株接种营养肉汤,37 ℃培养18 ~20 h,用无菌营养肉汤调整菌液至0.5 号麦氏标准管浊度, 然后涂布营养琼脂平板,待菌液被琼脂吸收后粘贴药敏片, 置37 ℃培养18 h,测量抑菌圈直径(R)。 试验重复3 次。
1.7 菌株产纤维素酶能力测定
1.7.1 绘制葡萄糖标准曲线 参考赖国栋等(2021)的方法进行试验。配制葡萄糖标准溶液:取葡萄糖在干燥箱中105 ℃烘干2 h 至恒重。 精确称取葡萄糖100 mg,加入100 mL 容量瓶中,用少量蒸馏水溶解后,定容至刻度,摇匀。 葡萄糖溶液浓度为1 mg/mL,于4 ℃保存冷藏,使用期2 ~3 d。绘制葡萄糖标准曲线:取16 支具塞试管,依次编号0 ~7,并作平行试验。 分别取1 mg/mL 标准葡萄 糖 溶 液0、0.2、0.4、0.6、0.8、1.0、1.2 mL 和1.4 mL 依次加入各管中,然后再依次加入蒸馏水2.0、1.8、1.6、1.4、1.2、1.0、0.8 mL 和0.6 mL,混匀,使各管液量均为2.0 mL。然后各管分别加入DNS 试剂2 mL,混匀,置沸水浴中显色5 min,立即取出,流水冷却。 以0 号管作为参考调零, 测定各溶液OD490值。 以葡萄糖量(mg)为横轴,以OD490值为纵轴,绘制葡萄糖标准曲线。
1.7.2 产纤维素酶活力测定 参考王琳等(1998)的方法, 取活化菌液以1%接菌量接种液体发酵培养基,37 ℃、180 r/min 振荡培养18 ~24 h,将发酵液离心,收集上清即为粗酶液,置4 ℃保存备用。取3 支刻度试管,分别加入3 倍稀释的粗酶液1 mL, 将其中2 支试管沸水浴灭活20 min, 第3支试管于50 ℃水浴1 min。 然后3 支管中分别加入2 mL 已预热至50 ℃的0.5% CMC-Na 缓冲液(pH 4.6),混匀,于50 ℃水浴30 min,结束后各管立即加入3 mL DNS 试剂,混匀,置沸水浴中显色5 min 立即取出, 流水冷却, 用蒸馏水定容至10 mL,以对照调零于490 nm 处测OD 值。 依据绘制的标准曲线算出还原糖含量, 按照以下公式计算酶活力。 在上述试验条件下,以1 mL 酶液每分钟水解纤维素生成1 μg 葡萄糖的量为1 个酶活力单位(U)。

式中:X为纤维素酶酶活力,U/mL;m为吸光度在标准曲线上计算的葡萄糖量,mg;n为酶液稀释倍数;V为酶液体积,mL;t 为时间,min;5.56 为
1 mg 葡萄糖的μmoL 数(1000/180=5.56)。
1.7.3 产纤维素酶活力曲线绘制 在筛选菌株发酵培养18 ~72 h 期间,每隔6 h 取样1 次,按上述试验方法测定发酵液中纤维素酶酶活。 设3 个试验组和1 个对照组, 每组设3 个平行。 以时间(t)为横轴,以纤维素酶活力(X)为纵轴绘制曲线,即得筛选菌的产酶曲线。
1.8 纤维素酶特性测定
1.8.1 热稳定性 取刻度试管8 支, 各管分别加入酶液3 mL,其中7 支为试验管,1 支为对照管,每组设3 个平行。 试验管分别置20、30、40、50、60、70、80 ℃环境,对照管置室温,各管分别在各温度条件下作用1 h,测定相对酶活力。
1.8.2 酸碱稳定性 取刻度试管7 支, 各管分别加入粗酶液3 mL, 其中6 支为试验管,1 支为对照管。 调节各管粗酶液pH 至3.0、4.0、5.0、6.0、7.0和8.0,对照管不调节,30 ℃作用1 h,各管用柠檬酸-柠檬酸钠缓冲液补足9 mL,测定相对酶活力。
2 结果与分析
2.1 产纤维素酶细菌筛选 从分离菌株中筛选出1 株能在刚果红琼脂形成较大水解圈的细菌,筛选菌在刚果红培养基形成的降解圈直径为9.45 mm,菌落直径为2.28 mm,菌株H/C 为4.15,说明分离菌株降解纤维能力较强。
2.2 筛选菌株鉴定 筛选菌扩增产物经琼脂糖凝胶电泳分析,目的片段大小约600 bp(图1)。菌株测序结果显示, 扩增的序列长度为574 bp,与贝莱斯芽孢杆菌PFY02 和TL4 的同源性达到100%,筛选菌株鉴定为贝莱斯芽孢杆菌,与相似度高的典型菌株构建系统进化树, 并命名为贝莱斯芽孢杆菌NKY1 株(图2)。

图1 PCR 扩增结果

图2 菌株16S rRNA 基因系统进化树
2.3 筛选菌种的生物学特性
2.3.1 形态及生化试验特性 显微镜观察筛选菌菌体形态为革兰氏阳性、 粗大杆菌, 菌体两端钝圆,多为单在,菌株能够形成芽孢,芽孢椭圆形,直径小于菌体(图3)。 菌株能够发酵葡萄糖、蔗糖,不发酵乳糖、麦芽糖、果糖、木糖、覃糖、山梨醇、甘露醇和水杨苷,水解七叶苷,吲哚、H2S、V-P 试验阳性,M.R、尿素酶、枸橼酸盐试验阴性。
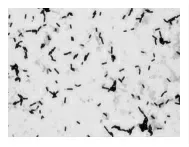
图3 筛选菌的菌体形态(1000×)
2.3.2 适宜生长温度测定 由图4 可知, 在环境温度10 ~40 ℃,随着温度的上升菌液的OD 值逐渐增大,至35 ℃达到峰值,各时间点的OD 值分别为0.150、0.153 和0.161,但与40 ℃比较OD 值差异不显著(P>0.05)。当培养温度大于40 ℃时,菌液OD 值逐渐降低,当温度达60 ℃时,各时间点菌液的OD 值均小于0.005。 试验表明,菌株在环境温度10 ~60 ℃内均能生长,但在30 ~40 ℃时生长良好, 其中35 ~40 ℃是菌株的最适生长温度。
2.3.3 适宜生长酸碱度测定 由图5 可知,在pH 5.0 ~8.0 内菌株生长良好,最适pH 约为6.0,各时间点菌液OD 值分别为0.837、0.995 和1.135;培养基pH 为3.0 ~4.0 时,各时间点菌液OD 值均低于0.05,不适宜菌株生长。 培养基pH 为9.0 时,各时间点菌液OD 值均为0,基本未见细菌生长。

图5 筛选菌的适宜生长酸碱度
2.3.4 生长曲线测定 结果如图6,菌株在初期培养的4 h 内为细菌生长的延迟期,OD 值小于0.3;在培养的5 ~12 h 细菌处于对数生长期,OD 值达1.201; 在培养的12 ~30 h 为生长稳定期,OD值始终保持1.2 左右;30 h 以后为生长衰亡期,OD 值持续下降。

图6 筛选菌生长曲线
2.3.5 芽孢形成情况 结果见图7, 培养至36 h开始产生芽孢,芽孢形成率达35.4%,随着培养时间的延长芽孢数量增多,72 h 时芽孢形成率为82.1%。

图7 筛选菌的芽孢形成情况
2.3.6 药物敏感性 由表1 可知, 所有受试药物中,菌株仅对林可霉素和红霉素耐药,对其余药物均敏感,表明细菌的药物敏感性好。

表1 筛选菌的药敏试验
2.4 筛选菌种产酶性质
2.4.1 产纤维素酶能力测定
2.4.1.1 葡萄糖标准曲线绘制 依据葡萄糖溶液测定结果得到回归方程y=0.8084x-0.0053 (R2=0.9993),葡萄糖标准曲线见图8。

图8 葡萄糖标准曲线
2.4.1.2 产纤维素酶曲线 由图9 可知, 培养至36 h 时筛选菌的纤维素酶活力达到最大值,为31.97 U/mL,此后纤维素酶活力呈轻微波动。
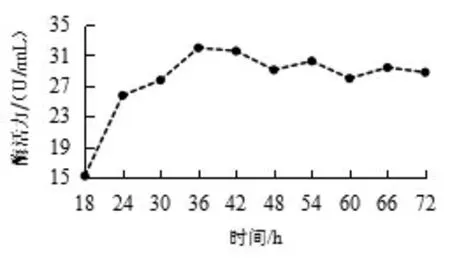
图9 产纤维素酶活力曲线
2.4.2 纤维素酶性质测定 热稳定性: 结果见图10,温度低于60 ℃时菌株的纤维素酶活力比较稳定,均高于90%;温度大于60 ℃时纤维素酶活力急剧下降, 达到80 ℃时, 纤维素酶活力低于40%。 酸碱稳定性:结果见图11,pH 7.0 时纤维素酶稳定性最好,pH 6.0 ~8.0 时纤维素酶相对稳定, 相对酶活力均保持在90%以上,pH 3.0 时纤维素酶稳定性急剧下降,相对酶活力仅约20%。

图10 菌株产纤维素酶热稳定性
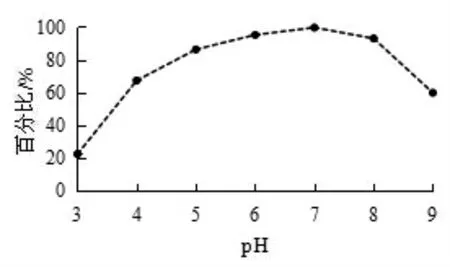
图11 菌株产纤维素酶酸碱稳定性
3 讨论
试验从板蓝根样品中分离出一株降解纤维素能力强,可在板蓝根培养基生长的细菌,经鉴定为贝莱斯芽孢杆菌,其耐药性差,稳定性好,可以作为发酵板蓝根的菌株。 生化结果显示,该菌株可以发酵葡萄糖和蔗糖,但是对其他糖、醇等均不发酵。 这与王帅等(2021)从土壤中分离的贝莱斯芽孢杆菌S-3 和缪伏荣等(2021)从茶叶渣中分离的贝莱斯芽孢杆菌Fb 的生化特性相近。 试验菌株的适宜培养温度和酸碱度结果显示,与陈龙等(2019)分离的高产内切纤维素酶贝莱斯芽孢杆菌和王金燕等(2018)分离的贝莱斯芽孢杆菌DY-6 的适宜温度和酸碱度相一致。 但同时本试验也与诸多关于贝莱斯芽孢杆菌的研究结果存在差异(孙会刚,2021;徐淑琴;2021;张小波,2020)。 原因可能与试验采用的培养基、摇床参数和细菌不同有关。
在试验所有受试药物中,分离的贝莱斯芽孢杆菌仅对林可霉素和红霉素耐药, 对其余药物均敏感。 张小波等(2020)从发病花边鸭肝脏组织中分离到一株贝莱斯芽孢杆菌, 分离菌对丁胺卡那、 哌拉西林、 四环素等三种药物中度敏感,对多黏菌素、氨苄西林、头孢他啶、苯唑西林、羧苄西林和青霉素等六种药物耐药,原因可能是细菌在动物体内经多次传代和动物生长过程中的抗生素添加导致的耐药基因变化造成的。
试验采用最常用的DNS 法测定细菌的产纤维素酶活力, 测得该菌株产纤维素酶活力为
31.97 U/mL。孙会刚等(2021)研究产酸性纤维素酶的贝莱斯芽孢杆菌的产纤维素酶活力为39.2 U/mL。 陈龙等(2019)研究的高产内切纤维素酶的贝莱斯芽孢杆菌的产纤维素酶活力为 (5.14±0.18)U/mL。 钟丽娟等(2021)分离的饲用贝莱斯芽孢杆菌产纤维素酶活性达65.63 U/mL。 产生纤维素酶活力差异的原因可能与培养条件和碳源、氮源等的不同有关。
4 结论
从板蓝根中分离到的内生细菌为贝莱斯芽孢杆菌,细菌的繁殖条件容易满足,具有良好产纤维素酶的能力,适宜作为中草药发酵菌种。

