不同分级指数燕麦干草对奶牛体外发酵营养物质降解率、瘤胃发酵参数和微生物组成的影响
陈雅坤, 刘 佳, 王思伟, 孟宪华, 王 昆, 张建勇, 杨丽萍, 沈旖帆, 赵连生
(1.中国农业科学院北京畜牧兽医研究所/动物营养学国家重点实验室,北京 100193;2.北京市兽药饲料监测中心,北京 102200;3.河北省农林科学院粮油作物研究所,河北石家庄 050035;4.河北省畜牧总站,河北石家庄 050035;5.宁夏回族自治区畜牧工作站,宁夏银川 750004;6.云南省饲草饲料工作站,云南昆明 650225)
燕麦草具有产量高、营养价值好、耐干旱、耐严寒等特性, 成为目前我国广泛推广的禾本科饲草(侯龙鱼等,2019)。但由于我国的燕麦草人工草地栽培体系不够成熟,燕麦草的质量参差不齐(解津刚等,2022;侯龙鱼等,2019)。 熊乙等(2018)研究了山西、 甘肃和澳洲等3 个产地的燕麦草营养价值发现, 不同产地燕麦草营养成分存在明显差异, 澳洲燕麦草中性洗涤纤维和酸性洗涤纤维较低,山西和甘肃燕麦草粗蛋白质含量较高。刘文婷等(2019)通过在全国燕麦主产区的11 个省研究环境因素和品质性质之间的相关性发现, 蛋白质含量与经纬度呈显著正相关, 淀粉和脂肪含量与经纬度呈负相关。
粗饲料分级指数(GI)是卢德勋结合我国饲草现状提出的饲草品质评价方法(红敏等,2011)。红敏等(2011)对GI 模型进行验证、对比发现,GI 与饲料相对价值(RFV)分级的准确性和顺序性较为一致,GI 能准确而科学地对粗饲料品质进行分级划分。 王艳菲等(2013)报道,GI 在评价饲草品质、筛选和优化饲草组合、 指导饲草科学种植等方面得到了广泛的应用。
燕麦草为反刍动物日粮中重要的粗饲料来源之一(解津刚等,2022)。 因此,掌握其在瘤胃消化吸收规律、 瘤胃微生物组成对提升其降解率具有重要作用。 Henderson 等(2015)研究发现,宿主和饲料是影响瘤胃微生物较大的因素, 其中饲料占主导地位。 Maga 等(2013)同样发现,反刍动物瘤胃微生物群落结构的大部分变异可归因于饲料的差异。本试验以成熟期燕麦干草作为研究对象,通过研究不同分级指数燕麦干草对奶牛营养物质降解率、瘤胃发酵参数和微生物组成的影响,了解其在瘤胃的降解规律, 为其在奶牛饲料配方中科学应用提供数据支撑。
1 材料与方法
1.1 试验材料 2022 年1 月,分别在甘肃省定西市、 河北省张家口市和内蒙古自治区锡林郭勒盟采集成熟期收割打捆的燕麦干草。 样品采集流程及方法参照《GB/T 14699-2005》(2005),每种饲草样品采集300 g 左右。 将采集的饲料65 ℃烘至恒重,回潮4 h 后粉碎,过40 目筛制成风干样品。参照《饲料分析与检验》(王加启和于建国,2004)进行常规营养成分测定。 参照《GB/T 23387-饲草营养品质评定GI 法》(2009)进行质量分级。 具体营养成分见表1。
1.2 试验设计 采用单因素设计, 试验分为3组,试验1 组、试验2 组和试验3 组底物是GI 值分别为4.26、10.98、11.60 MJ/d 的燕麦干草, 其等级分别是五级、三级、三级,每组设置10 个重复,体外发酵24 h。
1.3 动物供体与瘤胃液采集 在中国农业科学院北京畜牧兽医研究所昌平试验基地选取3 头健康且装有永久性瘤胃瘘管的泌乳期奶牛作为试验供体牛。 奶牛每天饲喂和挤奶2 次(07:00 和18:00),自由采食和饮水。 于晨饲后2 h 通过瘤胃瘘管采集3 头牛瘤胃液,混合后装入39 ℃预热处理的保温瓶中,密封后带回实验室,使用灭菌后的4层纱布过滤,同时通入CO2,整个过程于39 ℃水浴锅中进行。
1.4 体外发酵 参照Menke 等(1988)的方法配制缓冲液,将配制好的缓冲液持续通入CO2,使缓冲液由蓝色变为粉红色, 最后为无色, 并预热至39 ℃,备用。 准确称取0.5 g 饲料置于150 mL 厌氧发酵瓶中,接种前将发酵瓶预热39 ℃。 使用分装器迅速向每个发酵瓶中加入50 mL 缓冲液和25 mL 瘤胃液,并向每个瓶中通入CO25 s 后,立即用瓶塞密封,置于恒温培养振荡器(ZWT211,上海智城分析仪器制作公司)中,体外连续发酵24 h。
1.5 样品采集及前处理 在体外连续发酵24 h后,迅速将发酵瓶放入冰水浴中终止发酵,经尼龙袋过滤后,立即测定发酵液的pH,然后将一部分发酵液分装后于-20 ℃冰箱冷冻保存, 用于氨态氮、挥发性脂肪酸(VFA)的测定,另一部分取2 mL 发酵液放入液氮中速冻, 置于-80 ℃冰箱保存,用于微生物分析。将装有发酵残渣的尼龙袋清洗干净后,放入65 ℃烘箱中烘至恒重,用于干物质降解率(DMD)、粗蛋白质降解率(CPD)和中性洗涤纤维降解率(NDFD)的测定。
1.6 测定指标及方法
1.6.1 营养物质降解率测定 干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)测定参照《饲料分析与检验》(王加启和于建国,2004)中的方法进行,其中,CP 采用全自动凯氏定氮仪(K1100,山东海能科学仪器有限公司) 测定,NDF 采用全自动纤维分析仪 (Ankom A2000i Fiber Analyzer,美国ANKOM 公司)测定。 饲料中营养物质降解率计算公式如下:
降解率/%=[样品中营养物质含量(g)-降解后残渣中营养物质含量 (g)]/样品中营养物质含量(g)×100。
1.6.2 发酵指标测定 发酵液中pH 采用SartoriusPB-10 型pH 计测定;氨态氮(NH3-N)采用靛酚比色法(2011)测定;VFA 浓度利用气相色谱仪(Agilent 6890N GC system,Agilent)以外标法测定(王芳等,2016),色谱条件如下:以氮气为载气,色谱柱DB-FFAP (30 m×0.25 mm×0.25 μm), 柱温70 ℃,3 ℃/min 至125 ℃,再以30 ℃/min 至125 ℃,保持5 min, 进样口温度250 ℃, 检测器温度280 ℃,恒压25 kPa,分流比1:20,进样量20 μL。
1.6.3 瘤胃微生物组成测定 先用E.Z.N.A.Rsoil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)进行总DNA 抽提, 再用NanoDrop2000 测定DNA 浓度 和 纯 度; 使 用 引 物338F (5’ -ACTCCTACGGGAGGCAGCAG-3’) 和806R(5’-GGACTACHVGGGTWTCTAAT-3’) 对16S rRNA 基 因V3 ~V4 可变区进行PCR扩增, 将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA) 回收产物纯化,用QuantusTMFluorometer (Promega,USA) 对回收产物进行检测定量。 利用Illumina 公司的Miseq PE300/NovaSeq PE250 平台进行测序 (上海美吉生物医药科技有限公司)。
1.7 数据处理 对微生物测序结果先用fastp(Chen 等,2018)软件对原始数据进行质控,再用FLASH(Magoc∨等,2011)软件进行拼接,然后使用UPARSE(Edgar 等,2013)软件,根据97%( Edgar等,2013) 的相似度对序列进行OTU 聚类并剔除嵌合体,最后利用RDP classifier(Wang,2007)对每条序列进行物种分类注释, 对比Silva 16S rRNA 数据库(v138)。 对营养指标、发酵指标和菌群相对丰度运用Excel 2016 进行数据整理,采用SPSS 17.0 软件中单因素方差进行分析, 采用Duncan’s 法进行多重比较,0.05≤P< 0.10 表示有显著趋势,P< 0.05 表示差异显著,P< 0.01 表示差异极显著。
2 结果与分析
2.1 不同分级指数燕麦干草对体外营养物质降解率的影响 由表2 可知, 体外发酵24 h 时,试验2 组和试验3 组的DMD、CPD 和NDFD 极显著高于试验1 组(P<0.01),DMD 比试验1 组分别高50.95%和55.37%,CPD 比试验1 组分别高26.12%和94.32%,NDFD 比试验1 组分别高54.41%和50.47%。 其中试验2 组和试验3 组的DMD 和NDFD 差异不显著(P>0.05),而试验3 组CPD 显著高于试验2 组(P<0.01)。总的来说,试验2 组和试验3 组营养物质降解率明显高于试验1 组。
2.2 不同分级指数燕麦干草对瘤胃发酵参数的影响 由表3 可知,在发酵24 h,各试验组中pH、异丁酸、异戊酸差异不显著(P>0.05),而氨态氮、乙酸、丙酸、丁酸、戊酸、TVFA 和乙酸/丙酸差异显著(P<0.05),且试验2 组和试验3 组氨态氮、乙酸、丙酸、丁酸、戊酸和TVFA 显著高于试验1 组(P<0.05),除戊酸外,试验2 组和试验3 组之间差异不显著(P>0.05),其中试验2 组和试验3 组氨态氮比试验1 组分别高10.85%和16.63%,乙酸比试验1 组分别高12.41%和10.39%, 丙酸比试验1组分别高19.45%和12.05%,TVFA 比试验1 组分别高13.39%和11.05%。 总的来说,试验2 组和试验3 组瘤胃发酵参数明显好于试验1 组。

表3 不同分级指数燕麦干草对瘤胃发酵参数的影响
2.3 不同分级指数燕麦干草对瘤胃菌群数量的影响
2.3.1 瘤胃微生物群落操作分类单元(OTU)聚类和Alpha 多样性分析 本试验从12 个瘤胃液样品中获得307332 条有效序列, 在3%的距离上,12 个样本共获得1981 个OTU, 平均每个样本有1235.42 个OTU, 所有样本共有的OTU 数目为618 个。 由表4 可知, 样本的覆盖率达到99%以上, 说明测序深度足够。 其中,3 组OTU 数目、Shannon 指 数、Simpson 指 数、ACE 指 数 和Chaol指数均无显著差异(P>0.05)。

表4 燕麦干草体外发酵瘤胃微生物OTU 数目和Alpha 多样性指数分析
2.3.2 瘤胃微生物群落物种组成分析
2.3.2.1 门水平 本试验共获得19 个细菌门分类物种, 燕麦干草各组体外发酵瘤胃微生物优势菌门相同。 其中, 各组最优势菌群由拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)组成,两者占整个菌群89%以上,次级优势菌群是疣微菌门(Verrucomicrobiota)、纤维杆菌门(Fibrobacterota)、螺旋菌门(Spirochaetota)、变形菌门(Proteobacteria),其余相对丰度低于1%的门类被聚集到一起,试验1 组、 试验2 组和试验3 组分别为2.54%、2.36%和2.52%。
由表5 可知, 试验2 组和试验3 组纤维杆菌门相对丰度低于试验1 组, 比试验1 组分别低51.36%(P>0.05)和55.45%(P<0.05);其他菌门相对丰度差异不显著, 但厚壁菌门相对丰度有显著差异趋势(P=0.07),从数值上看,试验2 组和试验3 组要优于试验1 组。
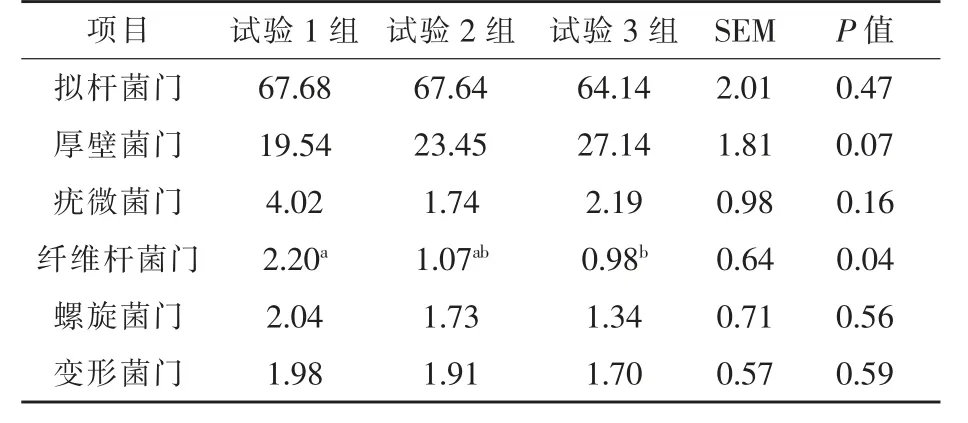
表5 不同分级指数燕麦干草对体外发酵瘤胃微生物优势菌门水平(相对丰度>1%)的影响%
2.3.2.2 属水平 本试验共获得253 个细菌属分类物种, 其中最优势菌属是普雷沃氏菌属(Pre-votella) 和 理 研 菌 科RC9 肠 道 群(Rikenellaceae_RC9_gut_group ),两者均超过15%;次级优势菌属15 个, 分别是未知属F082 菌群(norank_f_F082)、 未知属拟杆菌目RF16 菌群(norank_f_Bacteroidales_RF16_group)、 琥 珀 酸 菌 属(Succiniclasticum)、 克里斯滕森菌科R-7 菌群(Christensenellaceae_R-7_group)、 普雷沃氏菌科UCG-003(Prevotellaceae_UCG-003)、未分类理研菌 科(Unclassified_f_Rikenellaceae)、未 知 属 未 知目WCHB1-41 菌群(Norank_f_norank_o_WCHB1-41)、瘤胃球菌科的特定菌属(NK4A214_group )、未知属UCG-011(Norank_f_UCG-011)、纤维杆菌属(Fibrobacter)、普雷沃氏菌科_UCG-001(Prevotellaceae_UCG -001)、 鳞 球 菌 属 (Sphaerochaeta)、未知属绒毛杆菌科(Norank_f__Muribaculaceae)、 未知属-拟杆菌属UCG-001(norank_f_Bacteroidales_UCG-001)、 毛 螺 菌 科-NK3A20(Lachnospiraceae_NK3A20_ group), 其相对丰度均低于10%; 其余相对丰度低于1%的菌属被聚集到一起,试验1 组、试验2 组和试验3 组分别为19.64%、21.05%和20.99%。
由表6 可知,优势菌属中,试验3 组中未分类理研菌科、 未知属-绒毛杆菌科相对丰度显著高于试验1 组和试验2 组(P<0.05),试验2 组和试验3 组纤维杆菌属显著低于试验1 组(P<0.05),比试验1 组分别低51.36%和55.45%; 其他优势菌属相对丰度差异不显著(P>0.05)。
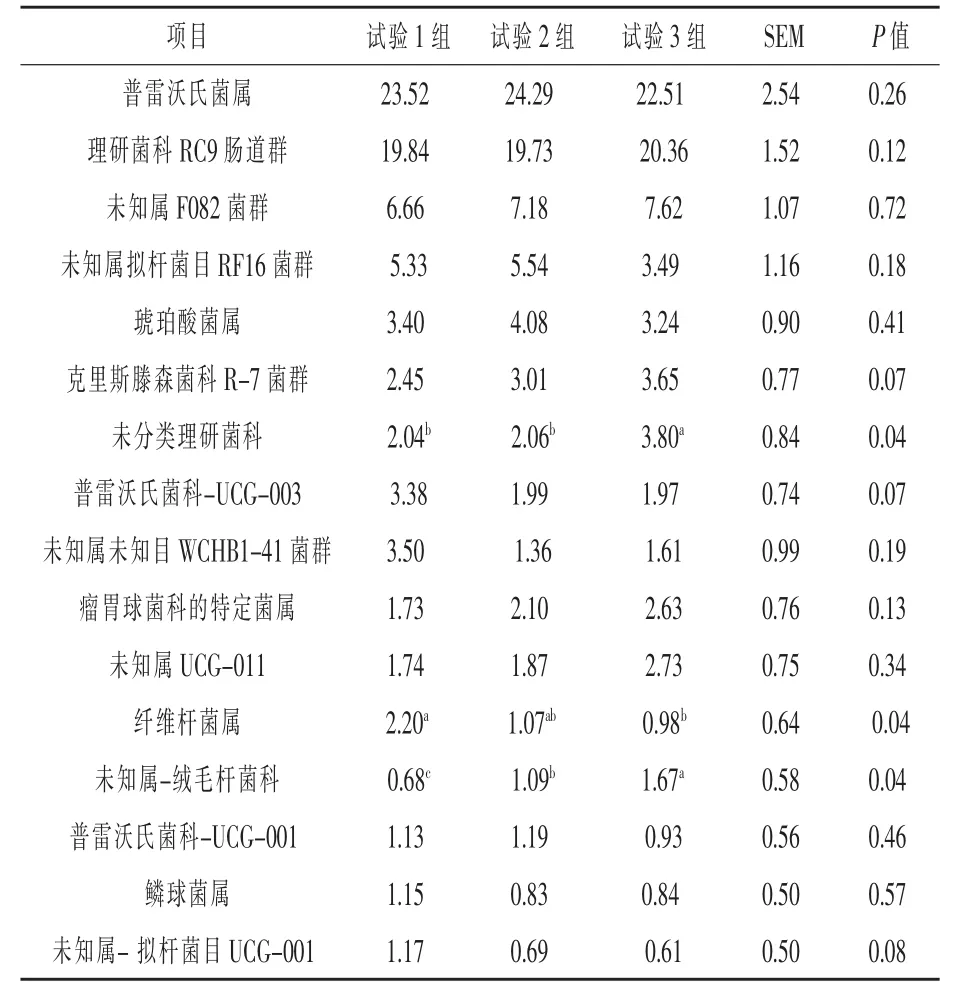
表6 不同分级指数燕麦干草对体外发酵瘤胃微生物优势菌属水平(相对丰度>1%)的影响%
3 讨论
3.1 不同分级指数燕麦干草对体外营养物质降解率的影响 营养物质降解率是评定饲料营养价值的关键指标。 DMD 是影响奶牛采食量(DMI)的关键因素之一,其代表了被瘤胃微生物利用的能力,DMD 越高, 瘤胃发酵效果就越好,奶牛DMI 就越高,摄入的CP 和能量也就会越多(Lunsin 等,2021;宫福臣等,2013)。在本试验中,试验2 组和试验3 组燕麦干草DMD 显著高于试验1 组, 这说明不同分级指数燕麦干草营养价值具有明显的差异, 这可能与试验1 组的燕麦干草的蛋白含量低, 中性性洗涤纤维和酸性洗涤纤维含量高有关(陈晓琳等,2014),营养物质含量的差异主要来源于地理环境、品种、收获时间和加工贮存方式等因素(王吉东等,2022)。
饲料CP 为微生物蛋白合成和瘤胃微生物的生长提供重要的氮源(李小娜等,2012),在本试验中, 试验3 组和试验2 组的CPD 显著高于试验1 组, 这可能是由于试验1 组燕麦干草中CP 含量低,可消化性碳水化合物少,在体外发酵过程微生物蛋白质合成受到限制,CPD 较低(王吉东等,2022)。
饲料中纤维物质有利于奶牛的瘤胃发酵,对于维持奶牛瘤胃的稳态具有重要的作用,因此,奶牛瘤胃中NDFD 是评价燕麦干草营养价值的重要指标, 其值大小反映了纤维物质在瘤胃消化的难易程度 (李胜利等,2014;Oba 等,2006)。在试验相同的条件下, 提高NDFD 对提高奶牛饲料干物质采食量和产奶量具有显著的作用,NDF 主要是由纤维素、 半纤维素和木质素等组成,其中半纤维素部分是主要可发酵的成分,而木质素部分结构独特, 几乎不会被瘤胃微生物所利用,因此,影响NDFD 主要因素是木质素在NDF 中的比例(李小娜等,2012)。 在本试验中,试验2 组和试验3 组NDFD 燕麦干草显著高于试验1 组,这可能是由于GI 等级为五级的燕麦干草的木质化程度较高造成的。 由此可见,相同GI 等级燕麦干草NDFD 差异不显著, 不同等级燕麦干草NDFD 存在较大差异,GI 分级在实际日粮配方应用过程中可以用作参考。
3.2 不同分级指数燕麦干草对瘤胃发酵参数的影响 pH 是反映瘤胃内环境稳态和发酵状况的综合指标, 也是瘤胃微生物正常生长繁殖和发挥功能的必要条件 (郑宇慧等,2020), 其值过高、过低对瘤胃发酵、微生物生长与功能均会产生不利影响(王芳等,2016)。 有研究报道,瘤胃液pH 正常范围是5.5 ~7.5 (Calsamiglia 等,2022)。 在本试验中, 各组发酵液pH 为6.90 ~6.97,均在正常范围内,这说明瘤胃缓冲液配制合理,达到了维持体外瘤胃环境稳态的作用(鲍宇红等,2021;杜超等,2020)。
NH3-N 是评价瘤胃发酵状况的关键指标之一,是饲料蛋白质在瘤胃内降解产物,也是合成瘤胃微生物蛋白的重要前提物质 (蒋辰宇等,2021)。 NH3-N 浓度能够综合反映对饲料蛋白质的分解能力和瘤胃微生物对NH3-N 利用的平衡状 态 (García-gonzález 等,20210), 瘤 胃 液 中NH3-N 浓度为6 ~30 mg/dL, 其中微生物生长最适范围为6.30 ~27.50 mg/dL (Wanapat 等,1999)。 在本试验中, 试验2 组和试验3 组的NH3-N 显著高于试验1 组,这可能是由于试验2组和试验3 组的蛋白含量高, 为瘤胃微生物提供较多的氮源, 使得瘤胃液中的NH3-N 浓度高于试验1 组,这与本试验中的粗蛋白质降解规律一致。
VFA 是碳水化合物在瘤胃降解的主要产物,为瘤胃微生物的生长和增殖提供主要的碳架来源(张霞等,2019;Spears 等,2004),能为反刍动物提供60% ~80%的可消化能(王加启,2011),其大小和组成比例变化可反映了瘤胃的发酵模式和发酵程度的变化。 乙酸是奶牛合成乳脂的主要前体物质, 丙酸是合成葡萄糖的前体物质 (程景等,2021)。在本试验中,试验2 组和试验3 组的乙酸、丙酸和TVFA 含量明显高于试验1 组, 可能由于试验2 组和试验3 组燕麦干草可溶性碳水化合物较高, 发酵过程中能释放充足的能量供瘤胃微生物利用,从而促进了瘤胃发酵,产生的VFA 含量增多(张毕阳等,2018)。
3.3 不同分级指数燕麦干草对微生物组成的影响 日粮是影响微生物多样性的关键因素之一,其中组成成分越复杂, 微生物多样性就越高(Menezes 等,2011)。在本试验中,各组中OTU 数目、Shannon 指 数、Simpson 指 数、ACE 指 数 和Chaol 指数均无显著性差异,说明不同GI 值的燕麦干草对总细菌数量、 物种丰富度和瘤胃微生物多样没有明显的影响。 在门水平,本试验与前人结果类似(李岚捷等,2017),拟杆菌门和厚壁菌门占主导地位, 且试验3 组和试验2 组厚壁菌门比试验1 组有显著增加的趋势, 可能是由于厚壁菌门中含有大量分解饲料中纤维的菌属, 能够分解纤维类物质供机体利用 (李岚捷等,2017), 这也是造成NDFD 出现差异的主要原因。 在属水平,普雷沃氏菌属、理研菌属琥和珀酸菌属为奶牛瘤胃内微生物优势菌属(Petri等,2019),本研究结果与其类似,但各组差异不显著。 在本研究中,试验2 组和试验3 组低丰度纤维杆菌属显著低于试验1 组, 这可能与燕麦干草中纤维含量不同有关。 有研究表明 (魏园等,2018;Weimer 等,1990), 当饲料中纤维素含量增加时, 纤维分解菌相应增加。 本试验还发现,各组中低丰度未分类理研菌科、未知属-绒毛杆菌科存在显著差异, 很可能具有某种重要功能,建议对该菌功能进一步挖掘分析,探索该菌是否有助于奶牛瘤胃营养物质的降解。
4 结论
在本试验条件下, 相同GI 等级燕麦干草营养物质降解率和瘤胃发酵特性没有显著差异,但不同GI 等级燕麦干草差异显著,且随着GI 等级越高,其瘤胃降解特性越好,营养价值越高。不同分级指数燕麦干草对瘤胃微生物组成没有显著影响,但对纤维分解菌、低丰度未分类理研菌科、未知属-绒毛杆菌科相对丰度具有显著的影响。

