FBXW7在食管癌组织中的表达及其对细胞增殖和细胞周期的影响
马小平,蔡 爽,邓朝伟,贾浴侦,Shaker Khan,赵凌宇
(西安交通大学医学部基础医学院细胞生物学与遗传学系,西安 710061;*通讯作者,E-mail:zhaolingyu@xjtu.edu.cn)
食管癌(esophageal cancer,EC)是世界上最常见的恶性肿瘤之一,其发生发展与饮食习惯、环境等有很大关系[1]。根据2020年全球癌症统计数据显示,较上一年,全球新增食管癌患者60多万例,死亡人数达54万多,而中国的发病人数占全球一半以上[2]。在几种消化道癌中,食管癌的预后最差。由于早期诊断困难,大多数食管癌被发现时已处于晚期,并存在对邻近器官的直接侵袭以及淋巴结转移,这使得食管癌的治疗非常困难[3],最终导致晚期患者5年生存率不足20.0%[4,5]。因此寻找能用于食管癌早期诊断的分子标志物,对于食管癌的诊断和治疗至关重要。
FBXW7是E3泛素连接酶中的核心F-box蛋白,是一种p53依赖的肿瘤抑制因子,参与降解多种癌蛋白,如Cyclin E、notch、c-Jun、c-Myc、mTOR[6],进行泛素介导的蛋白水解,控制人类细胞周期进程、细胞生长和肿瘤发展[7,8]。研究表明,在人类癌组织中观察到FBXW7表达下调,包括乳腺癌、膀胱癌和宫颈癌,FBXW7的失活或下调可导致上述蛋白的失调,进而可能导致人类肿瘤发生以及化疗耐药的发展[9-13]。尽管FBXW7在多种肿瘤中被报道,参与多种生物进程,然而,FBXW7在食管癌中的作用及其功能还有待进一步探索。
本研究检测了40例食管癌患者的食管癌组织和癌旁组织样本中FBXW7的表达水平,探究FBXW7对食管癌的细胞增殖、细胞周期和细胞凋亡以及细胞周期相关分子的影响,为阐明FBXW7在食管癌中的作用和功能奠定基础,也为研究食管癌发生发展的潜在机制提供新的思路。
1 材料与方法
1.1 组织收集及细胞培养
本研究自2018年6月至2019年3月间在西安交通大学第一附属医院普外科收集食管癌患者手术后的食管癌组织和癌旁正常组织样本各40例,提取总RNA和蛋白,用以分析FBXW7在食管癌肿的表达变化。
食管癌TE-1和EC9706细胞购于中科院上海细胞库,细胞培养于含10%胎牛血清,1%青霉素/链霉素的DMEM培养基中,在37 ℃、5.0% CO2培养箱中培养。TE-1细胞和EC9706细胞分别分为3组:阴性对照组、siRNA-1组和siRNA-2组,分别转染NC-siRNA(80 nmol/L)、FBXW7 siRNA-1(80 nmol/L)和FBXW7 siRNA-2(80 nmol/L),用于后续的细胞行为学实验。
1.2 主要试剂与仪器
DMEM培养基、Trizol试剂盒、cDNA逆转录试剂盒、SYBR Green PCR Master Mix试剂盒、化学增光剂购于美国Thermo fisher公司;MTT、RnaseA、PI、RIPA裂解缓冲液、Invitrogen Lipofectamine 2000购于美国Thermo fisher公司;FBXW7兔多克隆抗体和c-Myc兔单克隆抗体购于Thermo fisher公司(美国);细胞周期蛋白D1小鼠单克隆抗体和小鼠单克隆抗GAPDH抗体购于中国武汉三鹰生物技术有限公司;所有二抗购于美国Sigma公司;Annexin Ⅴ/FITC凋亡试剂盒购于美国BD-BioScience公司;FBXW7 siRNAs序列由中国上海吉玛制药技术有限公司合成。
流式细胞仪为美国FALSCALIBARBD公司产品;全自动酶标仪购于美国Bio-Tek公司;实时定量PCR仪、CO2培养箱、电泳仪、湿转槽均为美国Bio-RAD公司产品。
1.3 TCGA数据分析FBXW7在食管癌中表达
通过癌症基因组图谱(the cancer genome altas, TCGA)与基因型-组织表达工程(the genotype-tissue expression project,GTEX)数据(https://xena.ucsc.edu)以食管-黏膜和食管-肌层为正常对照组织,分析FBXW7在食管癌组织中的表达,R language(4.1.1)用于数据的可视化。
1.4 siRNA合成与转染
采用小干扰RNA(siRNAs)沉默人FBXW7基因用以研究其细胞学功能及分子机制。相关序列如下:①FBXW7 siRNA-1 sense:5′-GCACAGAAU-UGAUACUAACTT-3′,antisense:5′-GUUAGUAUC-AAUUCUGUGCTG-3′;②FBXW7 siRNA-2 sense:5′-CCUUAUAUGGGCAUACUUCTT-3′,antisense:5′-GAAGUAUGCCCAUAUAAGGTG-3′;③negative siRNA(NC-siRNA)sense:5′-UUCUCCGAACGUGUCACGUTT-3′,antisense:5′-ACGUGACACGU-UCGGAGAATT-3′,均由GenePharma合成。在平板中培养TE-1和EC9706细胞24 h后,根据制造商的方案,使用LipofectamineTM2000将siRNA瞬时转染到细胞中,用于探究FBXW7在TE-1和EC9706细胞中的生物功能及分子机制。
1.5 实时荧光定量PCR检测食管癌组织和转染siRNA后细胞中FBXW7 mRNA表达
采用实时定量PCR分别检测40对食管癌组织和癌旁组织,以及转染FBXW7 siRNAs的TE-1和EC9706细胞中FBXW7 mRNA水平表达变化。根据生产制造商说明,使用TRIzol试剂提取人食管癌组织和转染FBXW7 siRNAs细胞的总RNA。以GAPDH为内参对照,采用2-ΔΔCt方法来分析FBXW7 mRNA的相对表达量。引物序列包括FBXW7上游引物:5′-AAAGAGTTGTTAGCGGTTCTCG-3′,下游引物:5′-CCACATGGATACCATCAAACTG-3′;GAPDH上游引物:5′-GCCACATTACTCAGACAC-3′,下游引物:5′-GCCCAATACGGTCAAATCC-3′。
1.6 MTT比色法检测FBXW7 siRNAs对食管癌细胞增殖的影响
以1.1分组进行细胞培养,TE-1和EC9706细胞以2 000个细胞/孔分别接种于96孔板,每孔100 μl培养基,孵育24 h。每组5个复孔,转染后再分别培养24,48,72 h,再每孔加10 μl 5 mg/ml MTT溶液,继续培养4 h,弃上清并加入150 μl DMSO,利用酶标仪在492 nm波长下检测吸光度。
1.7 流式细胞仪检测FBXW7 siRNAs对食管癌细胞周期的影响
以1.1分组进行细胞培养及转染,TE-1和EC9706细胞以2×105个/孔分别接种于6孔板,每孔2 ml培养基。收集转染48 h后的各组细胞,用预冷PBS洗涤细胞两次。然后用1 ml 70.0%冰冷乙醇4 ℃过夜固定。PBS洗涤2次,在室温下用含50 μg/ml RNase A(无DNase)的50 μg/ml碘化丙啶染色细胞15 min。最后,通过流式细胞仪(FACS)检测细胞内PI含量,并用ModFit软件(Bio-Rad Laboratories,Hercules,CA,USA)分析细胞周期不同时相细胞比例。
1.8 流式细胞仪检测FBXW7 siRNAs对食管癌细胞凋亡的影响
以1.1分组进行细胞培养及转染,收集转染48 h后的各组细胞,然后用PBS清洗2次。用300 μl结合缓冲液重悬细胞,使其浓度为1×105/ml。取100 μl细胞悬液加入到5 ml流式管中,再加入5 μl 10 μg/ml Annexin Ⅴ/FITC和5 μl 20 μg/ml碘化丙啶,避光混匀,孵育15 min。在流式管中加入400 μl PBS。用流式细胞仪检测染色细胞,采用ModFit软件分析细胞凋亡。
1.9 Western blot分析食管癌组织中FBXW7的表达和FBXW7 siRNAs对FBXW7表达、c-Myc信号通路的影响
为了研究FBXW7在食管癌组织中的表达和FBXW7 siRNAs对TE-1和EC9706细胞中FBXW7表达、c-Myc信号通路的影响,采用Western blot检测相关蛋白表达。使用RIPA裂解缓冲液裂解12例食管癌组织及12例癌旁组织和以1.1分组处理的细胞样本。用10.0%SDS聚丙烯酰胺凝胶分离总蛋白,并转移到PVDF膜上,5%脱脂奶粉室温封闭1 h,分别与FBXW7兔多克隆抗体(1 ∶1 000)、c-Myc兔单克隆抗体(1 ∶2 000)、细胞周期蛋白D1小鼠单克隆抗体(1 ∶1 000)和小鼠单克隆抗GAPDH抗体(1 ∶4 000)4 ℃孵育过夜,洗膜,用HRP标记的山羊抗兔/山羊抗鼠二抗(1 ∶5 000)室温孵育1.5 h,洗膜。随后用ECL试剂处理膜进行化学发光检测。通过CCD相机检测发光信号,并用Syngene GBox记录并定量。
1.10 统计学分析
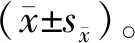
2 结果
2.1 FBXW7在食管癌组织中表达下调
与癌旁组织相比,食管癌组织中FBXW7 mRNA及蛋白水平表达均下调,差异有统计学意义(P<0.01,见图1A和1B)。TCGA联合GTEX数据库分析发现,FBXW7在食管癌组织中低表达(P=0.021,见图1C)。
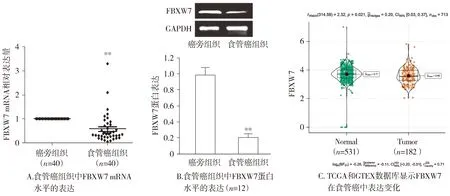
与正常食管组织组比较,**P<0.01图1 FBXW7在食管癌组织中的表达Figure 1 Expression of FBXW7 in esophageal carcinoma
2.2 食管癌细胞中沉默FBXW7的效率
在TE-1和EC9706细胞中,与阴性对照组相比,siRNA-1组和siRNA-2组FBXW7 mRNA水平降低,差异有统计学意义(P<0.01,见图2A)。同时与NC-siRNA组相比,siRNA-1组和siRNA-2组FBXW7蛋白表达也显著下调(P<0.01,见图2B和2C)。表明siRNA能有效沉默TE-1和EC9706细胞中FBXW7表达。

与阴性对照组比较,**P<0.01图2 在食管癌细胞中转染FBXW7 siRNAs后FBXW7表达变化Figure 2 Changes of FBXW7 expression after transfection with FBXW7 siRNAs in esophageal carcinoma cells
2.3 转染FBXW7 siRNAs对食管癌细胞增殖的影响
在TE-1和EC9706细胞中,与阴性对照组相比,FBXW7 siRNAs组的OD492 nm值在48 h和72 h均显著增加(P<0.01,见图3),表明沉默FBXW7后,TE-1和EC9706细胞增殖能力显著增加。

A.转染FBXW7 siRNAs对TE-1细胞增殖影响B.转染FBXW7 siRNAs对EC9706细胞增殖影响与阴性对照组比较,**P<0.01图3 FBXW7 siRNAs对食管癌细胞增殖的影响Figure 3 Effect of FBXW7 siRNAs on the proliferation of esophageal carcinoma cells
2.4 转染FBXW7 siRNAs对食管癌细胞周期的影响
在TE-1和EC9706细胞中,与阴性对照组相比,FBXW7 siRNAs组G1/G0期细胞显著减少(P<0.01),而S期和G2/M期细胞显著增加(P<0.01,见图4,图5),表明沉默FBXW7后,可以促进TE-1和EC9706细胞G1/S转换。

与阴性对照组比较,**P<0.01图4 沉默FBXW7对食管癌TE-1细胞周期的影响Figure 4 Effect of FBXW7 siRNAs on cell cycle of esophageal carcinoma TE-1 cells
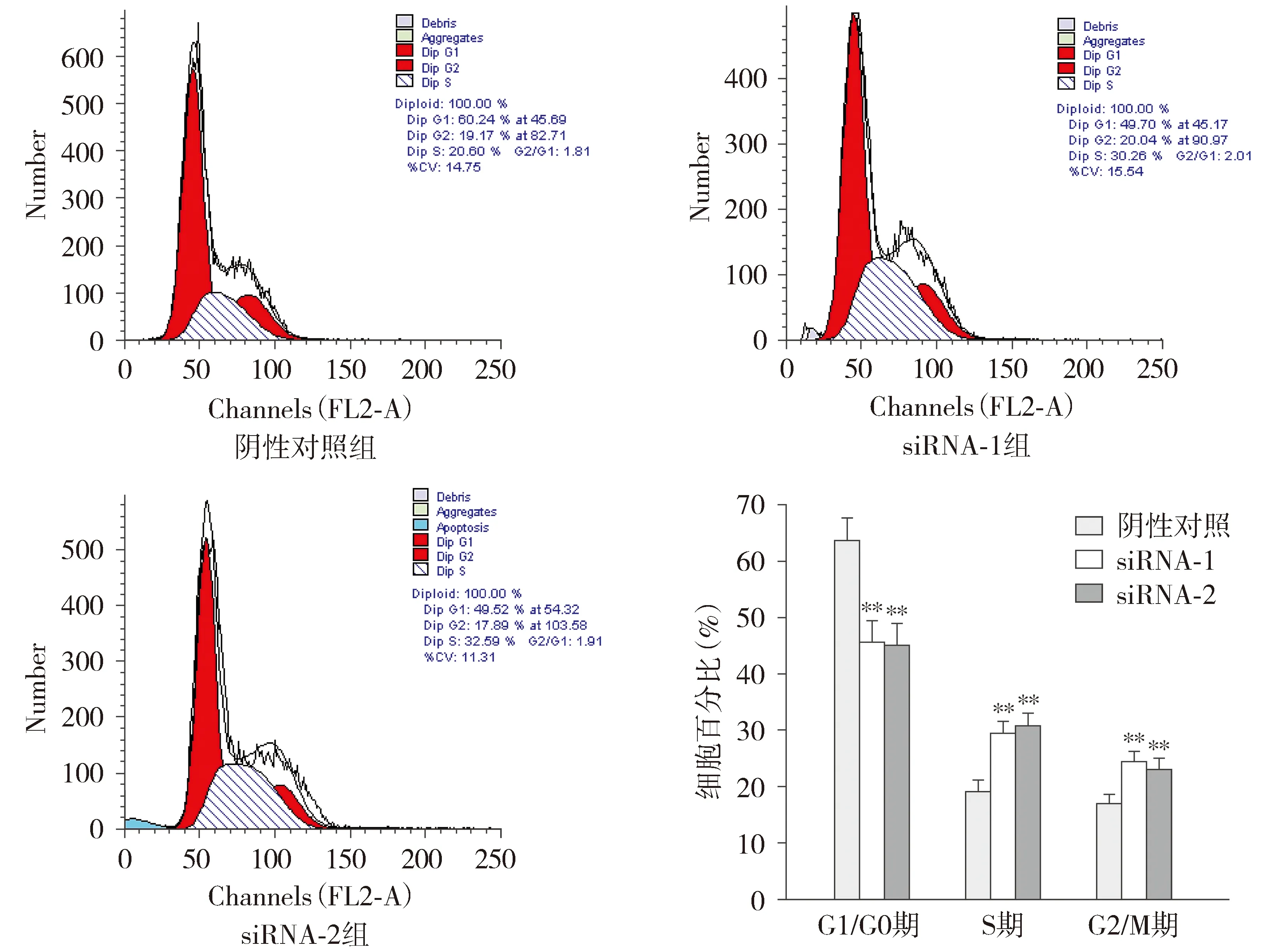
与阴性对照组比较,**P<0.01图5 FBXW7 siRNAs对食管癌EC9706细胞周期的影响Figure 5 Effect of FBXW7 siRNAs on cell cycle of esophageal carcinoma EC9706 cells
2.5 转染FBXW7 siRNAs对食管癌细胞凋亡的影响
与阴性对照组相比,siRNA-1组和siRNA-2组TE-1和EC9706早期和晚期凋亡细胞比例显著减少(P<0.05,见图6)。表明沉默FBXW7可以抑制TE-1和EC9706的凋亡。
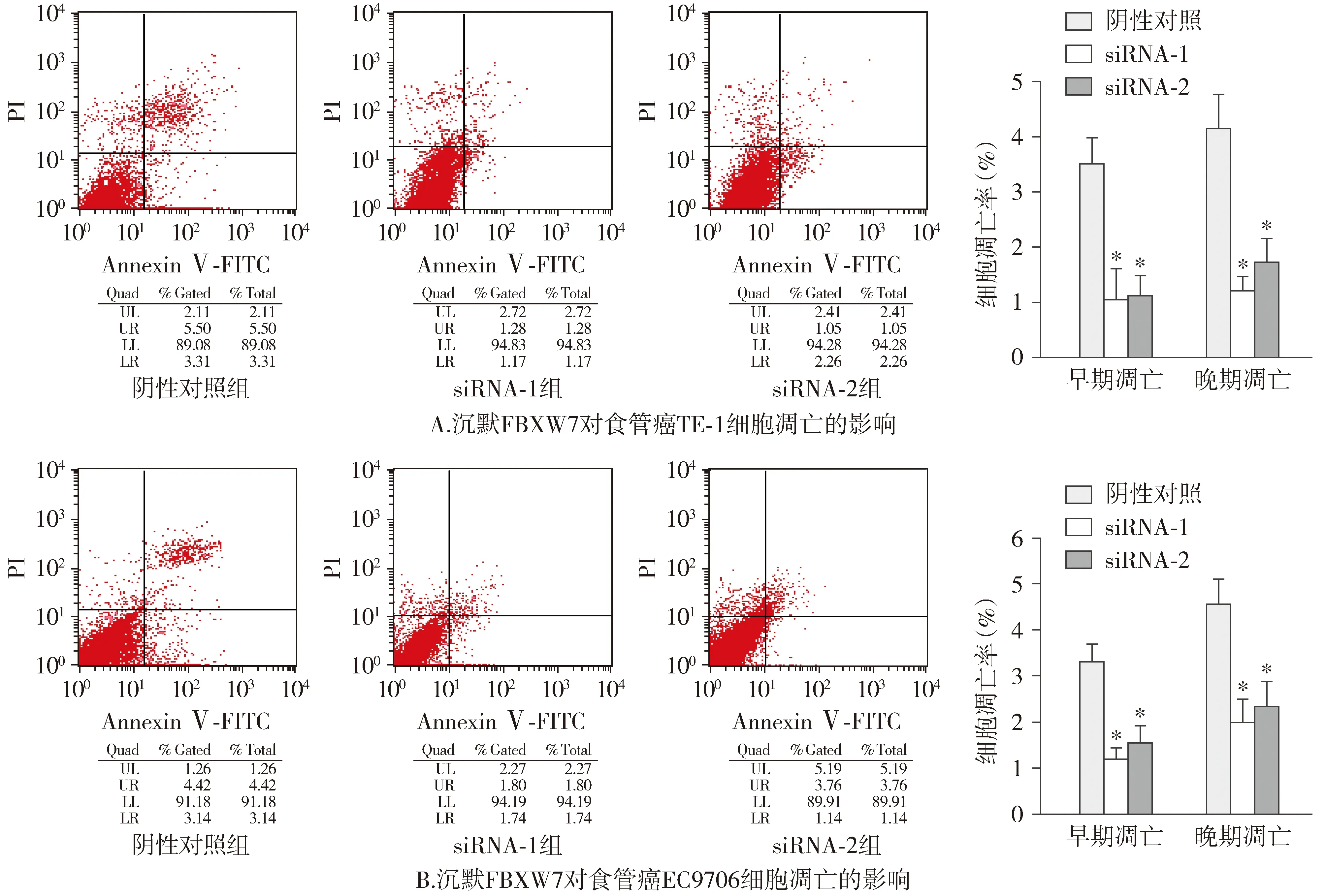
与阴性对照组比较,*P<0.05图6 FBXW7 siRNAs对食管癌细胞凋亡的影响Figure 6 Effect of FBXW7 siRNAs on apoptosis of esophageal carcinoma cells
2.6 转染FBXW7 siRNAs调控c-Myc信号通路
为分析FBXW7作用的分子机制,采用Western blot分析沉默FBXW7对TE-1和EC9706细胞c-Myc和Cyclin D1表达的影响。结果发现与阴性对照相比,沉默FBXW7后c-Myc和Cyclin D1蛋白表达均显著上调(P<0.01,见图7)。
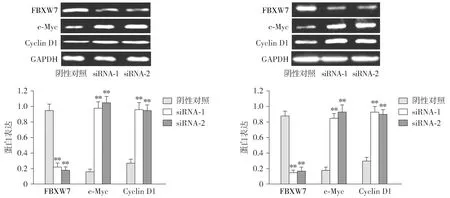
A.TE-1细胞转染FBXW7 siRNAs后c-Myc信号通路相关蛋白表达B.EC9706细胞转染FBXW7 siRNAs后c-Myc信号通路相关蛋白表达与阴性对照组比较,**P<0.01图7 FBXW7 siRNAs对食管癌细胞中c-Myc信号通路的影响Figure 7 Effect of FBXW7 siRNAs on c-Myc signaling pathway in esophageal carcinoma cells
3 讨论
食管癌的发生发展是一个从正常黏膜上皮细胞的不典型增生到原位癌再到浸润癌的演变模式。由于食管癌早期症状不明显,而且时隐时现,反复发作,不能很好地从影像学上诊断,加之缺乏能用于早期诊断的生物标志物,患者大多数确诊为晚期。因此,寻找有效的生物标志物和治疗靶标至关重要。众所周知,肿瘤发生涉及多种分子和生物学过程的异常变化,泛素化就是其中较为重要的一种。与细胞周期和凋亡相关的蛋白,80.0%以上都通过泛素-蛋白酶体系统(UPS)降解[9],UPS失调可能导致包括癌症在内的各种疾病的发生。因此对于该通路的调控已成为疾病治疗中的一种创新性方法。在泛素化过程中,泛素蛋白与靶蛋白结合,需要泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)3种酶。研究表明,E3功能的调节是癌症起始和进展的主要因素之一[14,15]。
FBXW7是SCF类泛素连接酶E3复合体中的关键因子,在转录水平受p53调节[16]。FBXW7负责识别和靶向泛素介导降解的各种癌蛋白(包括Cyclin E、c-Myc、c-jun和Notch-1),从而调控细胞周期进程和细胞凋亡[8,17,18]。本研究结果表明,FBXW7在食管癌组织中低表达。突变、缺失和高甲基化使FBXW7失活,是导致癌症进展的主要原因[7,19]。FBXW7在食管癌组织中表达下调可能是由于这些遗传改变所引起的。于是,为了进一步研究FBXW7在食管癌中的作用,我们通过沉默食管癌中FBXW7的表达,发现食管癌细胞增殖能力显著增强,G1/G0期细胞比例显著减少,S期与G2/M期细胞比例显著增加,早期凋亡和晚期凋亡显著减少,这与在乳腺癌、结直肠癌细胞系中的已有研究结果一致[20,21],先前研究也表明FBXW7沉默促进癌细胞G1期向S期转化[22],进而促进细胞增殖,抑制细胞凋亡[23]。
c-Myc已被报道在许多人类癌症中表达上调,还可以调节细胞周期和细胞代谢过程[24]。c-Myc的异常表达会导致肿瘤的发生,因此,c-Myc蛋白的稳定性受到严格控制。许多研究表明FBXW7表达下调致使其介导的泛素化降解蛋白质作用丧失,从而导致c-Myc表达上调,并与癌症患者的不良预后相关[25]。我们的研究结果表明,在食管癌中敲低FBXW7,c-Myc及其下游Cyclin D1上调,这说明食管癌中FBXW7可能是通过c-Myc及其下游通路介导细胞增殖、细胞周期转换以及细胞凋亡。
综上所述,FBXW7在食管癌组织中表达下调,致使c-Myc信号通路激活促进食管癌细胞增殖、细胞周期转换,并抑制细胞凋亡。本研究初步探究了FBXW7在食管癌中的表达,生物学功能及其分子机制。对于FBXW7在食管癌中的分子作用网络和临床作用,还有待进一步研究和验证。

