放牧和刈割对大针茅草原土壤微生物群落结构及多样性的影响
郑佳华,赵萌莉,*,王 琪,张 峰,张 彬 ,张 军
1 内蒙古农业大学草原与资源环境学院,呼和浩特 010019 2 内蒙古农业大学草地资源教育部重点实验室,呼和浩特 010019 3 内蒙古农业大学理学院,呼和浩特 010019
大针茅草原是欧亚草原中最常见,最具代表性和最稳定的典型草原群落,广泛分布于我国内蒙古中东部[1]。有研究表明,我国内蒙古锡林郭勒盟74.0%的大针茅草原处于退化状态,严重威胁着畜牧业生产和当地牧民的生计[2]。放牧和刈割是该地区最普遍的利用方式,也是造成草地退化的主要原因[3],过度放牧会对草地生态系统造成许多负面影响,包括有毒植物的增加以及植被覆盖度和生物量的损失、破坏植物群落的结构和组成、导致土壤环境恶化等[4—5],宋洁等的研究发现,重度放牧导致大针茅草原优势种重要值降低,并且显著降低了土壤养分含量[6],此外,土壤含水量、草地蒸散速率、土壤有机碳含量和土壤呼吸速率均与放牧强度呈负相关,说明放牧对草地生态系统功能有负效应[7]。另一方面,刈割显著降低大针茅草原的产量和土壤氮含量[8],也导致土壤中营养元素的流失,降低生态系统的稳定性[9—10]。
土壤是一个复杂的生态系统,可以提供植物生长所需的水分和养分,是生物地球化学循环的基础[11]。草地退化会导致沙漠化,并降低微生物数量[12]。土壤微生物是草地生态系统的重要组成部分,参与多种重要的生态功能,在调节碳氮循环等生物地球化学过程中发挥着重要作用[13]。不同的微生物在土壤养分循环中发挥不同的功能,如分解有机质和凋落物等[14]。有研究发现,人为干扰导致的草地植被群落的变化改变了一些土壤细菌的代谢,导致其对植物生长有害[15]。同时,生物和非生物因素,如凋落物输入、土壤物理性质和土壤养分状况可以调控微生物种群数量、群落结构和活性[16]。因此,不同利用方式下大针茅草原土壤养分状况和环境因子的变化可能导致微生物群落结构和组成的变化,这一研究对于草地管理和健康评价具有重要意义。
目前有关大针茅草原长期放牧和刈割下对土壤微生物群落的研究较少,因此本研究采用高通量测序技术,旨在研究大针茅草原在不同利用方式下土壤微生物组成及多样性的变化,并结合土壤理化因子进一步探究土壤微生物群落组成的主要影响因素。阐明土壤微生物群落组成的驱动因素,为大针茅草原合理利用提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于内蒙古锡林浩特市毛登牧场(116.03°—116.50°E、44.80°—44.82°N)。该地区属温带干旱大陆性气候,气温变化剧烈,昼夜温差较大。年平均气温2.25℃,年降水量136—387mm,年平均降水量281.39mm;年蒸发量2000—2700mm。大部分降水集中在6—9月,占全年降水量的80%以上。光照、热、降水同期出现。土壤以栗钙土为主,土壤有机质含量2%—3%。该地区以大针茅(Stipagrandis)为建群种,优势种有羊草(Leymuschinensis)和知母(Anemarrhenaasphodeloides),主要伴生种有黄囊苔草(Carexkorshinskyi)、黄花黄芪(Astragalusluteolus)、冰草(Agropyroncristatum)以及冷蒿(Artemisiafrigida)等。
1.2 试验设计
本研究选择刈割(M)以及自由放牧(G)两种利用方式,并以围封作为对照(E),各个样地在地形地貌、土壤组分、气候及原生群落组成与类型上基本一致。其中刈割样地和围封样地位于毛登牧场天然打草场试验地,实验样地于2011年开始处理,设置了刈割处理区和围封对照区,3次重复,共6个小区,每个小区面积为50m×30m,小区间隔10m,每年的8月31号使用打草机对刈割样地进行割草处理,留茬高度约为5cm。放牧样地选择毛登牧场中利用强度相近的3户牧民草场,面积分别为533、500、400hm2,全年自由放牧,主要放牧家畜为绵羊,放牧年限超过20年,2014—2020年使用移动围笼测定3户草地的7年平均草地利用率为60.9%[17]。
1.3 土壤取样
野外取样于2020年8月10—20日生物量高峰期进行。在刈割和对照样地各个重复小区内随机设置3个1m×1m的样方,3个家庭牧场各随机设置3个1m×1m的样方,使用内径7cm的根钻在每个样方内以“S”形5点混合采样法收集0—20cm土层的土壤并装入根袋中,筛出土壤样品分成2份保存,一份放在4℃冰盒中带回实验室用于土壤微生物高通量测定,另一份带回实验室风干后用于土壤理化性质指标的测定。完成土壤样品采集后,在每个小区内使用快速检测温度计随机测定3处20cm深度的土壤温度,计算平均值记为该小区的土壤温度,使用烘干称重法测定土壤含水量。
1.4 土壤微生物DNA提取及测序
将低温保存的土壤样品按每个区组混合成为1个样品,使用MOBIO土壤DNA提取试剂盒(德国QIAEN公司)提取土壤微生物总DNA。将得到的DNA溶液利用紫外分光光度计和琼脂糖凝胶电泳仪检测浓度和样品完整性(琼脂糖凝胶浓度:1%;电压:150V;电泳时间:40分钟)。当用Nanodrop 2000测定DNA样品的A260/A280比值均接近于1.8时,表明所提取DNA无降解,质量较好,可用于后续的PCR扩增实验。PCR扩增细菌16S rRNA V3-V4高变区:515F(5′-gtgccagcmgccgcggtaa- 3′)、806R(5′-ggac-TACHVGGGTWTCTAAT- 3′),使用真菌引物组ITS5- 1737F和ITS2- 2043R扩增ITS1可变区。在2%琼脂糖凝胶中检测PCR产物,以确定扩增的成功率和条带的相对强度。使用TruSeq® DNA PCR-Free Sample Preparation Kit 进行文库构建。测序工作由“北京诺禾致源科技股份有限公司”完成。基于IonS5TMXL测序平台,利用单端测序的方法,构建小片段文库进行单端测序。测序完成后,对原始数据进行剪切、过滤、拼接得到有效数据用于后续分析,在97%相似性水平下将优质序列聚类成为OTUs(Operational taxonomic units),然后对OTUs序列进行物种注释。使用Qiime软件计算Observed-otus指数、Chao1指数、Shannon-wiener指数、Simpson指数、ACE指数,用于分析土壤微生物群落α多样性[17]。
1.5 土壤理化性质测定
土壤全碳、全氮使用元素分析仪测定;土壤全磷使用钼锑抗比色法测定;土壤铵态氮、硝态氮使用连续流动分析仪AA3测定;土壤有机碳使用重铬酸钾容量法-外加热法测定;土壤有效磷使用0.5mol/L NaHCO3法测定;土壤电导率使用电导仪测定;土壤pH使用pH计测定。以上指标均严格按照土壤农化分析手册中的实验步骤测定[18]。
1.6 数据分析
使用Excel 2010初步整理数据,使用SPSS 20.0对实验数据进行正态分布检验和方差齐性检验,本试验的数据均符合正态分布且通过了方差齐性检验,对数据进行差异显著性检验(DUNCAN法,α=0.05)。使用Origin 2019作图。使用canoco 5.0软件进行冗余分析。
2 结果分析
2.1 土壤理化性质
由表1可以看出,利用方式对土壤养分含量有显著影响,与围封相比,放牧显著降低了土壤硝态氮、有效磷、有机碳、总氮和总碳含量,而刈割显著提高了土壤总氮和总碳含量(P<0.05)。说明刈割有利于大针茅草原土壤养分的累积,而放牧则导致了土壤养分流失严重。同时,利用方式对土壤物理性质也有显著影响,与围封相比,放牧显著降低了土壤含水量、温度和pH,而刈割显著提高了土壤pH(P<0.05)。
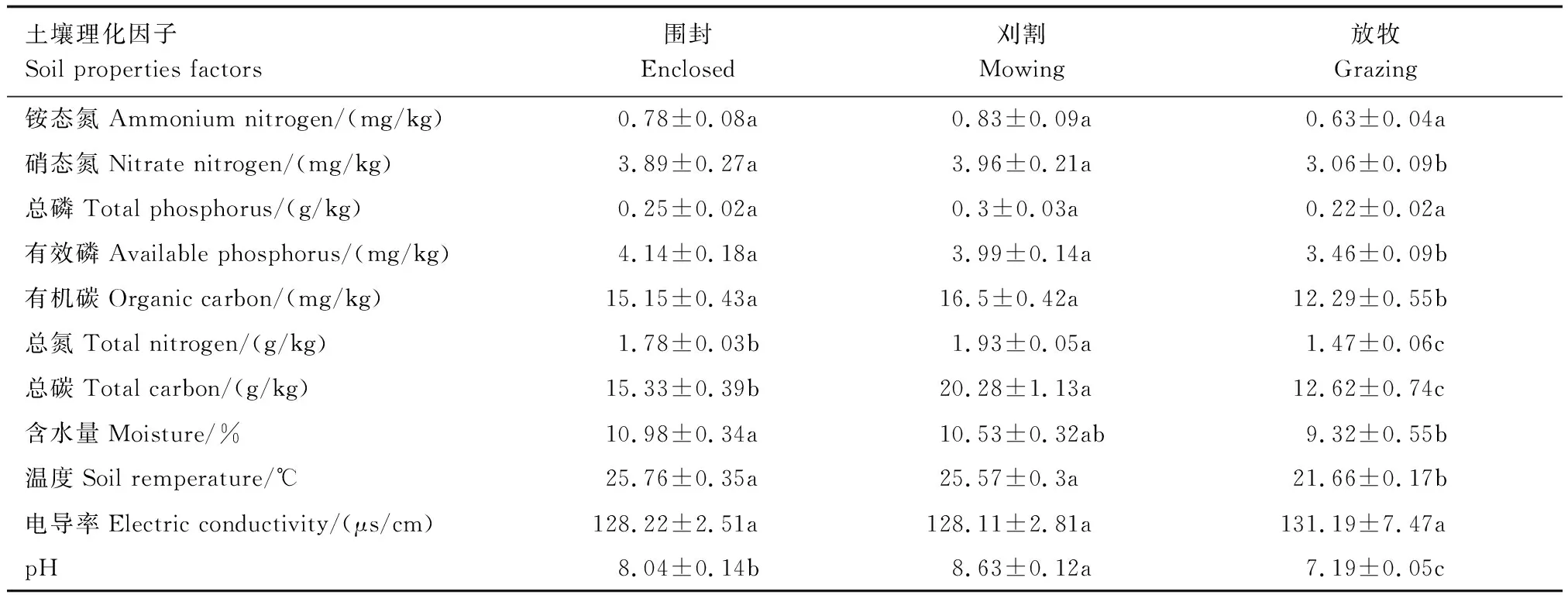
表1 不同利用方式下土壤理化特性Table 1 Physical and chemical characteristics of soil under different grassland management regime
2.2 OTU数量分析
根据不同利用方式下细菌、真菌的OTU数量绘制韦恩图,由图1可以看出,不用利用方式下共有细菌OTU2959个,围封样地特有的OTU数为762个;刈割样地为749个;放牧样地为974个,不用利用方式下共有真菌OTU559个,围封样地特有的OTU数为316个;刈割样地为368个;放牧样地为440个,可以看出土壤细菌数量远大于真菌数量。此外,在放牧样地中,特有的细菌OTU数和真菌OTU数均最大,说明在放牧下条件,土壤微生物群落变化最大,特有的微生物群落最多。
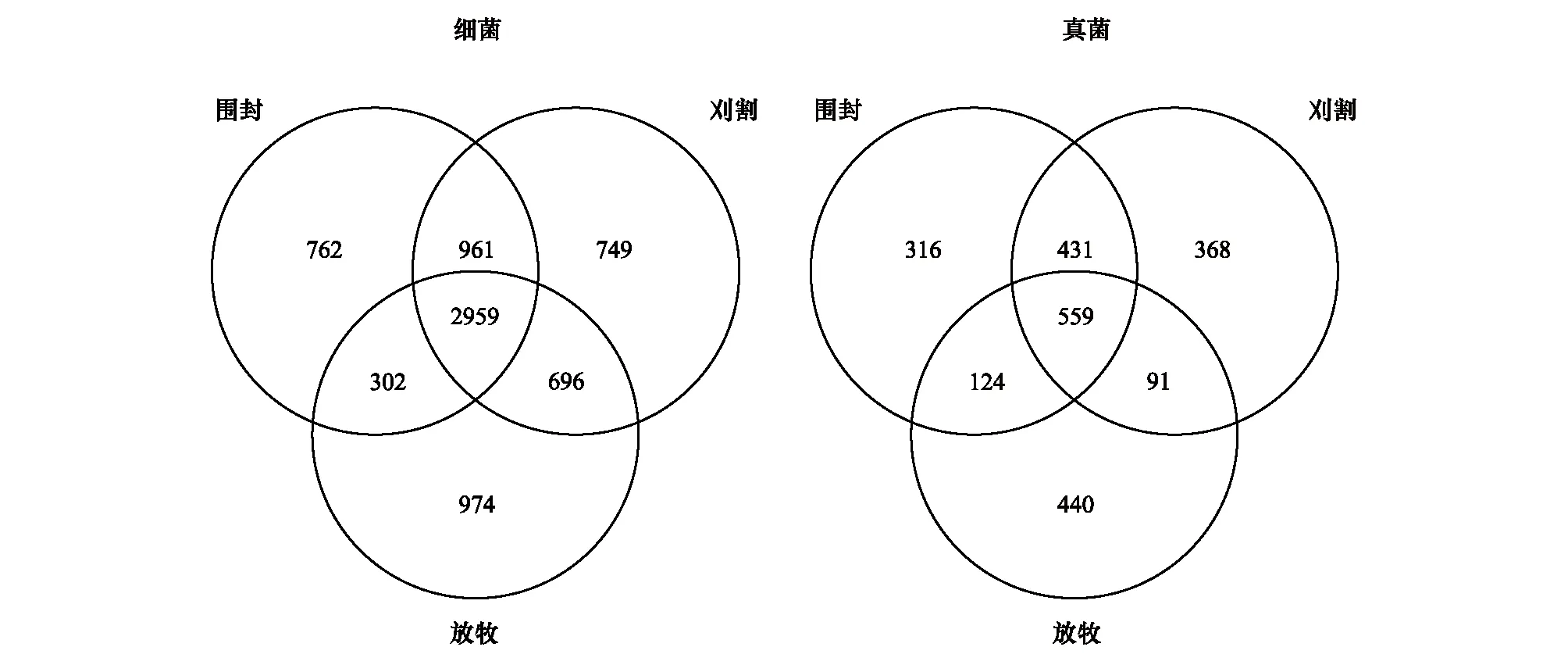
图1 土壤样品微生物 OTUs 数量的 16S(细菌)和 ITS(真菌)韦恩图Fig.1 Venne diagram of OTUs number of bacteria and fungiOTUs: 操作分类单位 Operational taxonomic units
2.3 土壤微生物α多样性分析
不同利用方式下土壤细菌群落的α多样性指数间无显著性差异,而土壤真菌群落的α多样性指数间差异显著(P<0.05)。其中,Observed_species指数、Chao1指数以及ACE指数的变化趋势一致,与围封相比,放牧无显著影响,但是刈割显著提高了土壤真菌群落的Observed_species指数、Chao1指数以及ACE指数(P<0.05),分别提高了7.24%、7.76%和8.13%(表2)。Observed_species指数表示真菌的物种数目,值越高表示该样地内物种丰富度越高;Chao1指数表示样地内真菌OTU数目;ACE指数表示样地内真菌物种丰富度和均匀度。说明在刈割处理下,土壤真菌群落丰富度最高且物种分布最均匀。
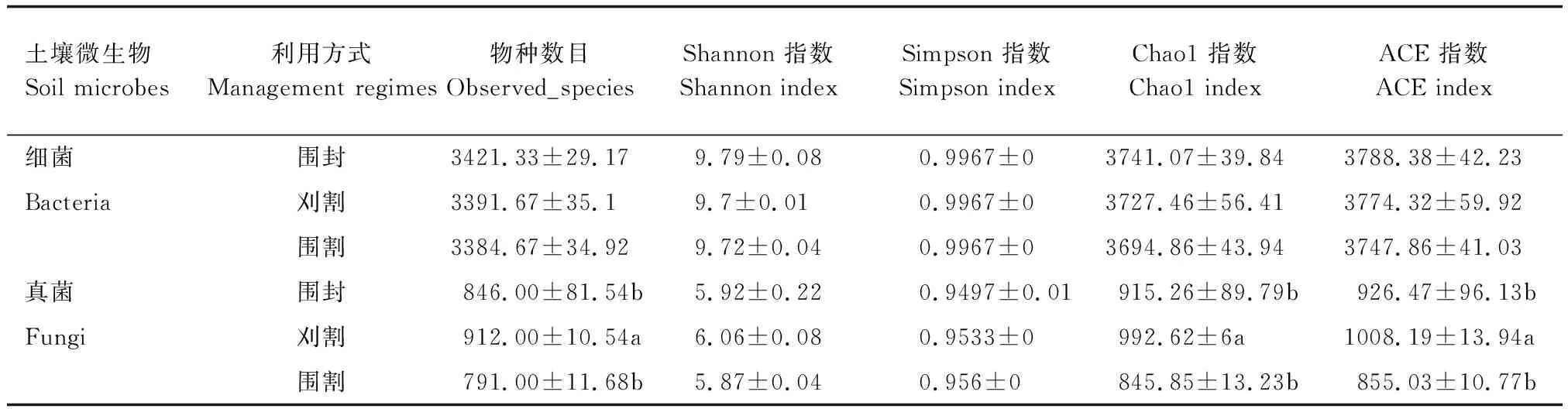
表2 不同利用方式下土壤细菌和真菌α多样性指数方差分析Table 2 Variance analysis of α diversity index of soil bacteria and fungi under different grassland management regimes
2.4 土壤微生物群落结构
不同利用方式下土壤细菌群落相对丰度在门水平上排名前10的菌群依次为:变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、undefined_Bacterial、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadetes)、泉古菌门(Crenarchaeota)以及绿弯菌门(Chloroflexi),其中相对丰度排名前5的细菌群落占土壤细菌总OTU数的60%以上(图2)。不同利用方式下土壤真菌群落相对丰度在门水平上排名前10的菌群依次为:子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、霉门(Mucoromycota)、球囊菌门(Kickxellomycota)、梳霉门(Kickxellomycota)、罗兹菌门/隐菌门(Rozellomycota)、油壶菌门(Olpidiomycota)以及隐孢子菌门(Aphelidiomycota),其中子囊菌门(Ascomycota)和被孢霉门(Mortierellomycota)占土壤真菌总OTU数的70%以上(图2)。
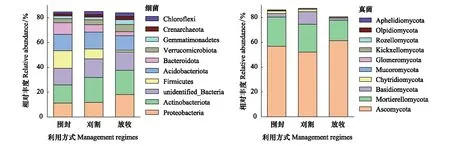
图2 不同利用方式下土壤细菌和真菌群落在门水平上的相对丰度Fig.2 Relative abundance of total bacterial and fungi phyla in soil under different grassland management regimes细菌:Proteobacteria,变形菌门;Actinobacteria,放线菌门;Firmicutes,厚壁菌门;Acidobacteria,酸杆菌门;Bacteroidetes,拟杆菌门;Verrucomicrobia,疣微菌门;Gemmatimonadetes,芽单胞菌门;Crenarchaeota,泉古菌门;Chloroflexi,绿弯菌门;真菌:Ascomycota,子囊菌门;Mortierellomycota,被孢霉门;Basidiomycota,担子菌门;Chytridiomycota,壶菌门;Mucoromycota,毛霉门;Glomeromycota,球囊菌门;Kickxellomycota,梳霉门;Rozellomycota,罗兹菌门/隐菌门;Olpidiomycota,油壶菌门;Aphelidiomycota,隐孢子菌门
通过MetaStat分析不同利用方式下土壤细菌的相对丰度在门水平上的差异性,共有6种细菌类群存在显著性差异,分别是变形菌门、放线菌门、厚壁菌门、疣微菌门、芽单胞菌门以及绿弯菌门(图3)。与围封相比,放牧显著提高了变形菌门、疣微菌门和芽单胞菌门的相对丰度(P<0.05),而围封样地与刈割样地间无显著差异;放牧和刈割显著提高了放线菌门和绿湾菌门的相对丰度(P<0.05);放牧和刈割显著降低了厚壁菌门的相对丰度(P<0.05)。
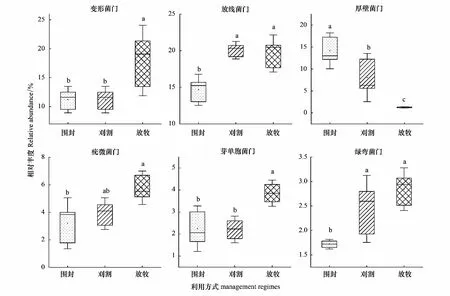
图3 不同利用方式下土壤门水平上主要细菌相对丰度的方差分析Fig.3 Variance analysis of relative abundance of major bacteria at soil phylum level under different grassland management regimes不同小写字母表示处理间差异显著(P<0.05)
土壤真菌群落的相对丰度在门水平上仅有担子菌门差异显著,与围封相比,刈割显著增加了担子菌门相对丰度(P<0.05),而围封样地与放牧样地间无显著差异(图4)。
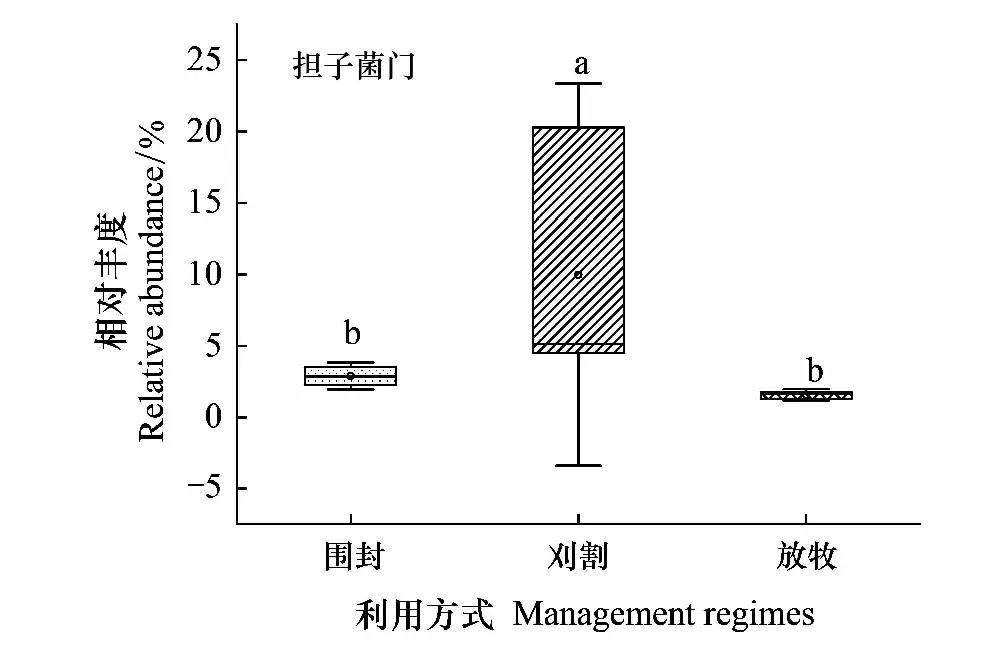
图4 不同利用方式下土壤门水平上主要真菌相对丰度的方差分析Fig.4 Variance analysis of relative abundance of major fungi at soil phylum level under different grassland management regimes
2.5 土壤微生物群落结构与土壤理化性质的关系
使用冗余分析(RDA)进一步分析土壤理化性质与土壤微生物群落结构的影响,图5为土壤细菌群落与土壤理化性质的RDA分析,RDA的前两个轴分别解释了总方差的74.38%和10.74%,共解释了85.12%,说明RDA的结果可靠,蒙特卡洛检验的结果表明,土壤硝态氮(P=0.024)和铵态氮(P=0.046)是影响土壤细菌群落最主要的因素(表3),由图5可以看出,二者均与酸杆菌门呈正相关,与变形菌门呈负相关;而土壤电导率与变形菌门呈正相关;土壤含水量与拟杆菌门呈正相关。
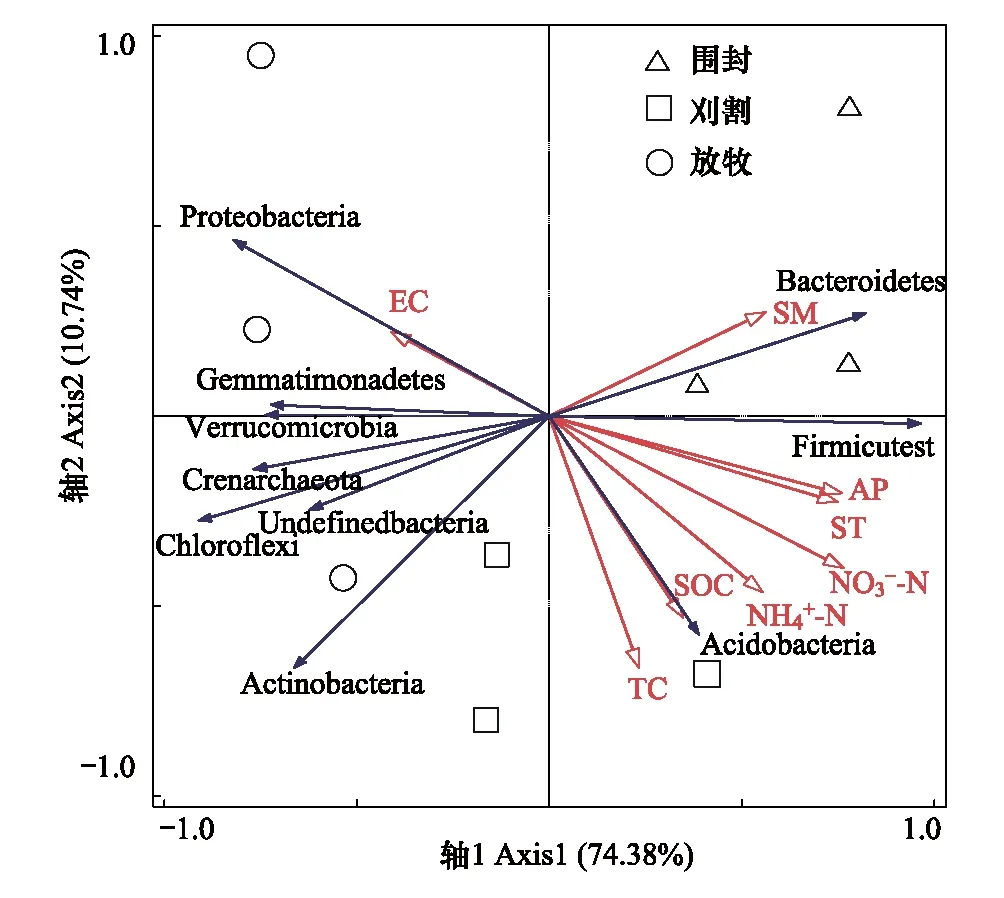
图5 土壤细菌群落与土壤理化性质的冗余(RDA)分析 Fig.5 RDA analysis of soil bacterial community and soil physicochemical propertiesEC:电导率 Electrical conductivity;SM: 土壤含水量Soil moisture;AP: 有效磷Available phosphorus;ST:土壤温度Soil temperature;SOC: 有机质Soil organic carbon;TC: 全碳Total 铵态氮Ammonium 硝态氮Nitrate nitrogen
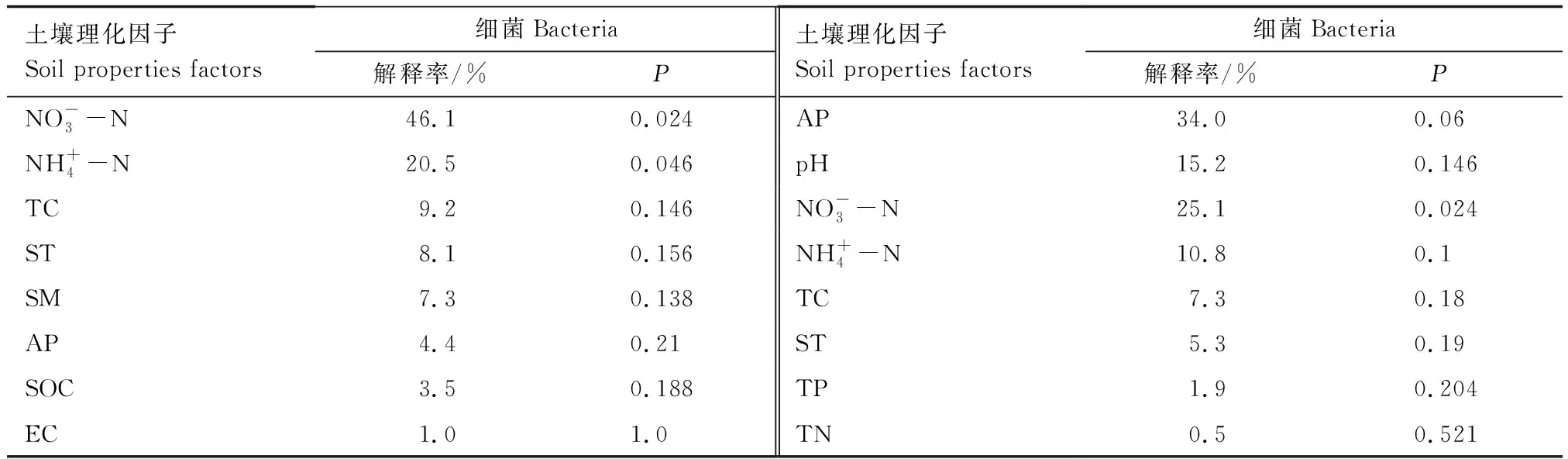
表3 经冗余分析确定土壤理化性质对土壤微生物群落结构的影响Table 3 The effects of soil physical and chemical properties on soil microbial community structure were determined by redundancy analysis
图6为土壤真菌群落与土壤理化性质的RDA分析,RDA的前两个轴分别解释了总方差的71.08%和26.72%,共解释了97.8%,说明RDA的结果可靠,蒙特卡洛检验的结果表明,土壤有效磷(P=0.06)和硝态氮(P=0.024)是影响土壤真菌群落最主要的因素,由图6可以看出,土壤有效磷、硝态氮、pH、铵态氮等理化性质与被孢霉门和担子菌门呈正相关,与子囊菌门和油壶菌门呈负相关。冗余分析的结果表明,土壤细菌和真菌对土壤理化性质的响应结果和敏感程度不同。
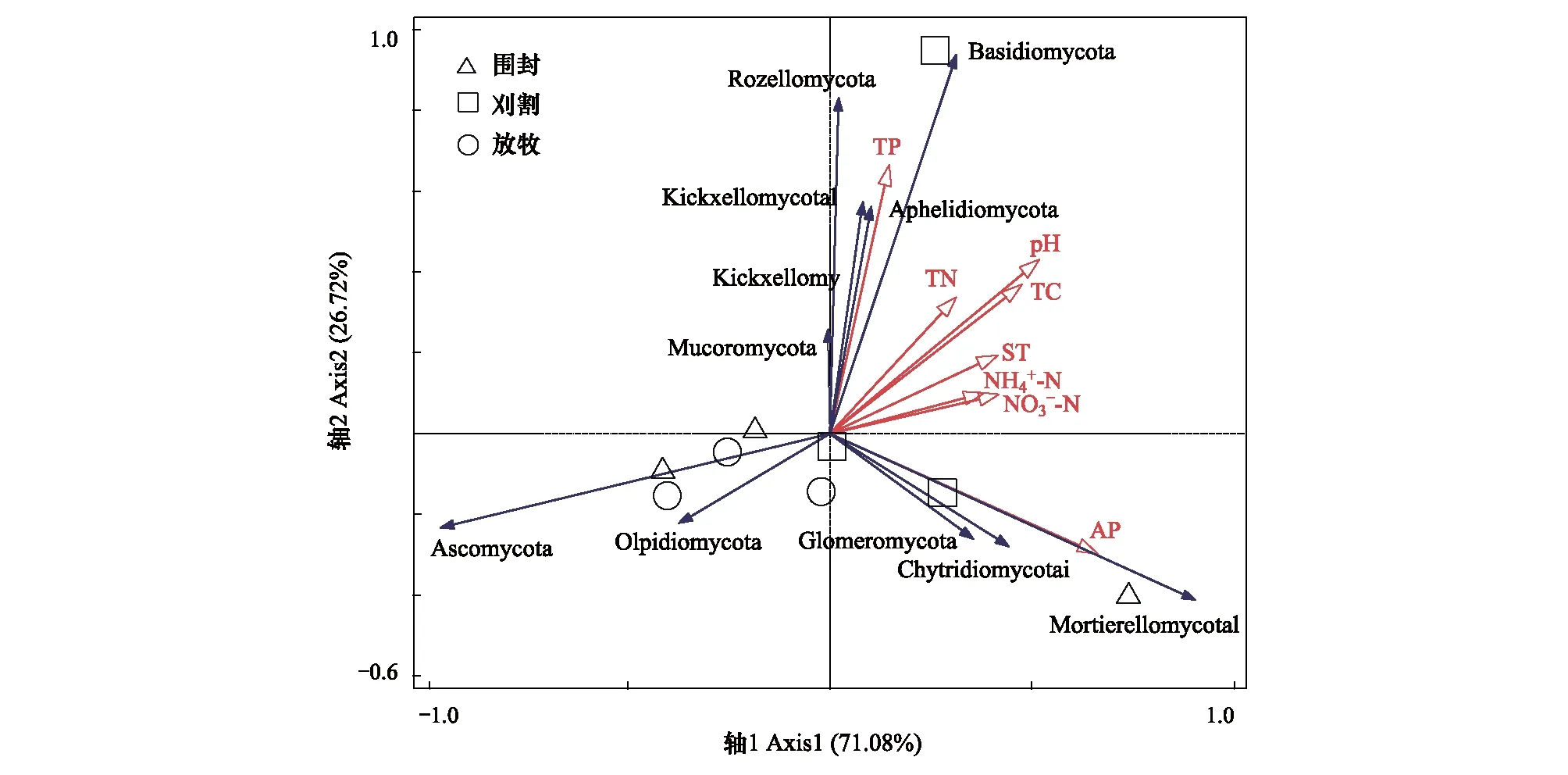
图6 土壤真菌群落与土壤理化性质的RDA分析Fig.6 RDA analysis of soil fungal community and soil physicochemical propertiesTP:全磷Total phosphorus;TN: 全氮Total nitrogen
3 讨论
3.1 利用方式对土壤理化性质的影响
放牧和刈割作为大针茅草原最主要的利用方式,对草地生态系统起到至关重要的作用,放牧主要通过家畜的粪尿和践踏影响草地养分循环[19],而刈割则是通过均匀的去除植物地上部分影响草地生态系统[20]。本研究表明,放牧显著降低了土壤总碳、总氮、有机碳含量,而刈割显著提高了土壤总碳含量,大针茅草原主要由多年生牧草,如大针茅、糙隐子草、羊草等组成,这些植物具有较高的地下生物量分配用于根系的发育,以便为来年植物的生长存储养分,因此,高强度放牧提高了植物地下碳的分配和对土壤碳的吸收,导致土壤有机碳含量下降[21—22]。植物残渣的分解是土壤碳储量的主要来源之一,而刈割仍会有少量植物残渣归还与土壤,并且刈割会导致植物根部死亡率提高,有利于土壤碳储量累积[23],同时,刈割有利于更多的微生物降解不稳定的有机碳,增加有机碳输入[24]。土壤氮素的输入主要取决于植物残渣返回土壤,还有一小部分来自大气沉积[25],张峰等人的研究表明,放牧显著降低凋落物量[26],导致草地养分返回减少,固氮能力下降,另一方面,放牧家畜的排泄物主要集中在棚圈中,也导致土壤氮素流失严重。此外,与铵态氮相比,植物主要吸收利用土壤中的硝态氮[25],长期放牧条件下,植物对土壤硝态氮的持续吸收以及固氮能力的不足导致其含量显著降低。土壤有机质分别通过在低养分条件下供应和在高养分条件下储存养分来发挥缓冲作用,并有助于将可溶性养分的可用性与植物需求同步,通过这种缓冲机制维持草地生态系统的碳、氮循环,但在重度放牧下,土壤有机质含量的显著降低导致碳、氮循环失衡[27],此外,放牧下土壤碳、氮损失可归因于土壤微生物群落结构的改变导致较低的真菌与细菌的比例[28—29]。
放牧对土壤物理性质的影响主要归因于动物践踏[30—31],随着放牧强度的增加,频繁的扰动可能会超过土壤的自然恢复能力,导致土壤结构恶化,进而导致水分渗透能力降低,同时,凋落物和植被盖度的降低导致裸露土壤的面积增加,从而增加日温度波动和日最高温度,进而导致土壤水分蒸发率更高[32],这些原因均导致放牧样地中土壤含水量显著降低[33]。本研究发现,放牧显著降低土壤pH,放牧导致根系分泌物和土壤呼吸产生更多的碳酸和有机酸等酸性物质,导致土壤酸化[34],而刈割显著提高土壤pH可能是由于刈割导致土壤有机氮的铵化作用增强,刈割下土壤铵态氮含量升高也证明了这一观点[35]。在本研究中,土壤理化因子,包括土壤总碳、有机碳、总氮、铵态氮、硝态氮、有效磷、水分及pH存在显著差异,这些差异可能导致了微生物群落结构和组成的差异。
3.2 利用方式对土壤微生物多样性及群落结构的影响
土壤微生物作为土壤系统的重要组成部分,通过调节土壤有机质和植物凋落物的分解以及植物养分的可用性,在草地生态系统中发挥着重要作用。本研究表明,刈割对土壤细菌群落多样性的影响有限,而土壤真菌多样性对刈割的响应更显著。刈割显著提高了土壤真菌α多样性,这一结果与Yu等人在高寒草甸的研究结果一致[36],可能是由于刈割后植物残渣的累积有利于真菌的聚集;此外,也有研究表明,刈割显著提高了丛枝菌根真菌的丰度和多样性,进而提高了土壤真菌的多样性[37]。而韦恩图表明,在放牧样地中特有的微生物OTU数最多,放牧条件下土壤受到的干扰最大,家畜的践踏、采食作用、排泄物以及人类活动导致土壤条件发生显著改变,进而导致微生物类群特异性最大[38]。
本研究区域内主要优势细菌类群为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria),主要优势真菌类群为子囊菌门(Ascomycota)和孢霉菌门(Mortierellomycota)。不同利用方式下部分微生物类群的相对丰度差异显著。放牧和刈割均显著提高了放线菌门和绿湾菌门(Chloroflexi)的相对丰度,二者中有很大一部分细菌可以通过光合作用获取能量并固定CO2[39—40],意味着其固碳能力提高,RDA分析结果也表明,土壤总碳和有机碳含量与放线菌门呈正相关关系,且放线菌门和绿湾菌门在有机物分解和营养循环中发挥重要作用。放牧和刈割均显著降低了厚壁菌门(Firmicutes)的丰度,许多植物致病菌属于厚壁菌门[41],说明刈割和放牧减小了土壤致病细菌对植物健康的威胁。放牧显著提高了变形菌门的丰度,其被认为可以降解土壤中更多的顽固性有机质,如甲壳素等[42—43],说明放牧下草地退化伴随着顽固性有机质输入的增加。同时,放牧还显著提高了疣微菌门(Verrucomicrobia)和芽单胞菌门(Gemmatimonadetes)的丰度,二者均是主要参与土壤氮循环的微生物类群,与土壤氮含量呈负相关,与前人的研究结果一致[44],以上结果表明,具有营养物质降解功能和较高代谢活性的微生物在放牧下生存良好,这一现象证实了放线菌门和变形菌门等对放牧条件下大针茅草原的生境条件具有良好的适应能力。刈割显著提高了担子菌门(Basidiomycota)的相对丰度,这是一类主要功能为分解植物木质化残渣的真菌类群,刈割后的植物残渣的增加导致了富集[45]。
由于土地利用方式的改变对土壤结构及养分状况的影响,土壤微生物组成也随之变化[46]。我们的研究表明,土壤性质解释了85.12%和97.8%的土壤细菌和真菌群落的变化,这表明微生物群落组成的变化与土壤性质有很大的相关性。RDA分析表明,土壤铵态氮和硝态氮含量是细菌群落最主要的影响因素,且与酸杆菌门呈正相关关系,酸杆菌门是一类寡营养型细菌,能利用铵态氮和硝态氮作为氮源[47],Yuan等也发现土壤铵态氮是影响青藏高原表层土壤细菌群落的主要环境因子,说明了土壤氮组分在细菌群落结构形成中的重要性[48]。土壤真菌群落主要受有效磷和硝态氮的影响,这一结果与Ding等的研究结果一致[49],土壤有效磷与真菌群落密切相关,说明土壤有效磷在建立土壤真菌群落中具有重要意义。本研究表明,细菌对铵态氮含量敏感,而真菌对硝态氮含量敏感,说明微生物对土壤不同形式氮的利用存在选择性。综上所述,不同利用方式下土壤微生物群落结构存在显著差异,土壤铵态氮、硝态氮和有效磷是土壤微生物群落形成和演化的主要驱动因素。
4 结论
不同利用方式显著改变了土壤微生物多样性及群落结构,刈割显著提高了土壤真菌α多样性指数。放牧显著提高了变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)和芽单胞菌门(Gemmatimonadetes)的相对丰度,刈割显著提高了放线菌门(Actinobacteria)、绿湾菌门(Chloroflexi)及担子菌门(Basidiomycota)的相对丰度,此外,放牧和刈割显著降低了厚壁菌门(Firmicutes)的相对丰度。土壤理化性质共解释了土壤细菌85.12%和真菌97.8%的变化,土壤细菌群落结构主要受硝态氮和铵态氮含量的影响,土壤真菌群落结构主要受有效磷和硝态氮含量的影响,土壤速效养分是不同利用方式下大针茅草原土壤微生物群落形成和演化的主要驱动因素。本研究揭示了不同利用方式下大针茅草原土壤微生物多样性及群落结构的变化及其主要驱动因素,为大针茅草原合理利用提供了理论依据。

