HOXC10通过靶向调控CST1的表达对肺癌细胞干细胞样特性的作用研究
康建军, 高 乐
(陕西省榆林市第一医院呼吸内科, 陕西 绥德 718000)
肺癌是全球最常见的癌症类型,死亡率高。2020年中国癌症新发病例数和癌症死亡病例数最高的均是肺癌[1]。尽管目前的放疗、化疗、靶向治疗等手段可以较好的控制肺癌进展,但癌症干细胞(Cancer stem cell,CSC)的存在常常引起肿瘤复发及化疗耐药。与普通肿瘤细胞相比,CSC显示出强大的自我更新和分化能力,虽然CSC在大多肿瘤中广泛报道,但在肺癌中关于CSC的具体作用调控机制还不甚清楚[2],故当前针对肺癌干细胞的靶向治疗十分迫切。HOXC10 基因是 HOX 基因家族的一员,在哺乳动物的生理过程中起着至关重要的作用,如肢体发育、肢体再生和腰椎运动神经元分化。HOXC10 还与血管生成、脂肪代谢和性别调节有关。HOXC10是一种重要的转录因子,可以通过调节ERK、AKT、p65和上皮间质转化相关基因等多种靶分子来激活多种致癌途径,还可通过促进DNA修复途径诱导肿瘤耐药性,近期研究人员将HOXC10报告为NSCLC细胞中一种新的肿瘤促进癌基因[3],而HOXC10的异常高表达是否影响肿瘤干细胞仍无研究报告。胱抑素SN(胱抑素1,CST1)促进多种癌症的进展[4],CST1对甲状腺乳头状癌细胞生长、侵袭、迁移、上皮间质转化和干性等具有重要调控功能[5]。研究发现,HOXC10可以通过调控CST1的水平影响胃癌细胞的迁移和增殖[6]。但目前尚无文献报道HOXC10和CST1与肺癌干细胞的关系,我们猜想HOXC10是否可以调控CST1进而影响肺癌细胞干性。为此,本研究探讨HOXC10通过调控CST1的表达,对肺癌细胞干性的影响,为针对肺癌干细胞治疗提供新的策略。
1 材料与方法
1.1细胞系及试剂:人肺癌细胞系A549(CL-0016)购买武汉普诺塞公司。胎牛血清购买自Hyclone公司,DMEM培养基和DMEM-F12培养基购买自江苏凯基生物技术股份有限公司,总RNA提取试剂TRIzol购自美国Invitrogen公司,Primescript RT逆转录试剂盒购自北京智杰远科技有限公司,CCK-8试剂盒购自Biosharp公司,qPCR引物由金唯智生物科技有限公司合成。ShNC、ShHOXC10慢病毒载体由上海吉玛基因负责构建和包备,CST1过表达载体pcDNA3.1-CST1由本实验室构建、PGL6-CST1-2000荧光报告质粒由本实验构建,Lipofectamine 2000购自日本TaKaRa公司,一抗Actin Beta(#4970)、SOX2(#3579)、Nanog(#8822)、OCT4(#2750)、CD44(#96848)、CD133(#64326)均购买自CST,HOXC10(ab153904)购买自Abcam公司。
1.2细胞培养及转染:人肺癌细胞系A549在常规条件下(DMEM培养液中胎牛血清浓度为10%,5% CO2,37℃)过夜培养,待细胞生长至对数生长期时备用。按照吉玛基因给的慢病毒感染操作手册,构建ShNC和ShHOXC10细胞,感染48h后使用2μM嘌呤霉素筛选2周。生长至对数生长期时用胰酶消化、计数,然后接种于6孔板,培养24h以备转染。严格按照Lipofectamine 2000试剂盒说明书将转染pcDNA3.1-CST1至ShHOXC10 A549细胞,转染48h后在荧光显微镜下观察细胞的转染效果,并通过qPCR和蛋白质印记法检测各组细胞的转染效率。
1.3CCK-8细胞增殖检测:ShNC、ShHOXC10、ShHOXC10+OE_CST1组细胞以每孔2000个细胞接种于96孔板中,每孔体积为100ul,设置6个平行实验对照。在细胞孵育0h、24h、48h、72h、96h、120h时,每孔添加10μL CCK-8溶液,将细胞在37℃下孵育2h,并在酶标仪中于450nm波长读取吸光度。
1.4CST1启动子活性检测载体构建:使用赛默飞的基因组DNA纯化试剂盒(K0512)提取A549细胞基因组,PCR法扩增CST1基因上游2000BP启动子序列(F:cccaagcttatggagaccaaacgggt,R:cgcggatcctcaaaggtccaagattttca),克隆插入PGL6荧光素报告载体。
1.5蛋白质印记法检测CD44、CD133等蛋白表达:胰酶消化人肺癌A549细胞,离心5min,PBS溶液洗涤,弃上清,重覆3次。提取各组细胞总蛋白,用BCA法测定蛋白浓度。每组取50μg进行SDS-PAGE分离蛋白条带,用湿转法将目的蛋白转移至0.45um的PVDF膜上,5%脱脂奶粉室温封闭2h,加入一抗(1∶500),4℃孵育过夜;次日,TBST洗涤3次,加入HRP标记的二抗,室温孵育2h;TBST洗涤3次后加入ECL化学发光液进行显影,然后在凝胶成像仪上观察拍照。
1.6肿瘤成球分析:在人肺癌细胞A549状态良好时使用胰蛋白酶-EDTA溶液消化贴壁生长的各组细胞,在非粘附的24孔板中每孔接种500个细胞,然后在含有B27(20ng/mL)和表皮生长因子(10ng/mL)的无血清DMEM-F12培养基中培养。每两天后,通过添加新鲜的无血清培养基补充旧培养基,而无需去除旧培养基。培养14d后计数大于100μm的球体,每孔设置三个平行,并重复三遍。后续下游实验均采用体积大于100μm的肿瘤球。细胞球形成效率(Sphere Formation Efficiency,SFE):SFE=每孔中直径大于100μm的细胞球的个数/每孔中原始接种细胞的总数
1.7双萤光素酶报告基因检测:HEK293T细胞转染PGL6-CST1-2000荧光素酶报告基因质粒,用PBS洗涤,并用裂解缓冲液裂解。13000g,5min离心收集上清液,并按照制造商的说明进行双荧光素酶测定(Promega)。转染效率通过海肾荧光素酶的共表达进行标准化。
1.8肺癌小鼠皮下瘤模型构建:BALB/c免疫缺陷雌鼠12只,3~4周龄,体重为12~15g,由西安交通大学实验动物中心提供。将12只小鼠随机均分为两组:ShNC组(接种ShNC A549细胞)、ShHOXC10组(接种ShHOXC10 A549细胞)。收集生长状态良好,细胞活率>98%的两组细胞,以1×107个/100μL/只接种于小鼠右侧腋窝皮下,当有肿瘤块生成时,用游标卡尺测量肿瘤体积,肿瘤体积计算(V=1/2LS2,L长径,S短径)。接种30d后脱颈处死全部小鼠,测量瘤体重量。
1.9免疫组化:肺癌小鼠肿瘤组织用固定剂(甲醇:丙醇,1∶1)固定,切片和复水后用0.3%Triton X-100孵育。用anti-HOXC10、anti-CST1、anti-CD44、anti-CD133抗体进行免疫组织化学检测。
1.10统计学处理:使用SPSS20软件进行实验数据分析,采用GraphPad7.0软件进行相关图片绘制。所有实验独立重复3次,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05表示差异具有统计学意义。
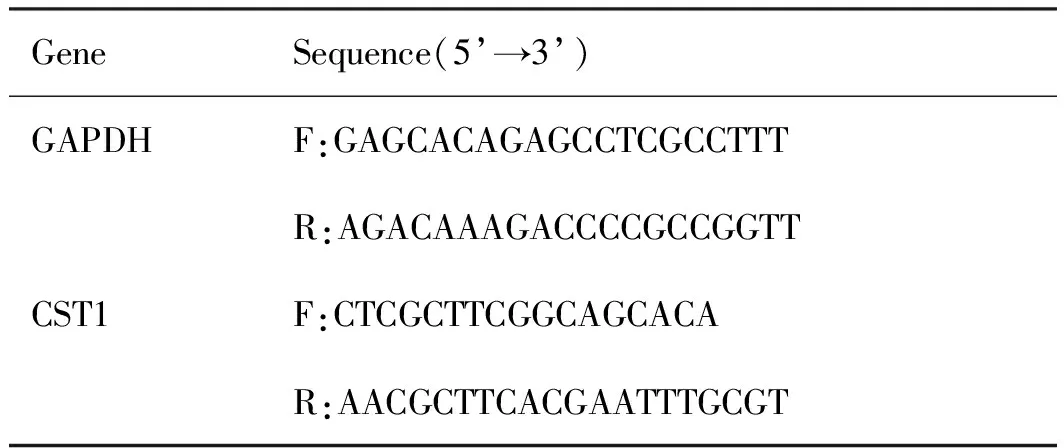
表1 qPCR引物
2 结 果
2.1HOXC10调控肺癌细胞干细胞样特征:通过无血清富集培养,在A549肺癌细胞系中成功生长出肿瘤球(图1A)。Western Blotting结果显示,HOXC10在肿瘤球中的蛋白表达水平高于贴壁细胞部分,且干性标志蛋白CD44、CD133、SOX2、Nanog、OCT4等蛋白水平在肿瘤球部分也显著提升(图1B)。当在A549细胞中敲低HOXC10时,相较于ShNC组,ShHOXC10组的干性标志蛋白CD44、CD133、SOX2、Nanog、OCT4明显下调(图1C)。肿瘤成球实验显示,ShHOXC10组(1.48%±0.16)细胞肿瘤成球能力显著低于ShNC组(3.89%±0.38)细胞(P<0.001,图1D),细胞活力实验显示,相较于ShNC组,ShHOXC10组细胞活力在第3天后显著降低(图1E)。上述结果表明,HOXC10在肺癌细胞系A549的肿瘤球部分显著上调,敲低HOXC10可抑制干性标志蛋白CD44、CD133、SOX2、Nanog、OCT4等表达,抑制A549细胞的细胞增殖和肿瘤成球能力。
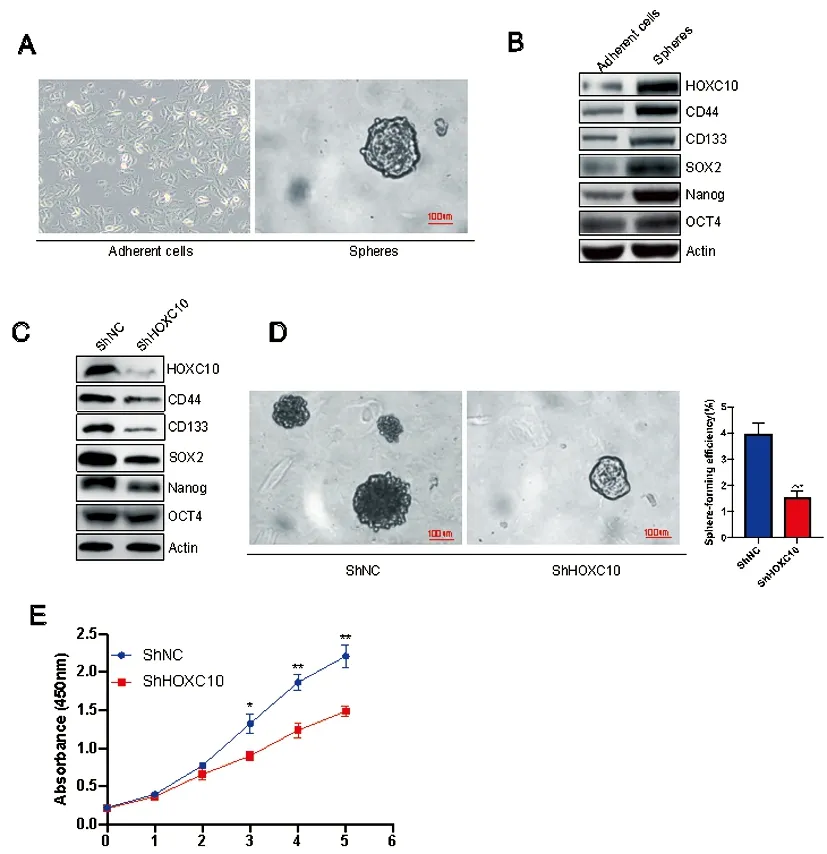
图1 HOXC10调控肺癌细胞干细胞样特征
2.2敲除HOXC10可减少肺癌细胞小鼠成瘤能力及干性特征:测定肿瘤细胞成瘤能力分析结果显示,相较于ShNC组小鼠,ShHOXC10组小鼠的肿瘤体积显著减小(P<0.01,图2A、2B)。测定肿瘤重量结果显示,ShHOXC10组(1.47±0.23g)小鼠的肿瘤重量显著低于ShNC组(0.45±0.19g)小鼠(P<0.0001,图2C)。此外,免疫组化实验结果显示相对于ShNC组,ShHOXC10组小鼠肿瘤组织中的HOXC蛋白显著下调,并且CST1、CD44、CD133蛋白水平也明显降低(图2D)。上述结果表明,敲除HOXC10抑制A549细胞在小鼠中的肿瘤体积与重量,并且抑制干性标志蛋白CD44、CD133和CST1的表达。
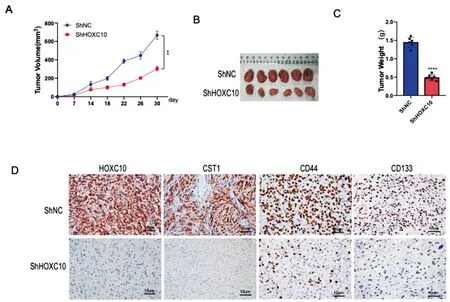
图2 敲除HOXC10可减少肺癌细胞小鼠成瘤能力及干性特征
2.3HOXC10调控CST1转录:qPCR结果显示,ShHOXC10组(0.34±0.15)A549细胞中CST1 mRNA水平显著低于ShNC组(0.97±0.21)(P<0.01,图3A)。Western Blotting检测结果显示,相较于ShNC组,ShHOXC10组的CST1蛋白表达水平降低(图3B)。ChIP-PCR和ChIP-qPCR结果显示,HOXC组成功富集到大量CST1启动子序列(P<0.01,图3C、3D)。双荧光素酶报告实验显示,ShHOXC10组(0.46±0.23)中的CST1启动子活性显著低于ShNC组(0.96±0.18)(P<0.01,图3E)。上述结果表明,在肺癌细胞A549中,敲低HOXC10,CST1的mRNA和蛋白水平均明显下调,并且HOXC10与CST1的启动子序列结合,敲低HOXC10后,CST1的启动子活性被显著下调。
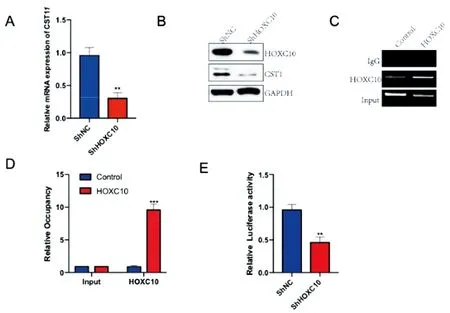
图3 HOXC10调控CST1转录

图4 过表达CST1逆转HOXC10调控A549细胞干细胞样性状
2.4过表达CST1逆转HOXC10调控A549细胞干细胞样性状:WesternBlotting检测结果显示,相较于ShNC组,ShHOXC10组细胞中CST1、CD44、CD133、Nanog、SOX2、OCT4蛋白水平明显降低,但是过表达CST1后,ShHOXC10+OE_CST1组细胞中CD44、CD133、Nanog、SOX2、OCT4等蛋白水平显著高于ShHOXC10组,与ShNC组表达水平无明显差异(图4A)。肿瘤成球实验显示,相较于ShNC组(4±0.36)%,ShHOXC10组(1.2±0.24)%细胞肿瘤成球能力显著降低;而ShHOXC10+OE_CST1组(3.9±0.15)%细胞的肿瘤成球能力显著高于ShHOXC10组,与ShNC组无显著差异(P>0.05,图4B)。CCK8实验结果显示,ShHOXC10组细胞增殖能力显著低于ShNC组和ShHOXC10+OE_CST1组细胞(P<0.01,图4C)。上述结果表明,过表达CST1可以上调CD44、CD133、Nanog、SOX2、OCT4蛋白水平,增强A549细胞的肿瘤成球能力和细胞增殖能力。
3 讨 论
肺癌是最常见肿瘤发病率和死亡率极高。虽然放疗和化疗能在一定程度上延缓肿瘤进展,但患者的五年生存率仍不足15%。研究发现肿瘤干细胞的存在是肺癌耐药和复发的重要原因。原癌基因HOXC10在多种肿瘤中被异常激活或高表达,参与肿瘤的发生发展过程,通过抑制肿瘤细胞的分化与增殖调控肿瘤细胞的命运。之前的研究表明HOXC10对绵羊骨髓间充质干细胞(sBMSCs)增殖和成脂分化起着至关重要的作用[7];研究人类胎盘的间充质干细胞(MSC)中的HOX基因发现,HOXC10在羊膜来源的MSC中高表达;并且HOXC10还可维持小鼠MSC的干性,抑制其成骨分化潜能[8]。这充分表明了HOXC10在维持干细胞干性,抑制分化的潜能,但没有文献报告肿瘤组织中异常升高的HOXC10是否和肿瘤干细胞有关。本研究表明在肺癌A549细胞系形成的肿瘤球中HOXC10和肿瘤干细胞蛋白标志CD44、CD133、Nanog、SOX2、OCT4等表达水平显著高于正常贴壁A549细胞。当在肺癌细胞系A549中敲低HOXC10的表达,我们发现A549细胞的肿瘤成球能力显著降低,且肿瘤球内的肿瘤干细胞蛋白标志CD44、CD133、Nanog、SOX2、OCT4等表达水平显著降低。相较于ShNC组,ShHOXC10组细胞的增殖能力也显著降低。这表明HOXC10可促进肺癌细胞A549的增殖能力和肿瘤成球能力,并且调控肿瘤干细胞蛋白标志CD44、CD133、Nanog、SOX2、OCT4等的表达,HOXC10可调控肺癌干细胞性状。
进一步通过构建肺癌小鼠皮下瘤模型研究发现,ShHOXC10组A549细胞肿瘤体积和大小均显著低于ShNC组A549细胞,说明敲低HOXC10抑制了A549细胞的肿瘤形成能力。肿瘤组织免疫组化实验显示,ShHOXC10组肿瘤组织内的HOXC10表达水平显著低于ShNC组,且细胞增殖指标Ki67在ShHOXC10组也显著降低,干细胞标志蛋白CD44和CD133也发生显著的下降。至此,体内实验进一步显示,HOXC10的敲低抑制了肿瘤形成能力和对干细胞样特性的调控。
Cystatin SN(胱抑素1,CST1)是胱抑素超家族的成员,可抑制半胱氨酸蛋白酶的蛋白水解活性。CST1是一种肿瘤生物标志物,可为食管癌、胃癌和结直肠癌、胰腺癌的诊断提供有用的信息。CST1在肿瘤中的异常高表达受上游转录因子、MicroRNA等的调控,在结肠癌研究中发现MicroRNALet-7d通过CST1/P65通路调控结肠癌细胞增殖,HOXC10在胃癌中通过转录水平调控CST1促进肿瘤细胞增殖和迁移。我们研究发现在肺癌细胞中敲低HOXC10,CST1在mRNA和蛋白水平均发生下调,随后通过ChIP-PCR和ChIP-qPCR实验发现,HOXC10可以和CST1上游启动子序列结合,表明HOXC10与CST1基因直接结合,发挥直接调控作用。在HEK293T中通过双荧光素酶报告实验发现,敲低HOXC10直接下调了CST1的启动子活性。表明在肺癌细胞A549中HOXC10直接结合CST1上游启动子序列,从而调控CST1基因的表达。接着为了探究HOXC10可通过CST1调控肺癌细胞干细胞样特征,进行回补实验,在ShHOXC10的基础上进行CST1过表达,结果显示过表达CST1可以逆转由敲低HOXC10下调的干细胞标志蛋白CD44、CD133、Nanog、SOX2、OCT4表达水平,且细胞肿瘤成球能力和增殖能力也显著恢复。表明在肺癌细胞A549中 HOXC10通过CST1调控的干细胞样特征。综上所述,在肺癌细胞中,HOXC10异常高表达,通过调控CST1基因转录,从而促进肺癌细胞干细胞样特性。

