异鼠李素对子宫腺肌病小鼠子宫的作用
唐 静 ,侯俊芳 ,郭 艳 ,李永海
1.开封市人民医院妇科,开封 475002;2.开封市人民医院检验科,开封 475002;3.新乡医学院干细胞与转化医学研究中心,新乡 453000
子宫腺肌病(adenomyosis,AM)好发于30~50岁的经产妇,且发病率呈逐年上升趋势,临床表现为痛经、月经量过大、子宫不规则出血及不孕等[1]。研究表明,AM 的发生与子宫内膜的腺体、基质具有侵袭性密切相关[2],上皮间质转化及细胞凋亡学说备受关注。异鼠李素(isorhamnetin,Iso)属黄酮类化合物,提取自沙棘、银杏等的叶、花、果实,具有降血脂、降血压、抗炎、抗病毒及抗癌等作用,有研究发现其可通过抑制肿瘤细胞上皮间质转化过程,诱导肿瘤细胞凋亡[3]。本研究通过构建AM 小鼠模型,观察Iso对其子宫异位内膜侵袭性与子宫内膜细胞凋亡的影响,并探讨可能的机制。
1 仪器与材料
1.1 仪器
HM325型轮转式石蜡切片机(德国美康公司);CX23型光学显微镜(日本奥林巴斯株式会社);Glite UV 凝胶成像系统(江苏伟禾生物科技有限公司)。
1.2 试药
异鼠李素(上海西格生物科技有限公司);干扰素γ(interferon-γ,IFN-γ)、白细胞介素-4(interleukin-4,IL-4)ELISA 试剂盒均购自上海广锐生物科技有限公司;Tunel细胞凋亡原位检测试剂盒(美国Abcam 公司);兔抗小鼠P53-273H、上皮生长因子受体(epithelial growth factor receptor,EGFR)、p-EGFR、转录信号转导子与转录激活子3(signal transducer and activator of transcription 3,STAT3)、p-STAT3 一 抗,均购自美国Assay Designs公司。
1.3 动物
SPF级未孕ICR 雌鼠60 只,8 周龄,体质量为(32±3) g,ICR雄鼠25只,8周龄,体质量为(40±4) g。均购自上海砥石生物科技有限公司,生产许可证号SCXK(沪)2021-0003。
2 方法
2.1 构建AM 模型
用异体垂体移植术构建AM 模型[4]。腹腔注射戊巴比妥钠麻醉雌鼠,分离腹部皮肤层与皮下肌层,游离子宫,确认膀胱下子宫分叉位置。处死同周龄ICR雄鼠,开颅,取出垂体组织,分成2份,分别与少量生理盐水混合后,经套管针将垂体悬浊液0.5 mL推注至雌鼠右侧宫腔,同时退出内芯与针头,将子宫放回腹腔中,常规预防感染,关腹。
2.2 分组及干预
从60只雌性未孕ICR 小鼠中随机抽取10只作为对照组,其余50 只构建AM 模型。构建模型后3个月从建模小鼠中随机抽取10只分离异位组织,经HE染色观察证实造模成功,其余40只随机分为AM组,Iso低、中和高剂量组,每组10只。Iso低、中和高剂量组用质量浓度5 g·L-1Iso+羧甲基纤维素钠混悬液1 mL灌胃,剂量分别为25、50、100 mg·kg-1[5],对照组、AM 组用等体积质量浓度5 g·L-1羧甲基纤维素钠溶液灌胃。每日1次,连续干预2个月。
2.3 检测血清IFN-γ、IL-4水平
末次干预后次日,腹腔注射戊巴比妥钠麻醉小鼠,心脏采血0.8 mL,室温静置后以3 000 r·min-1离心分离血清。用ELISA 检测血清IFN-γ、IL-4水平,按照试剂盒说明书中的步骤操作,测定490 nm处的吸光度,根据标准曲线计算血清IFN-γ、IL-4水平。
2.4 组织取材
血液采集完成后,颈椎脱臼处死小鼠,开腹剖取子宫,取子宫在位内膜置于质量浓度40 g·L-1的多聚甲醛中固定48 h,用自来水将固定液冲洗干净,用酒精梯度脱水,依次用二甲苯Ⅰ、Ⅱ透明、浸蜡包埋,用切片机切成厚4 μm 的切片用于Tunel染色;取子宫异位内膜分为2份,一份同法切片用于HE 染色,一份保存于液氮中用于蛋白表达水平的检测。
2.5 Tunel染色法检测子宫内膜细胞凋亡率
取子宫在位内膜切片,脱蜡水洗,加Tunel反应混合液,37 ℃湿盒孵育1 h,用PBS冲洗,加碱性磷酸酶抗体,37 ℃孵育0.5 h,用PBS冲洗,加2滴碱性磷酸酯酶底物BCIP/NBT,室温孵育20 min,用PBS冲洗,用苏木素复染,脱水干燥,封片。阳性标准为显微镜下观察到细胞核被染成棕色或棕黑色。每张切片任选5个不相邻视野,以平均每1 000 个细胞中Tunel阳性细胞所占百分比为凋亡率,求均值。凋亡率=(阳性细胞数÷细胞总数)×100%。
2.6 HE染色法观察子宫异位内膜侵袭性
取异位内膜切片,常规脱蜡,用自来水冲洗,用苏木精染液染色,用自来水冲洗,用盐酸酒精冲洗3 s,再用自来水冲洗,用Scott蓝化液反蓝,用自来水冲洗,用伊红染液染色,经常规脱水、透明,用中性树胶封片,于光镜下观察子宫异位内膜侵袭性。根据AM 5级标准分级方式观察子宫内膜侵袭性:正常子宫为0分;内膜间质向肌肉内层侵入为1分;内膜间质及腺体向肌肉内层侵入为2分;内膜组织向内外肌层交界位置侵入为3分;内膜腺体囊性增生,并可观察到浆膜下结节为4分。
2.7 免疫印迹法检测子宫内膜组织相关蛋白表达量
取保存于液氮中的子宫异位内膜组织,加入PBS匀浆,用RIPA 细胞裂解液裂解,提取总蛋白,离心取上清,用BCA 试剂盒进行定量检测。取50 μg待测蛋白,混合5倍体积上样缓冲液,沸水浴10 min,离心、电泳、转至PVDF 膜,加入质量浓度50 g·L-1脱脂奶粉,置于摇床中(室温)封闭2 h,洗涤后加入兔抗小鼠 P53-273H、EGFR、p-EGFR、STAT3、p-STAT3一抗(1∶500),4 ℃孵育过夜,加入山羊抗兔IgG 二抗(1∶2 000),常温孵育2 h,洗涤后加入ELC发光液,暗室曝光,用凝胶成像系统扫描并进行分析。蛋白的相对表达量=待测蛋白条带的灰度值÷GADPH 条带的灰度值。
2.8 统计学方法
3 结果
3.1 血清IFN-γ、IL-4水平比较
与对照组比较,AM 组血清IFN-γ水平降低,IL-4水平升高(P<0.05);与AM 组比较,Iso低剂量组血清IFN-γ水平升高,IL-4水平降低(P<0.05);与Iso低剂量组比较,Iso中剂量组血清IFN-γ水平升高,IL-4水平降低(P<0.05);与Iso中剂量组比较,Iso高剂量组血清IFN-γ水平升高,IL-4水平降低(P<0.05)。结果见表1。
表1 各组血清IFN-γ、IL-4水平比较 (n=10,)Tab.1 Comparison of serum IFN-γ and IL-4 levels in each group (n=10,)

表1 各组血清IFN-γ、IL-4水平比较 (n=10,)Tab.1 Comparison of serum IFN-γ and IL-4 levels in each group (n=10,)
注:与对照组比较,aP<0.05;与AM 组比较,bP<0.05;与Iso低剂量组比较,cP<0.05;与Iso中剂量组比较,dP<0.05。
3.2 子宫内膜细胞凋亡率比较
与对照组比较,AM 组子宫内膜细胞凋亡率降低(P<0.05);与AM 组比较,Iso低剂量组子宫内膜细胞凋亡率升高(P<0.05);与Iso低剂量组比较,Iso中剂量组子宫内膜细胞凋亡率升高(P<0.05);与Iso中剂量组比较,Iso高剂量组子宫内膜细胞凋亡率升高(P<0.05)。结果见表2、图1。
表2 各组子宫内膜细胞凋亡率比较 (n=10,)Tab.2 Comparison of apoptosis rate of endometrial cells in each group (n=10,)

表2 各组子宫内膜细胞凋亡率比较 (n=10,)Tab.2 Comparison of apoptosis rate of endometrial cells in each group (n=10,)
注:与对照组比较,aP<0.05;与AM 组比较,bP<0.05;与Iso低剂量组比较,cP<0.05;与Iso中剂量组比较,dP<0.05。

图1 Tunel染色检测子宫内膜细胞凋亡情况 (×400)Fig.1 Endometrial cell apoptosis detected by Tunel staining (×400)
3.3 子宫异位内膜侵袭性比较
与AM 组比较,Iso低剂量组子宫异位内膜侵袭性评分降低(P<0.05)。
与Iso低剂量组比较,Iso中剂量组子宫异位内膜侵袭性评分降低(P<0.05)。
与Iso中剂量组比较,Iso高剂量组子宫异位内膜侵袭性评分降低(P<0.05)。
结果见表3、图2。

图2 HE染色检测子宫异位内膜侵袭性 (×200)Fig.2 HE staining to detect the invasiveness of ectopic endometrium (×200)
表3 各组异位内膜侵袭性比较 (n=10,)Tab.3 Comparison of ectopic endometrium invasiveness in each group (n=10,)
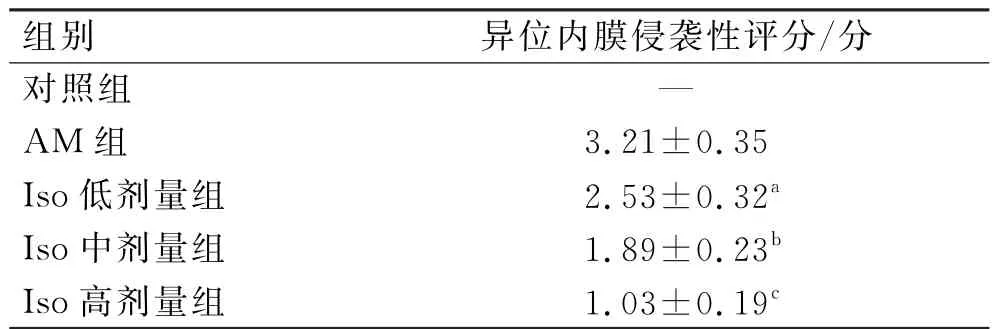
表3 各组异位内膜侵袭性比较 (n=10,)Tab.3 Comparison of ectopic endometrium invasiveness in each group (n=10,)
注:与AM 组比较,aP<0.05;与Iso低剂量组比较,bP<0.05;与Iso中剂量组比较,cP<0.05。
3.4 子宫内膜组织中P53-273H 蛋白表达量,p-EGFR/EGFR、p-STAT3/STAT3的比较
与对照组比较,AM 组P53-273H 蛋白的表达量及p-EGFR/EGFR、p-STAT3/STAT3升高(P<0.05);与AM 组比较,Iso低剂量组P53-273H 蛋白的表达量及p-EGFR/EGFR、p-STAT3/STAT3降低(P<0.05);与Iso低剂量组比较,Iso中剂量组P53-273H 蛋白表达量及p-EGFR/EGFR、p-STAT3/STAT3降低(P<0.05);与Iso中剂量组比较,Iso高剂量组P53-273H 蛋白的表达量及p-EGFR/EGFR、p-STAT3/STAT3 降低(P<0.05)。结果见表4、图3。
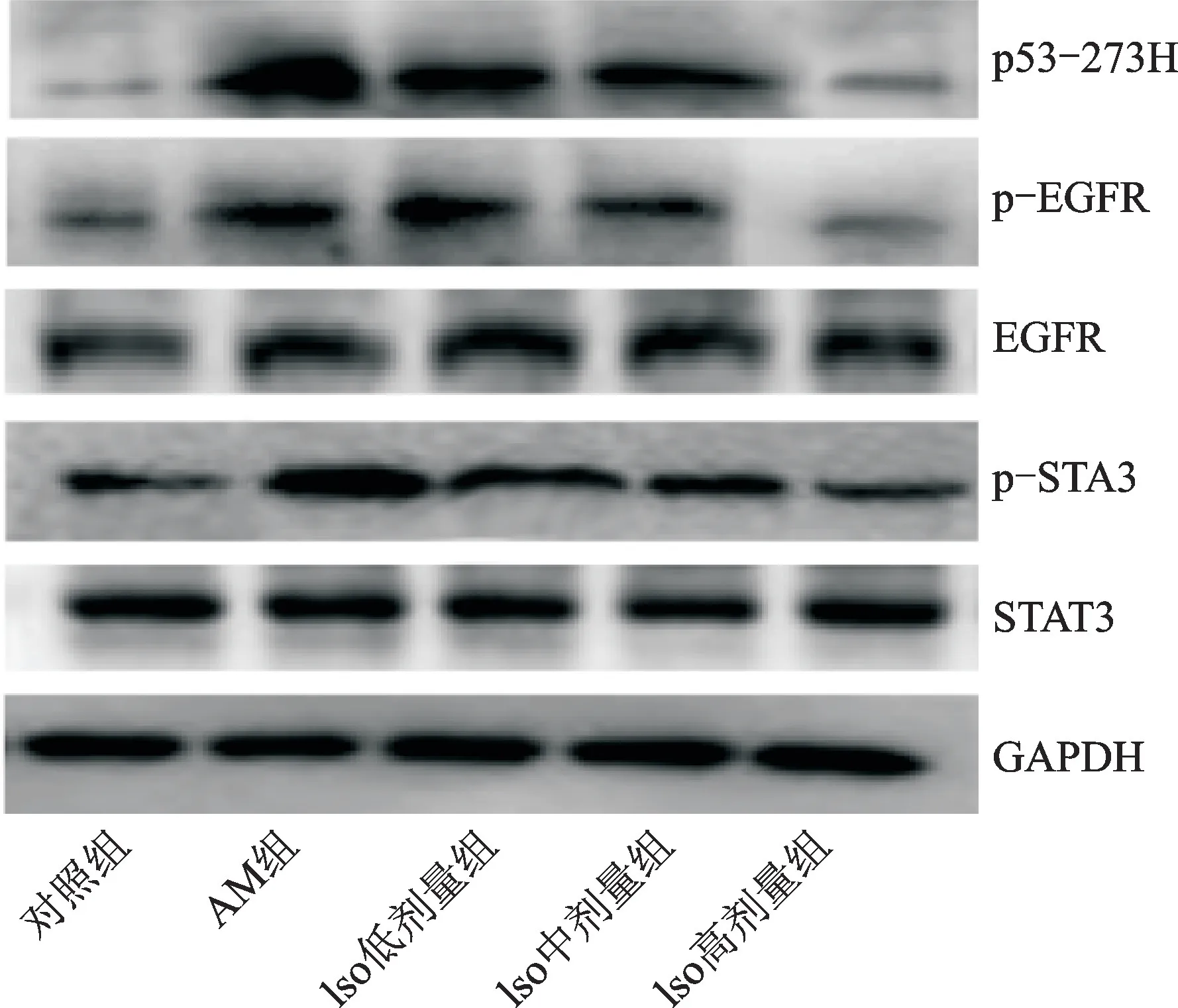
图3 免疫印迹法检测子宫内膜组织中P53-273H、p-EGFR、EGFR、p-STAT3、STAT3蛋白的表达量Fig.3 Expression of P53-273H,p-EGFR,EGFR,p-STAT3,STAT3in endometrial tissue by Western blot
表4 大鼠子宫内膜组织中P53-273H 蛋白表达量及p-EGFR/EGFR、p-STAT3/STAT3的比较 (n=10,)Tab.4 Comparison of P53-273H protein expression,p-EGFR/EGFR and p-STAT3/STAT3 in rat endometrium(n=10,)

表4 大鼠子宫内膜组织中P53-273H 蛋白表达量及p-EGFR/EGFR、p-STAT3/STAT3的比较 (n=10,)Tab.4 Comparison of P53-273H protein expression,p-EGFR/EGFR and p-STAT3/STAT3 in rat endometrium(n=10,)
注:与对照组比较,aP<0.05;与AM 组比较,bP<0.05;与Iso低剂量组比较,cP<0.05;与Iso中剂量组比较,dP<0.05。
4 讨论
AM 是一种常见的妇科良性疾病,通常认为其病因与子宫内膜黏膜下层缺失、基底层在刺激下向深层及平滑肌束间侵袭、影响间质细胞与上皮细胞功能有关,伴有浸润、血管增殖、种植及黏连周围组织等肿瘤特性[6-7]。目前AM 保守治疗药物易引起雌激素水平降低,用药时间及范围限制较大,且停药后容易复发[8]。因此,探究AM 异位内膜侵袭性及子宫内膜细胞凋亡的可能机制,研究相对安全的中药单体对该病的治疗十分必要。
IFN-γ是辅助T1样细胞、自然杀伤细胞被激活后释放的单糖蛋白,可间接活化巨噬细胞、中性粒细胞,增强其吞噬能力及抗病毒能力,是机体重要的免疫调控因子[9]。
IL-4是Th2细胞标志性细胞因子,研究表明其在AM 患者外周血及异位子宫内膜组织中的表达水平明显升高,表明AM 伴有局部或全身的Th2型免疫应答系统活化[10]。子宫内膜组织维持正常结构与功能的关键在于内膜细胞发生自发性凋亡,AM 患者内膜细胞凋亡异常导致子宫基底层防御功能及内膜内环境被破坏,内膜组织穿透基底层侵入子宫肌层并发生失控性增长[11-12]。
Iso是一种广泛存在于自然界中的天然甲基化黄酮类化合物,以往关于其的研究多集中在抗肿瘤、改善糖代谢等方面,而AM 以子宫内膜向肌层浸润性生长为主要病理表现,增殖特性与恶性肿瘤具有相似性[13-15]。本研究结果显示,Iso可提高AM 小鼠血清IFN-γ水平、子宫内膜细胞凋亡率,降低IL-4水平、异位内膜侵袭性评分,提示Iso可改善AM 免疫功能,促进子宫内膜细胞凋亡,并降低异位内膜侵袭性。
p53是机体中重要的凋亡调节因子,突变型p53(P53-273H)在细胞周期中的作用与野生型p53 相反,其对细胞生长的抑制作用减弱,且对细胞过度增殖具有促进作用[16-17]。EGFR 主要分布于上皮来源细胞的细胞膜表面,其高表达可降低细胞间的黏附性,促进其移向细胞质中,从而促进上皮间质转化,引发侵袭、迁移等生物学行为。AM 子宫内膜组织的上皮及腺体中均有EGFR 的表达,且其表达量显著高于在正常及子宫在位内膜中的表达量[18]。AM 中突变型p53(P53-273H)的表达水平明显升高,并通过上调EGFR促进STAT3磷酸化,导致病灶细胞异常生长,形成异位内膜[19]。本研究结果发现,AM 组P53-273H 蛋白表达量及p-EGFR/EGFR、p-STAT3/STAT3均高于对照组,经Iso干预后有所降低,且表现为剂量依赖性,提示Iso对AM 的治疗作用可能通过抑制p53/EGFR/STAT3信号通路来实现[20]。
综上所述,Iso可降低AM 小鼠子宫异位内膜侵袭性,促进子宫内膜细胞发生凋亡,推测其作用机制与抑制p53/EGFR/STAT3信号通路有关。

