抗Jo-1抗体和抗SRP抗体共存皮肌炎并发干燥综合征1例报告及文献复习
谭声海,袁 艺,张彦东,谷三炜,姜振宇
(吉林大学第一医院风湿免疫科,吉林 长春 130021)
特发性炎性肌病(idiopathic inflammatory myopathy,IIM)是一组骨骼肌非化脓性炎症性疾病,其特征是原因不明的近端肌无力。根据组织病理学结果,可以分为多发性肌炎(polymyositis,PM)、皮肌炎(dermatomyositis,DM)、包涵体肌炎(inclusion body myositis,IBM)和免疫介导性坏死性肌炎 (immune-mediated necrotizing myopathy,IMNM)[1],通常可在 IIM 患者的血清中检测到一些特定的自体抗体,如抗氨基酰转运RNA合成酶抗体,包括抗Jo-1(histidyl)、PL-7(threonyl)、PL-12(alanyl)、 OJ(isoleucyl)、EJ(glycyl)、KS(asparaginyl)、Zo(phenylalanyl) 和Ha(tyrosyl)抗体,上述抗体阳性的患者通常表现为发热、肺间质病变、关节炎、“技工手”和雷诺现 象[2]。 抗 信 号 识 别 颗 粒 (signal recognition particle,SRP)抗体阳性的患者通常表现为肌炎急性或亚急性发作,通常累及心脏,但皮疹和肺间质病变少见,关节炎和雷诺现象极少见,并且对皮质类固醇治疗反应不佳[3-5]。目前对于双抗体阳性DM报道不多,仅见于极少数个案报道[6-8],并发干燥综合征(Sjogren’s syndrome,SS)者,目前尚未见相关报道,其发病机制和详尽的诊治过程也鲜有提及。IIM患者中通常只能检测出1种肌炎特异 性 抗 体 (myositis-specific antibodies, MSAs),同时出现2种或2种以上MSAs极为罕见,原因不明。本研究报告1例抗Jo-1和抗SRP抗体双阳性的DM并发SS患者,该患者具有DM、IMNM和SS的共同临床表现,现对其诊疗经过进行分析,以增强风湿免疫科医生对此类疾病的认识,提升对该病的诊治水平。
1 临床资料
1.1 一般资料 患者,女性,52岁,因间断咳嗽、咳痰和气短伴全身乏力2个月于2021年1月1日入院。该患者于2个月前无明显诱因出现咳嗽、咳痰和气短,并伴全身乏力,咳嗽呈阵发性,与吸入刺激性气味无关,咳少许白色黏痰,伴呼吸困难,自觉全身乏力,活动后呼吸困难更为明显且进行性加重,遂至本院门诊就诊。肺CT提示:双肺散在炎变,其内有间质性改变。入住本院呼吸科,给予抗感染(氨苄西林、更昔洛韦和莫西沙星)治疗后咳嗽、咳痰和气短较入院时好转,但全身乏力症状未见明显改善,检测血清风湿免疫指标提示抗SSA/Ro52抗体异常,详细追问病史,患者病程中有口干和眼干症状,考虑患者肺间质改变与自身免疫性疾病有关,遂转至本院风湿免疫科继续诊治。既往史无特殊。
1.2 查 体 体温36.5℃,心率110 min-1,血压102/62 mmHg,呼吸频率20 min-1,一般状态尚可,口唇无发绀,胸廓对称,双肺呼吸运动对称,双侧语音震颤减弱,双肺叩诊清音,双肺呼吸音粗,双下肺可闻及Velcro啰音,双手轻度“技工手”样改变,双肘皮肤色素沉着,双上肢肌力3级,双下肢肌力3级,双下肢轻度凹陷性水肿,余查体未见明显异常。
1.3 实验室检查 实验室检查指标中,抗Jo-1抗体和抗SRP抗体水平明显升高,其余检测指标如降钙素原、抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasm antibodies,ANCA)筛查加确证、抗环瓜氨酸多肽(anti-cyclic citrullinated peptide,CCP)抗体+抗角蛋白抗体(anti-keratin antibody,AKA)+抗核周因子 (anti-perinuclear factor,APF)抗体、免疫固定电泳、感染标志物、呼吸道感染病原体、自免肝病IgG抗体9项和狼疮抗凝物等均未见明显异常。实验室检查结果见表1。
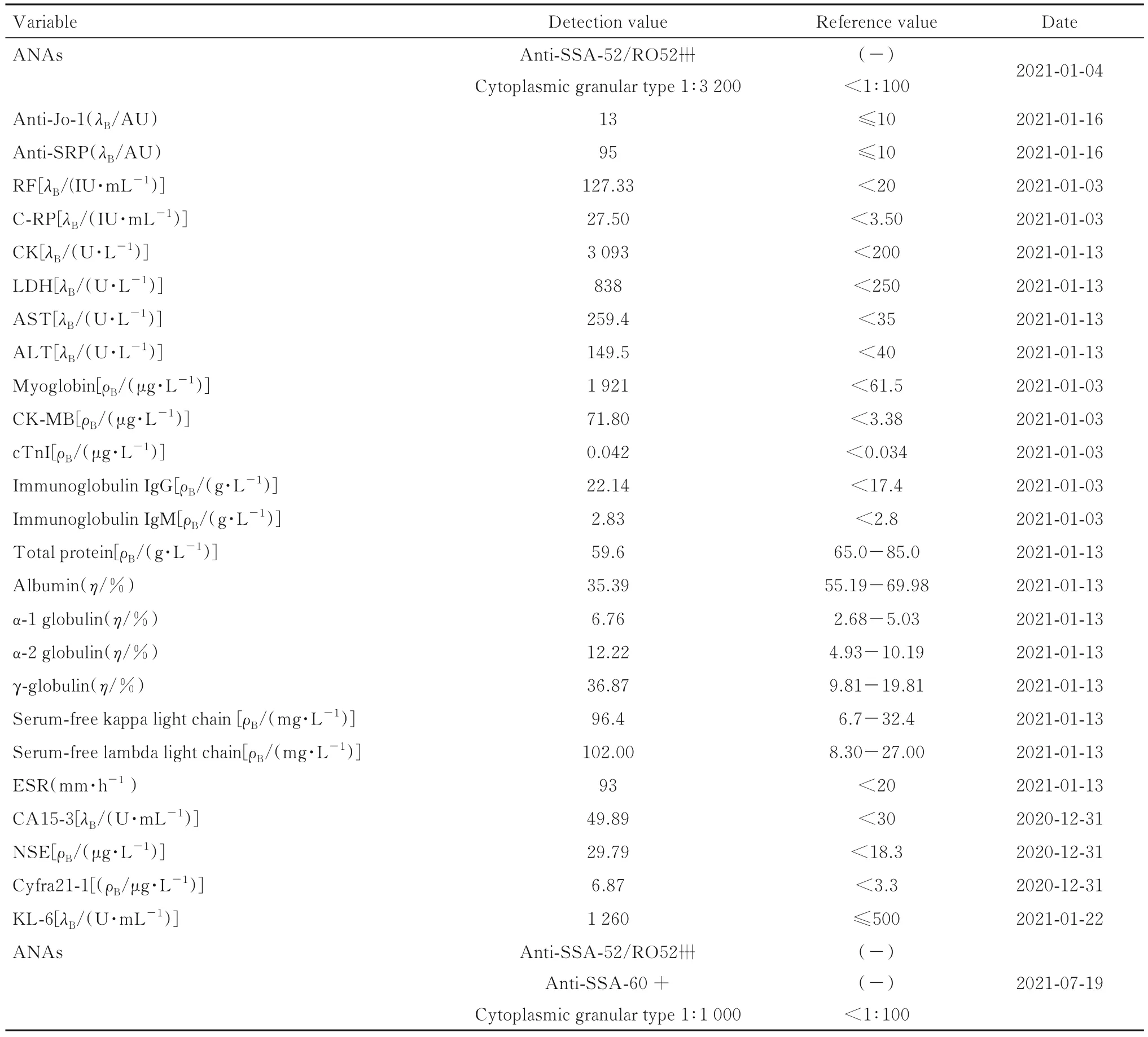
表1 双抗体阳性DM并发SS患者实验室检查结果Tab. 1 Laboratory inspection results of patient
1.4 影像学检查 胸部CT(2020-12-30):双肺散在炎性病变,其内有间质性改变(图1A),纵膈和双侧腋窝多发淋巴结肿大。PET-CT(2021-01-04):双肺炎性病变,部分呈间质性炎性病变;双侧肺门和纵膈(4R组)稍高代谢淋巴结影,较大者1.3 cm×0.8 cm,考虑炎性病变,双侧腋窝淋巴结显示放射性摄取不高;全身所示多处肌肉放射性摄取增高,标准摄取值(standardized uptake value,SUV)最大值3.9(图1B)。双大腿肌肉核磁共振(2021-01-13):双侧大腿周围软组织内见条片状质子密度加权抑脂序列(proton-density/fat-saturated,PD-FS)高信号,双侧大腿周围软组织肿胀和渗出(图1C)。涎腺彩超(2021-01-07):双侧涎腺实质弥漫性改变。超声心动图(2020-12-31):三尖瓣轻度返流。
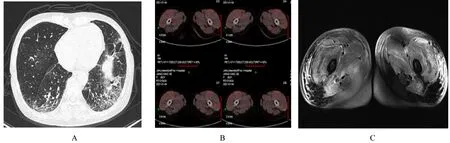
图1 双抗体阳性DM并发SS患者入院前胸部CT(A)、住院期间PET-CT(B)和双大腿肌肉核磁共振(C)影像Fig.1Images of chest CT before admission(A),PET-CT(B)and double thigh muscle MRI(C)during hospitalization of patient with double antibody positive DM complicated with SS
1.5 肌电图检查 肌电图结果显示:右侧上下肢呈肌源性改变,自发性活动增加,表现为尖波、纤颤、低振幅和短时间运动单元电位。
1.6 肌肉和唇腺组织病理形态表现 左上肢肌肉活检:肌束边缘可见少量小径成角肌纤维,符合肌萎缩表现;可见散在肌纤维变性和再生;散在数灶状淋巴细胞浆细胞和组织细胞浸润(图2A);免疫组织化学染色:CD68(+),淋巴细胞毒抗体(lymphocytotoxic antibody,LCA)(+)。唇腺活检:仅见1个淋巴细胞浸润灶,符合口腔SS表现(图2B)。
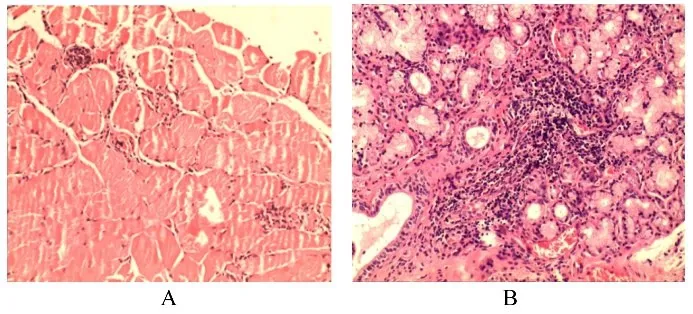
图2 双抗体阳性DM并发SS患者肌肉(A)和唇腺(B)组织病理形态表现(HE,×40)Fig.2 Pathomorphology of muscle(A)and labial salivary gland(B)tissues of patient with double antibody positive DM complicated with SS
1.7 眼科专科检查和肺功能 眼表综合检查:右眼泪膜破裂时间,第一次破裂时间2.68 s,平均破裂时间5.31 s,等级2级;左眼泪膜破裂时间,第一次破裂时间3.06 s,平均破裂时间3.49 s,等级2级。诊断:干眼症(双)。肺功能:弥散功能重度降低,肺一氧化碳弥散量(diffusing capacity of the lungs for carbon monoxide,DLCO)占预计值39.1%,肺泡弥散量重度降低,DLCO/肺泡容积(diffusing capacity divided by the alveolar volume,VA)占预计值49.8%,肺总量、残气量、残总比和功能残气量正常。
1.8 临床诊断和治疗过程 结合患者病史、体征和辅助检查,考虑该患者DM并发SS可能性大,治疗上给予醋酸地塞米松7.5 mg每日1次肌注,联合吗替麦考酚酯0.5 g每日2次口服,同时予以白蛋白输注、抗感染、祛痰和保肝等对症支持治疗。
治疗第2天,患者全身乏力症状较前稍减轻。查体: 体 温36.7℃, 心 率86 min-1, 血 压108/60 mmHg,呼吸频率20 min-1,双侧语音震颤减弱,双肺叩诊清音,双肺呼吸音粗,双下肺可闻及Velcro啰音,双上肢肌力3级,双下肢肌力3级。将醋酸地塞米松调整为甲泼尼龙40 mg每日1次静脉注射。
治疗第3天,患者全身乏力症状较前减轻,偶有咳嗽,咳少许白痰。查体:体温36.5℃,心率88 min-1,血压 104/64 mmHg,呼吸频率 18 min-1,双侧语音震颤减弱,双肺叩诊清音,双肺呼吸音粗,双下肺可闻及Velcro啰音,双上肢肌力3级,双下肢肌力3级。调整甲泼尼龙80 mg每日1次静脉注射。
治疗第4天,患者全身乏力症状较前明显减轻。查体:体温36.5℃,心率88 min-1,血压104/64 mmHg,呼吸频率18 min-1,双侧语音震颤减弱,双肺叩诊清音,双肺呼吸音粗,双下肺可闻及Velcro啰音,双上肢肌力3级,双下肢肌力3级。患者肌电图及肌酶谱结果回报,考虑DM诊断明确,复查肌酸肌酶较前下降,继续当前激素治疗方案。
治疗第9天,患者全身乏力症状较前明显减轻,无咳嗽和咳痰。查体:体温36.7℃,心率82 min-1,血压 106/60 mmHg,呼吸频率 18 min-1,双侧语音震颤减弱,双肺叩诊清音,双肺呼吸音粗,双下肺可闻及Velcro啰音,双上肢肌力3级,双下肢肌力3级。
1.9 随访 患者出院后,按照2020年美国医学会最新DM诊断和治疗指南[9],继续每日1次口服美卓乐68 mg,联合吗替麦考酚酯0.5 g每日2次、吡非尼酮200 mg每日3次口服,期间缓慢减少美卓乐剂量,至今连续随访5个月,DM症状明显控制,肺间质改变较入院时好转(图3),肌酸激酶已完全降至正常,可独立进行一般体力劳动。
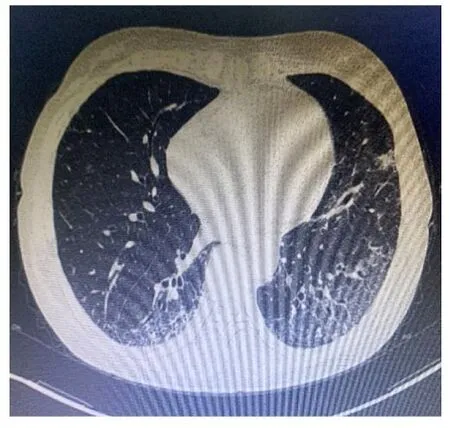
图3 双抗体阳性DM并发SS患者随访第5个月胸部CT影像Fig.3Chest CT image of patient with double antibody positive DM complicated with SS in 5th month of follow-up
2 讨 论
IIM患者的血清中经常检测到一些自身抗体,其中部分抗体只在临床诊断为IIM的患者中才可出现,称为MSAs,与炎性肌病的亚临床表型和预后相关[10]。在IIM患者中也可检测到在其他结缔组织病中出现的自身抗体,称为肌炎相关性抗体(myositis-associated antibodies,MAAs),如 Ro52,通常在抗Jo-1、PL-12和PL-7抗体等阳性的患者中检测到,也常在系统性红斑狼疮(systemic lupus erythematosus,SLE)和系统性硬化症(systemic sclerosis,SSc)等患者中发现,其与更严重肺间质病变、肌肉和关节受累有关联,且对免疫抑制剂的治疗反应不佳[11]。
抗合成酶综合征(anti-synthetase syndrome,ASS)是IIM中最常见的类型,该综合征的特征是各种氨基酰转运RNA(transfer RNA,tRNA)合成酶的高度特异性抗体的存在,上述合成酶是细胞内的酶,在蛋白质合成中起关键作用,可将氨基酸连接到相对应的tRNA分子上。每种氨基酸均有不同的氨基酰基tRNA合成酶,并且在ASS中的自身抗体都针对一种独特的合成酶。抗Jo-1抗体的靶标是组氨酸-tRNA合成酶,将组氨酸结合到蛋白质中。抗Jo-1抗体是1980年描述的第一个肌炎特异性 和 ASS抗 体[12]。 CASCIOLA-ROSEN 等[13]研究显示:组氨酸转运RNA合成酶(histidyl-tRNA synthetase,HRS)N-末端(1~48个氨基酸)片段由颗粒酶B的切割产生,而HOWARD等[14]证实:HRS在体外具有诱导CD4+和CD8+T淋巴细胞、单核细胞及未成熟树突状细胞迁移的能力,趋化活性通过C-C趋化因子受体5(C-C chemokine receptor type 5,CCR5)介导。因此,HRS可能从受损的肌肉细胞中释放出来,经过其趋化而来的抗原呈递加工成抗原提呈,从而产生抗体,并使疾病持续发展。具有抗Jo-1抗体的患者较具有其他抗合成酶抗体的患者肌肉和关节更易受累。抗Jo-1抗体通常预示着更好的预后,可能是因为抗Jo-1抗体的患者通常比非抗Jo-1抗体的患者在病程中更早被诊断。
IMNM是IIM的一个亚型,临床常表现为急性、亚急性或出现严重的肌肉无力。抗SRP抗体在1980年首次被发现,由多肽链(相对分子质量72 000、68 000、54 000、19 000、14 000 和 9 000)和7SL RNA组成[15],在新生多肽转运至内质网的过程中起重要作用。研究[16]显示:在IMNM患者中,抗SRP抗体几乎总是针对血清中相对分子质量至少54 000的SRP亚单位。有越来越多的数据[17]表明:抗SRP抗体是致病的,从血清阳性IMNM患者血浆中提纯的IgG可引起受体小鼠肌力下降,并有一定程度的肌纤维坏死和再生。在血清阳性的IMNM患者中,IgG1和C1q的存在以及C5b-9MAC19的形成证明了经典的补体级联反应被激活[18]。虽然抗SRP抗体作用于内质网表面的蛋白质,但研究[19]表明:SRP异位存在于肌肉纤维表面,可以直接被抗体靶向;抗SRP抗体可导致肌肉纤维萎缩,并增加肌肉萎缩因子编码基因的转录。此外,抗SRP抗体的存在可使成肌细胞产生的抗炎细胞因子白细胞介素4(interleukin-4,IL-4)和白细胞介素13(interleukin-13,IL-13)水平降低。一些难治性抗SRP抗体相关性肌病患者[20-21],经利妥昔单抗治疗后抗SRP抗体滴度明显降低,提示B细胞可能在抗SRP抗体相关性肌病的炎症过程中起致病作用,但其病理生理机制尚不清楚。
SUGIE等[6]报道1例DM患者,表现为大量胸腔积液并伴有间质性肺病,经治疗后伴发胃癌,行胃切除术后1年,患者死于进展性肺间质病变伴大量胸腔积液和胃癌多发性肝转移。VINCZE等[7]报道1例PM患者,初诊时患者血清中检测出抗Jo-1抗体,经糖皮质激素联合环磷酰胺治疗4年后,PM症状控制不佳,随后在该患者血清中筛查出抗SRP抗体阳性。MELGUIZO MADRID等[8]报道1例抗Jo-1和抗SRP抗体均呈阳性的PM患者,经治疗后肌肉症状和肌酸肌酶迅速改善,但逐渐出现进行性呼吸困难,因此推测双抗体阳性的患者预后不良。
本例患者因间断咳嗽、咳痰和气短伴全身乏力2个月入院,经抗感染治疗后咳嗽和咳痰较入院时好转,但仍存在全身乏力,病程中有口干及眼干症状,查体示双肺下叶Velcro啰音,双手轻度“技工手”样改变,双肘皮肤色素沉着,双上肢肌力3级,双下肢肌力3级,影像学提示双肺散在条片状和索状高密度影,以胸膜下区为著,肌肉病理提示肌束萎缩、变性和再生,唇腺病理提示淋巴细胞浸润灶>1个,实验室检查显示抗Jo-1、抗SRP、抗SSA/Ro52和抗SSA-60抗体阳性,结合患者病史、体征和辅助检查,考虑DM并发SS诊断成立,给予糖皮质激素联合免疫抑制剂治疗9 d后,患者全身乏力症状明显好转,提示患者对激素和免疫抑制剂反应良好,随访期间,激素缓慢减量,出院5个月后复查肌酸肌酶完全降至正常,查体示上、下肢肌力5级,肺CT示肺间质改变较前好转。综合以上资料,本例患者可明确诊断DM并发SS,治疗上传统的糖皮质激素联合免疫抑制剂仍然有效。
结合本例患者的临床特点及相关文献复习,本文作者认为:出现2种或2种以上MSAs的情况非常罕见,目前世界上仅有3例抗Jo-1和抗SRP抗体双阳性DM报道,并发SS则更为罕见,该类患者常表现为咳嗽、气短和乏力等非特异性症状,易被临床医生忽视,造成误诊和漏诊。在临床工作中,当出现肺间质改变[22],且并发抗核抗体异常时应警惕自身免疫性疾病可能。此类患者对激素联合免疫抑制剂的治疗仍然有效,早期发现和及时治疗能够明显改善患者预后。

