IL-17A在非小细胞肺癌组织中的表达及其通过NF-κB信号通路对VEGF表达的调控作用
何程远,杨红宇,谭钰晶,苏 杭,李泓澍,历 春
(1.北华大学基础医学院免疫学教研室,吉林 吉林 132013;2.吉林省吉林市化工医院病理科,吉林 吉林 132001;3.北华大学理学院 吉林省中药生物技术创新中心,吉林 吉林 132013)
肺癌是发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌 (non-small cell lung cancer,NSCLC) 占 80%~85%[1]。研究[2-3]表明:慢性炎症与NSCLC的发生发展有密切关联,炎性细胞因子的异常分泌已成为NSCLC发生和转移的重要因素。白细胞介素17(interleukin-17,IL-17)作为促炎性细胞因子,是辅助性T细胞17(T helper cell 17,Th17)的主要效应细胞因子,不仅参与机体感染、过敏和自身免疫性疾病,在肿瘤的发生发展中也发挥重要作用[4-5]。最新研究[6-10]显示:IL-17A在胃癌、结直肠癌、胰腺癌和肺癌等多种肿瘤细胞中也有表达,可通过促进上皮-间质转化和血管生成等多种机制促进肿瘤的发生发展。血管内皮生长因子(vascular en-dothelial growth factor,VEGF)是肿瘤血管生成重要的调节因子,以VEGF介导的血管生成为靶点已成为目前治疗肿瘤的重要策略之一[11-12],但肿瘤细胞中IL-17A对VEGF的调控作用及相关机制尚未完全阐明。
本研究通过检测IL-17A在NSCLC组织中的表达,分析其阳性表达率与NSCLC患者临床病理参数和微血管密度(microvessel density,MVD)的相关性,同时采用核转录因子κB(nuclear transcription factor-κB, NF-κB) 抑 制 剂 BAY11-7082阻断A549肺癌细胞NF-κB信号通路,观察IL-17A对NF-κB和VEGF的调控作用以及对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)增殖的影响,以期为NSCLC的靶向治疗提供新的思路。
1 资料与方法
1.1 临床资料 收集2009年1月—2013年12月吉林省吉林市化工医院病理科存档的NSCLC患者术后石蜡包埋标本55例。患者年龄39~78岁,平均年龄(60.5±9.4)岁。年龄≥60岁28例,年龄<60岁27例;男性35例,女性20例;肿瘤直径≤3 cm 24例,>3 cm 31例;组织学分型:鳞状细胞癌35例,腺癌20例;组织病理学分级:高-中分化32例,低分化23例;有淋巴结转移24例,无淋巴结转移31例;TNM分期采用国际抗癌联盟(Union for International Cancer Control,UICC) 的国际肺癌分期标准(2009年第7版),Ⅰ期27例,Ⅱ+Ⅲ期28例。所有NSCLC患者术前均未行放疗和化疗,均为原发病灶,所有标本均经病理学检测明确诊断。另取15例肺部良性病变的正常肺组织作为对照组。
1.2 细胞、主要试剂和仪器 人肺腺癌细胞株A549由北华大学分子医学重点实验室保存,HUVECs购自深圳市华拓生物科技有限公司,IL-17A抗体购自美国Novus公司,CD31抗体购自美国Santa公司,通用型PV9000及DAB试剂盒均购自北京中杉金桥试剂公司,DMEM培养液购自美国HyClone公司,胎牛血清购自浙江天杭生物科技股份有限公司,外源性重组人IL-17A(recombinant human IL-17A,rhIL-17A)、MTT试剂盒、BAY11-7082、BCA试剂盒、IL-17受体A(interleukin-17 receptor A,IL-17RA)抗体、P65抗体、磷酸化P65(phosphorylated P65,p-P65)抗体、VEGF抗体和GAPDH抗体均购自上海碧云天生物技术有限公司。Western blotting电泳设备购自美国Bio-Rad公司,全自动酶标仪购自美国Bio-Tek公司。
1.3 细胞培养及分组 将A549细胞和HUVECs分别培养于含10%胎牛血清的DMEM培养液中,放置于37℃、5%CO2和相对饱和湿度的培养箱中培养传代。A549细胞分为对照组(A549)、rhIL-17A组(100 mg·L-1rhIL-17A)、BAY11-7082组(10 mmol·L-1BAY11-7082)和联合组(100 mg·L-1rhIL-17A+10 mmol·L-1BAY11-7082),作用 48 h后,分别收集各组细胞和上清液。
1.4 免疫组织化学染色 将石蜡标本重新制备为4 μm厚度的切片,经烘烤、脱蜡、脱水后置于pH 6.0的柠檬酸缓冲液中高压抗原修复,参照试剂盒说明书进行免疫组织化学染色,PBS缓冲液替代一抗作阴性对照。采用双盲法进行评估,以肿瘤细胞质显示棕黄色颗粒为阳性染色。IL-17A染色结果判定,染色强度:无染色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分;阳性面积:阳性面积<5%计0分,5%≤阳性面积≤25%计1分,25%<阳性面积≤50%计2分,50%<阳性面积≤75%计3分,阳性面积>75%计4分;染色强度与阳性面积相乘得到最终评分:0~2为阴性,3~5为弱阳性,6~8为中阳性,9~12为强阳性。最后评分>2视为阳性[13]。以CD31染色结果表示MVD,在每个高倍视野(×200)中血管最多的区域计数阳性染色的血管数量,以5个区域的平均值作为每例患者的MVD;选择55例NSCLC标本的平均MVD值作为分界值,大于或小于平均MVD值为MVD高表达或低表达[14]。
1.5 Western blotting法检测各组A549细胞中IL-17A、IL-17RA、p-P65和 VEGF蛋白表达水平 胰蛋白酶消化收集各组细胞,PBS缓冲液充分洗涤后,置于含RIPA裂解液和抗磷酸化降解的蛋白裂解液中冰上孵育30 min,4℃、15 000 r·min-1离心15 min后收集上清液。采用BCA法检测总蛋白浓度,蛋白上样量为30 μg,10%SDS-PAGE电泳1 h,湿转法将胶内蛋白转到PVDF膜上,5%BSA室温封闭1 h,弃去封闭液,加入IL-17A、IL-17RA、p-P65、P65和VEGF抗体(浓度均为1∶1 000)4℃孵育过夜。次日,TBST洗涤PVDF膜3次,加入HRP标记的二抗(1∶3 000)室温孵育1 h。TBST洗涤3次,ECL发光并拍照,以GAPDH作为内参。IL-17A、IL-17RA和VEGF蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值,p-P65蛋白表达水平=p-P65蛋白条带灰度值/P65蛋白条带灰度值。
1.6 MTT比色法检测各组HUVECs增殖活性 将HUVECs密度调整为1×104个/孔,接种至96孔细胞培养板中,每组设3个复孔,分别加入各组A549细胞培养上清液200 μL。培养48 h后每孔中加入 MTT 溶液 20 μL (5 g·L-1) 放于培养箱中继续培养4 h,弃上清。每孔中加入DMSO 150 μL,震荡使结晶溶解并混匀。采用酶联免疫检测仪在490 nm波长处检测各孔吸光度(A)值,取平均A值表示各组细胞增殖活性。
1.7 统计学分析 采用SPSS 17.0统计软件进行统计学分析。NSCLC组织和正常肺组织中IL-17A阳性表达率和不同临床病理参数NSCLC患者癌组织中IL-17A阳性表达率组间比较采用χ2检验;IL-17A表达与MVD的相关性分析采用Pearson相关分析;各组细胞中相关蛋白表达水平和增殖活性均符合正态分布且方差齐性,以±s表示,两组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1 NSCLC组织和正常肺组织中IL-17A阳性表达率 免疫组织化学染色结果显示:NSCLC组织中IL-17A主要定位于肺癌细胞的胞质,IL-17A阳性表达率为60.0%,正常肺组织中IL-17A阳性表达率为33.3%,组间比较差异有统计学意义(P<0.05)。见图1A和B。
2.2 不同临床病理参数NSCLC患者癌组织中IL-17A阳性表达率 与高-中分化组比较,低分化组NSCLC患者癌组织中IL-17A阳性表达率明显升高(P<0.05)(图1C和D)。IL-17A阳性表达率与NSCLC患者年龄、性别和肿瘤大小等无关联(P>0.05)。见表1。
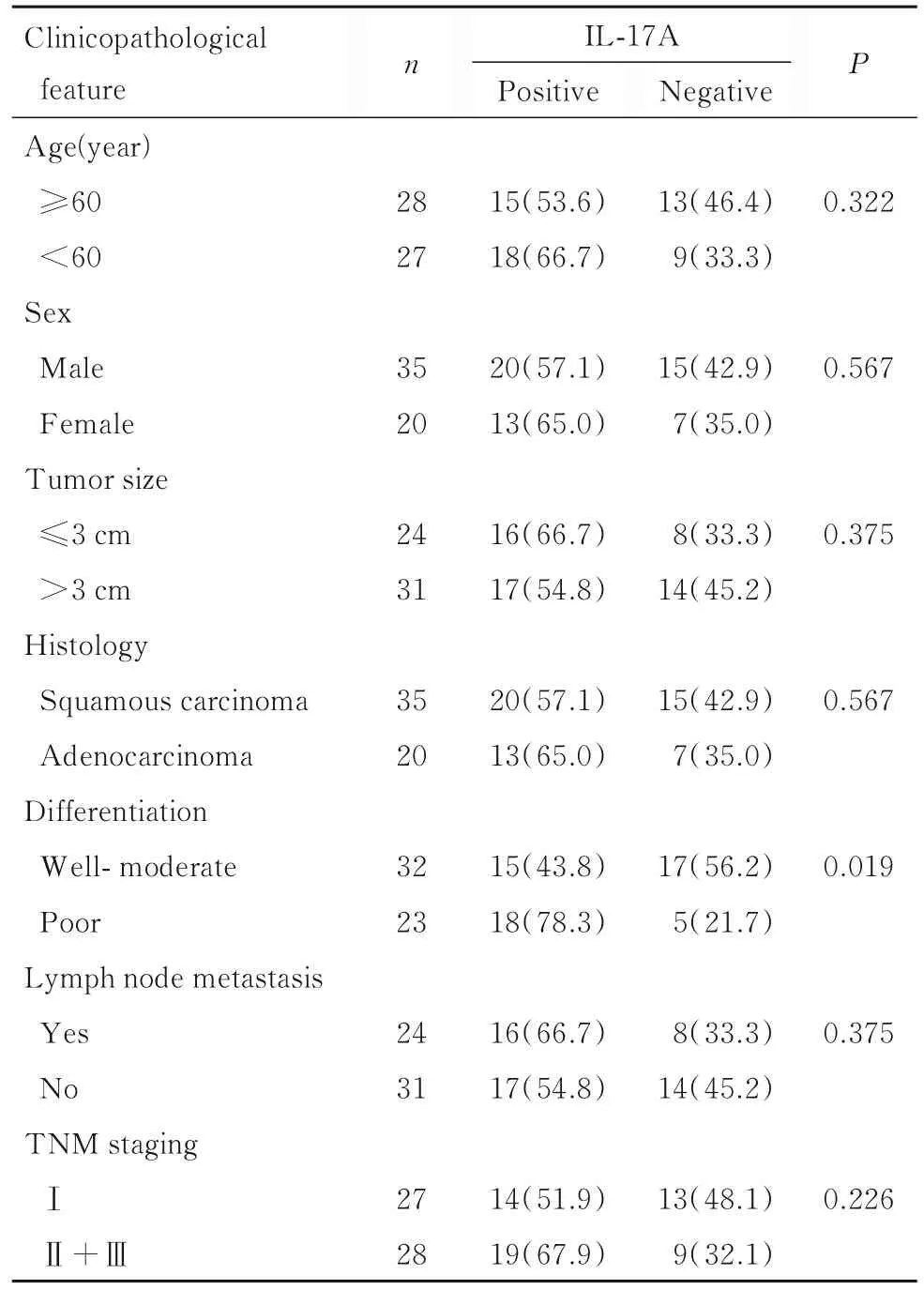
表1 不同临床病理参数NSCLC患者癌组织中IL-17A阳性表达率Tab. 1 Positive expression rates of IL-17A in cancer tissue of NSCLC patients with different clinicopathological features[n(η/%)]
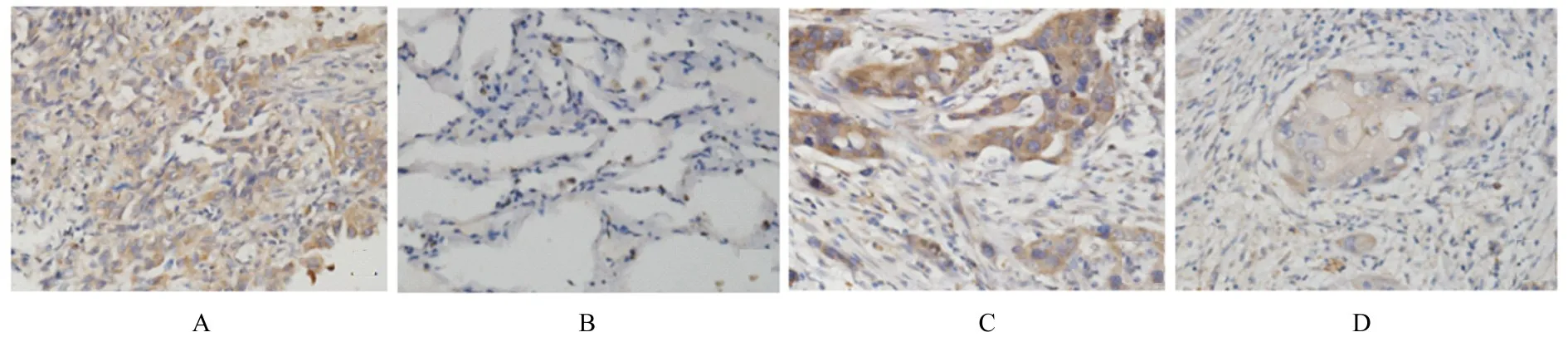
图1 NSCLC组织和正常肺组织中IL-17A的表达情况(免疫组织化学,×400)Fig.1Expressions of IL-17A in NSCLC tissue and normal lung tissue(Immunohistochemistry,×400)
2.3 NSCLC组织中IL-17A表达与MVD的相关性Pearson相关分析显示:IL-17A表达与MVD呈明显正相关关系(r=0.329,P<0.05)。见表2和图2。
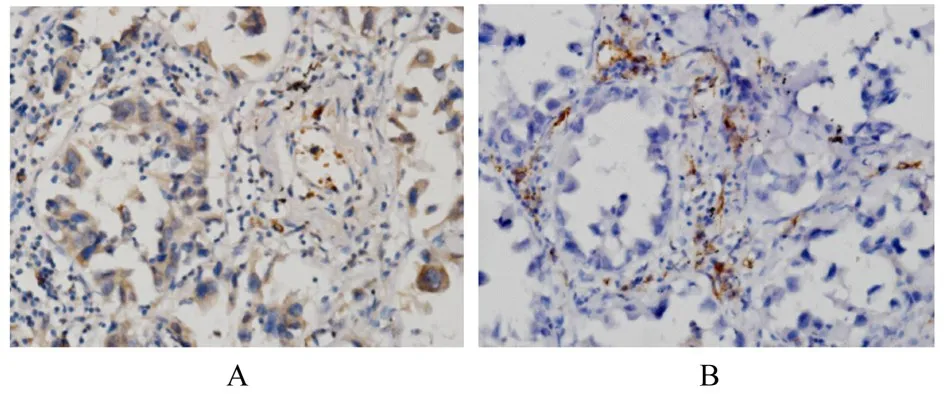
图2 NSCLC组织中IL-17A(A)和CD31(B)的表达情况(免疫组织化学,×400)Fig.2 Expressions of IL-17A (A)and CD31(B)in NSCLC tissue(Immunohistochemistry,×400)

表2 NSCLC组织中IL-17A表达与MVD的相关性Tab. 2 Relationship between expression of IL-17A and MVD in NSCLC tissue
2.4 2组A549细胞中IL-17RA、p-P65和VEGF蛋白表达水平 与对照组比较,rhIL-17A组细胞中IL-17RA、p-P65和VEGF表达水平明显升高(P<0.05)。见图3和表3。

图3 Western blotting法检测2组A549细胞中IL-17RA、VEGF和p-P65蛋白表达电泳图Fig.3 Electrophoregram of expressions of IL-17RA,p-P65 and VEGF proteins in A549 cells in two groups detected by Western blotting method
表3 2组A549细胞中IL-17RA、p-P65和VEGF蛋白表达水平Tab. 3Expression levels of IL-17RA, p- P65 and VEGF proteins in A549 cells in two groups (n=3,±s)
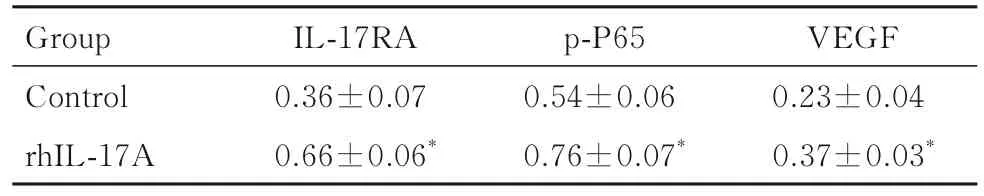
表3 2组A549细胞中IL-17RA、p-P65和VEGF蛋白表达水平Tab. 3Expression levels of IL-17RA, p- P65 and VEGF proteins in A549 cells in two groups (n=3,±s)
*P<0.05 compared with control group.
Group Control rhIL-17A VEGF 0.23±0.04 0.37±0.03*IL-17RA 0.36±0.07 0.66±0.06*p-P65 0.54±0.06 0.76±0.07*
2.5 各组A549细胞中IL-17RA、p-P65和VEGF蛋白表达水平 与对照组比较,rhIL-17A组细胞中IL-17RA、p-P65和VEGF蛋白表达均明显升高(P<0.05),BAY11-7082组 细 胞 中IL-17RA、p-P65和VEGF蛋白表达水平均明显降低(P<0.01);与rhIL-17A组比较,联合组细胞中IL-17RA、p-P65和VEGF蛋白表达水平均明显降低(P<0.05)。见图4和表4。
表4 各组A549细胞中IL-17RA、p-P65和VEGF蛋白表达水平Tab. 4 Expression levels of IL-17RA, p- P65 and VEGF proteins in A549 cells in various groups (n=3,±s)

表4 各组A549细胞中IL-17RA、p-P65和VEGF蛋白表达水平Tab. 4 Expression levels of IL-17RA, p- P65 and VEGF proteins in A549 cells in various groups (n=3,±s)
*P<0.05,**P<0.01 compared with control group;△P<0.05 compared with rhIL-17A group.
VEGF 0.26±0.03 0.37±0.04*0.15±0.01**0.24±0.02△30.345<0.01 Control rhIL-17A BAY11-7082 Combination FP 0.77±0.08 0.99±0.06*0.12±0.02**0.45±0.08△63.61<0.01 1.25±0.08 1.53±0.08*0.52±0.07**1.01±0.07△59.09<0.01 Group IL-17RA p-P65
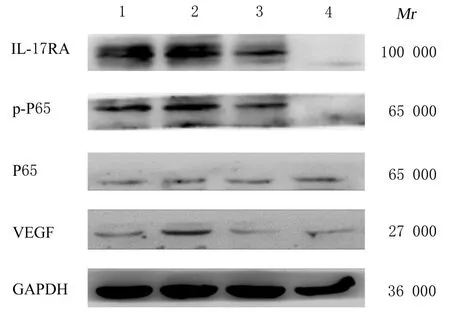
图4 Western blotting法检测各组A549细胞中IL-17RA、p-P65和VEGF蛋白表达电泳图Fig.4 Electrophregram of expressions of IL-17RA,p-P65 and VEGF proteins in A549 cells in various groups detected by Western blotting method
2.6 加入A549细胞培养上清液后各组HUVECs增殖活性 与对照组比较,rhIL-17A组HUVECs增殖活性明显升高(P<0.05),BAY11-7082组HUVECs增殖活性明显降低(P<0.05);与rhIL-17A组比较,联合组HUVECs增殖活性明显降低(P<0.05)。见表5。
表5 加入A549细胞培养上清液后各组HUVECs增殖活性Tab. 5Proliferation activities of HUVECs in various groups after treated with A549 cell culture supernatant (n=3,±s)

表5 加入A549细胞培养上清液后各组HUVECs增殖活性Tab. 5Proliferation activities of HUVECs in various groups after treated with A549 cell culture supernatant (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with rhIL-17A group.
Proliferation activity 0.887±0.035 0.974±0.036*0.750±0.100*0.851±0.057△Control rhIL-17A BAY11-7082 Combination Group
3 讨 论
研究[15]表明:肿瘤微环境中存在大量的炎症细胞因子,其与肿瘤细胞之间相互作用,从而影响肿瘤的发生发展。其中,IL-17A作为Th17细胞的主要效应细胞因子在肿瘤微环境中发挥重要作用,可通过结合其受体IL-17RA活化下游信号通路促进结肠癌、乳腺癌和肺癌等肿瘤的生长和转移[16-17]。XU等[18]研究发现:将过表达IL-17A的重组腺病毒作用K-ras基因突变的肺癌模型小鼠3周后,小鼠体内肺肿瘤数量明显增多,表明IL-17A可促进肺癌的生长。目前,IL-17A在肿瘤细胞中的作用及相关机制研究较少。本研究中,IL-17A在NSCLC组织中的阳性表达率明显高于正常肺组织,进一步证实了IL-17A与肺癌发生发展的关联;此外,IL-17A在低分化组NSCLC患者癌组织中高表达,表明其在NSCLC中发挥促瘤作用,高表达IL-17A的肺癌细胞其恶性程度可能更高,进展更快。有研究[9,19]表明:肺癌细胞和宫颈癌细胞中IL-17A的高表达与CD31标记的肿瘤MVD的升高有密切关联。因此,本研究检测了NSCLC组织中IL-17A与CD31标记的MVD之间的相关性,分析结果与上述研究结果相符,提示IL-17A可能在肿瘤血管生成中发挥重要作用。
VEGF是肿瘤血管生成过程中最关键的促血管生成因子。研究[9,20-21]显示:IL-17A可通过信号转导因子和转录激活因子1(signal transducer and activator of transcription 1,STAT1)信号通路调控白细胞介素6(interleukin-6,IL-6)、白细胞介素8(interleukin-8, IL-8)和VEGF的表达进而促进肿瘤血管生成,可通过STAT3信号通路和CXC趋化因子配体(CXC chemokine ligand,CXCL)-CXC趋化因子受体2(CXC chemokine receptor 2,CXCR2)途径调控VEGF的表达。NF-κB是联系炎症与肿瘤的关键信号分子,激活后可通过诱导炎症介质和免疫相关基因的转录影响肿瘤的发生发展[22]。研究[23]显示:NF-κB 信号通路活化后,可通过上调P65蛋白的磷酸化水平促进VEGF的表达。基于以上研究背景,本文作者推测,肺癌微环境中IL-17A可能参与NF-κB信号通路对VEGF的表达调控。因此,本研究首先检测了IL-17A作用肺癌细胞后IL-17RA、p-P65和VEGF蛋白表达水平,结果显示:IL-17A可明显上调IL-17RA、p-P65和VEGF蛋白表达水平,表明IL-17A与肺癌细胞IL-17RA的结合可激活NF-κB信号通路和促进VEGF蛋白的表达。为进一步验证IL-17A调控VEGF蛋白的表达是通过NF-κB信号通路发挥作用,采用BAY11-7082作为NF-κB通路抑制剂阻断NF-κB信号通路,检测IL-17A和BAY11-7082单独或联合作用肺癌细胞后IL-17RA、p-P65和VEGF蛋白的表达情况,结果显示:阻断NF-κB信号通路可明显抑制IL-17RA和VEGF的表达,IL-17A诱导的IL-17RA和VEGF上调作用在NF-κB通路阻断后明显下调,表明NF-κB信号通路参与IL-17A对VEGF的表达调控。
研究[24-26]表明:VEGF对内皮细胞具有特异性的促有丝分裂作用,可通过活化内皮细胞促进内皮细胞的增殖。本研究将IL-17A和BAY11-7082单独或联合处理的肺癌细胞上清液作用于HUVECs,检测HUVECs的增殖情况,结果显示:IL-17A作用的肺癌细胞上清液可明显促进HUVECs增殖,但与BAY11-7082联合作用的肺癌细胞上清液可明显抑制HUVECs的增殖,表明IL-17A促进HUVECs增殖的机制之一是通过NF-κB信号通路促进VEGF的分泌实现的。
综上所述,IL-17A在低分化NSCLC细胞中高表达,其可通过与IL-17RA结合活化NF-κB通路调控VEGF的表达进而促进HUVECs的增殖。

