杀白细胞毒素基因阴性金黄色葡萄球菌的基因分型、耐药性及其生物学特征
额尔德木图,王艳艳,吕莹莹,陈贵林,王俊瑞
(1.内蒙古大学生命科学学院生物学系,内蒙古 呼和浩特 010021;2.内蒙古医科大学附属医院检验科,内蒙古 呼和浩特 010050)
金黄色葡萄球菌是一种重要的革兰阳性致病菌,包括耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus,MRSA)和甲氧西林敏感金黄色葡萄球菌(methicillin sensitive Staphylococcus aureus,MSSA),可引发多种社区感染和医院获得性感染,包括皮肤、关节、软组织和骨感染以及心内膜炎、败血症和中毒性休克等,并且病死率较高[1-5]。国外报道[6]提示:医院获得性MRSA(hospital acquired MRSA, HA-MRSA)和社区获得性MRSA(community acquired MRSA,CA-MRSA)在流行范围和生物学特性(基因分型、毒素分泌及耐药模式等)方面存在明显差异,尤其是杀白细胞素(panton-valentine leukocidin,pvl)基因表达情况,CA-MRSA的pvl基因表达多呈阳性,而HA-MRSA的pvl基因表达常呈阴性。pvl基因阴性金黄色葡萄球菌特别是pvl基因阴性MRSA是导致住院患者发生严重感染的一个重要病原。金黄色葡萄球菌产生多种毒力因子是发挥其致病力的一个重要方式,毒力因子主要包括 α-溶 血 素 (α-hemolysin, hla)、 肠 毒 素 A(enterotoxin A,sea) 和 杀 白 细 胞 毒 素 DE(leucocytic toxin DE,luk DE) 等[7-10]。上述毒力因子表达水平受多个调控系统的影响,特别是辅助基 因 调 控 子 (adopting accessory gene regulator,agr)群体调控系统。agr群体调控系统对金黄色葡萄球菌有全局性调控作用,不同agr分型和表达缺陷菌株的耐药性、毒力和生物膜形成能力等生物学特性均存在差异。研究[11]显示:不同来源菌株agr-Ⅰ~Ⅳ型基因分布有明显差异,但是对于pvl基因阴性金黄色葡萄球菌的agr分型研究甚少。本研究以住院患者分离出的pvl基因阴性金黄色葡萄球菌为研究对象,对其耐药特征、基因分型、毒力基因分布和生物膜形成能力进行分析,为临床更好了解和防治pvl基因阴性金黄色葡萄球菌感染提供更多理论依据。
1 资料与方法
1.1 菌株来源 收集2013年9月—2021年2月内蒙古医科大学附属医院就诊患者临床标本分离的100株金黄色葡萄球菌,剔除同一患者重复菌株。质控菌株为金黄色葡萄球菌ATCC29213和ATCC25923,由本实验室保存。
1.2 试剂和仪器 细菌基因组DNA提取试剂盒[天根生化科技(北京)有限公司],MasterMix和DNA Marker(大连TaKaRa生物工程有限公司)。培养箱(美国ThermoFisher Scientific公司),VITEK-Ⅱ全自动微生物分析系统及配套GP鉴定卡和AST-GP67药敏卡(法国梅里埃公司),PCR扩增仪(北京领宇科技有限公司),电泳仪和Gel DocXR+凝胶成像分析系统(美国Bio-Rad公司)。1.3 细菌鉴定和药物敏感性试验(药敏试验) 所有菌株均由VITEK-Ⅱ全自动微生物分析仪进行菌种鉴定,利用AST-GP67药敏卡检测菌株抗菌药物敏感性,结果参照CLSIM100-S30文件规定判读标准进行抗菌药物敏感性判读。
1.4 agr基因分型 按照试剂盒说明书进行DNA提取,-20℃条件下保存备用。引物由北京中美泰和生物公司合成,引物序列和反应条件参照参考文献 [11],agr-Ⅰ型、agr-Ⅱ型、agr-Ⅲ型和agr-Ⅳ型扩增片段分别为441、575、323和659 bp,PCR扩增产物经1.5%琼脂糖凝胶,120 V电泳30 min,将凝胶置于凝胶成像系统扫描成像,检测到相应的目的基因长度的片段为该基因型阳性。
1.5 毒力基因检测 提取100株金黄色葡萄球菌菌株全基因组(操作参见试剂盒说明书),将提取的DNA于-20℃条件下保存备用。引物由北京中美泰和生物公司合成,包括黏附因子基因、溶血素基因、肠毒素基因、杀白细胞毒素基因、表皮剥脱素基因和中毒性休克综合征毒素基因合计32个毒力(黏附因子:fnbA、clfA、clfB、cna、sdrC、sdrD、 sdrE、 ebpS 和 edin; 肠 毒 素 : sea、 seb、sec、 sed、 see、 seg、 seh、 sei、 sej、 sen、 seo 和sem;毒素休克综合征毒素:tsst;表皮剥脱毒素:eta和etb;白细胞毒素:pvl、lukDE和lukM;溶血素:hla、hlb、hld、mpHLG、mpHLG2;agr分型:agr-Ⅰ、agr-Ⅱ、agr-Ⅲ和agr-Ⅳ)。基因引物序列和反应条件参照文献[11-12]。PCR扩增产物经1.5%琼脂糖凝胶,120 V电泳30 min,将凝胶置于凝胶成像系统扫描成像,以检测到相应目的基因长度的片段为该基因携带阳性,未检测到相应目的基因长度的片段为该基因携带阴性。
1.6 生物膜形成能力检测 待测菌株在含0.25%葡萄糖的TSB液中37℃过夜培养,调整菌液浓度为0.5麦氏浊度 (约1.5×108CFU·mL-1),并在含0.25%葡萄糖的TSB中稀释至最终浓度为1×106CFU·mL-1,置于无菌96孔细胞培养板中37℃培养48 h。弃去培养液,用无菌生理盐水轻轻洗涤3次,用甲醇固定15 min。风干后,各孔用0.1%结晶紫染色5 min,再用无菌PBS缓冲液洗涤3次,自然风干,随后于33%冰乙酸中作用30 min溶解生物膜。在590 nm波长下用酶标仪测定各培养孔吸光度 (A) 值,平行3个重复,计算其均值。以未接种菌液的孔作为阴性对照,A值反映生物膜与接触表面黏附的牢固程度,依据临界Ac值(Ac是由空白孔的平均值加上其3倍的标准差),可将生物被膜分成以下4类:A值≤Ac值为不黏附(0),Ac值<A值≤2Ac值为弱黏附(+),2Ac值<A值≤4Ac值为中等黏附(),A值>4Ac值为强黏附()。
1.7 统计学分析 采用SPSS 16.0统计软件进行统计学分析。MSSA和MRSA耐药率和毒力基因携带率以百分率(%)表示,2组间率的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 100株pvl基因阴性金黄色葡萄球菌标本来源分布 100株pvl基因阴性金黄色葡萄球菌标本来源于5种临床标本,其中主要以痰/支气管肺泡灌洗液最多(52.0%),其次为分泌物标本(32.0%),呼吸道标本中MRSA检出最多,检出率为80.8%。具体标本来源分布和构成比见表1。

表1 100株pvl基因阴性金黄色葡萄球菌菌株分离标本构成比Tab. 1 Constituent ratios of 100 pvl gene-negative samples of Staphylococcus aureus ioslates
2.2 100株pvl基因阴性金黄色葡萄球菌临床科室来源分布100株pvl基因阴性金黄色葡萄球菌来源科室广泛,主要来源于皮肤科、神经外科和呼吸内科,分别占19.0%、9.0%和9.0%,除血液科外其他科室均有MRSA检出。金黄色葡萄球菌临床科室来源分布见表2。

表2 100株pvl基因阴性金黄色葡萄球菌菌株分离临床科室分布构成比Tab. 2 Constituent ratios of distribution of 100 pvl genenegative Staphylococcus aureus isolates isolated from departments
2.3 100株pvl基因阴性金黄色葡萄球菌药敏试验结果 100株pvl基因阴性金黄色葡萄球菌对13种抗生素的药敏试验结果见表3。金黄色葡萄球菌对万古霉素、利奈唑胺和奎奴普丁/达福普丁全部敏感,其中MSSA菌株对大多数抗生素敏感,主要对青霉素、红霉素和克林霉素3种抗生素耐药,耐药率分别为89.5%、71.1%和34.2%;MRSA对青霉素耐药率最高,为100.0%,对其余产生耐药的抗生素耐药率均≥50.0%。除红霉素以外,MRSA对其他产生耐药抗生素的耐药率明显高于MSSA(P<0.01)。见表3。
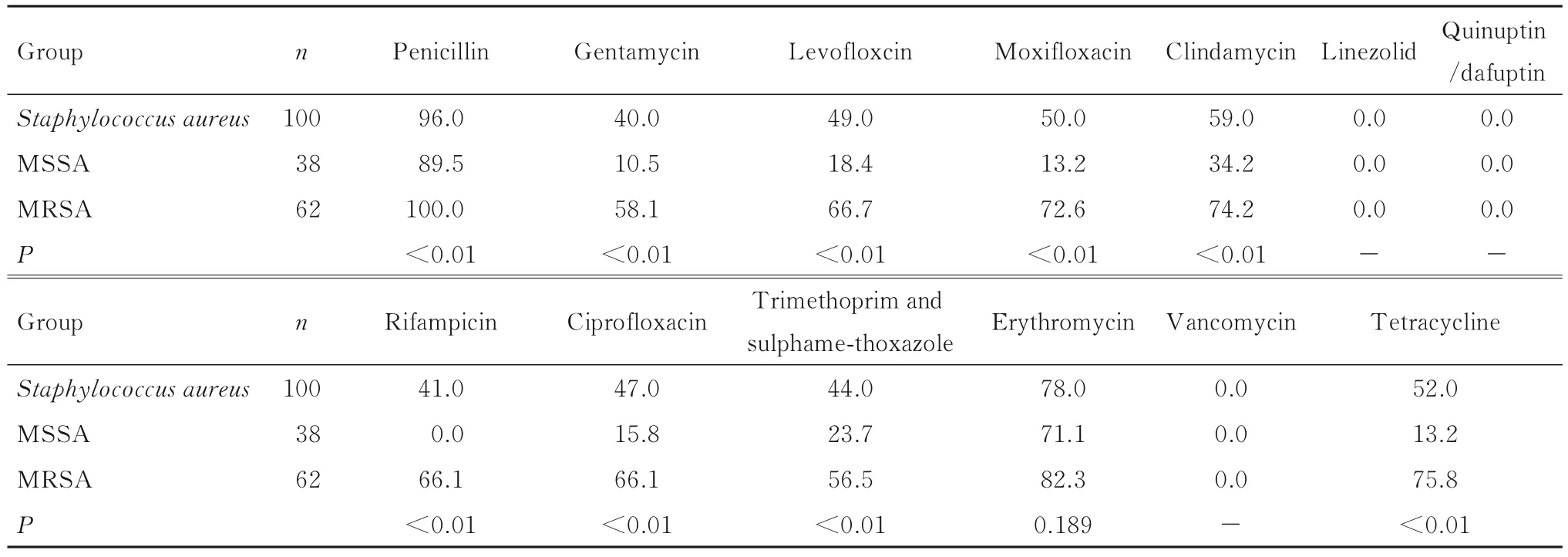
表3 100株pvl基因阴性金黄色葡萄球菌对常用抗菌药物的耐药率Tab. 3 Antimicrobial resistance rates of 100 pvl gene-negative Staphylococcus aureus isolates(η/%)
2.4 100株pvl基因阴性金黄色葡萄球菌中agr等位基因分布特征 100株pvl基因阴性金黄色葡萄球菌agr基因阳性率为100.0%。agr-Ⅰ~Ⅳ基因型均在金黄色葡萄球菌中发现,其中agr-Ⅰ为主要基因型(79.0%),其次为agr-Ⅱ基因型(16.0%)。MSSA的agr-Ⅱ基因携带率明显高于MRSA(P<0.01),MRSA的agr-Ⅰ基因携带率明显高于MSSA(P<0.01)。见表4。
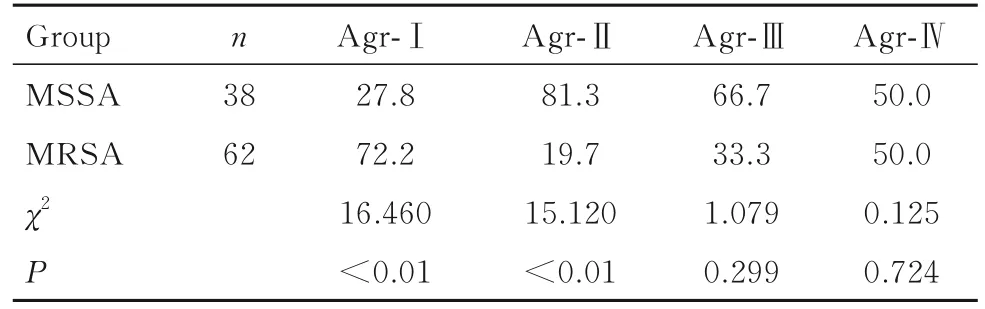
表4 100株pvl基因阴性金黄色葡萄球菌agr基因分型Tab.4 Arg gene typing of100 pvl gene-negative Staphylococcus aureus isolates(η/%)
2.5 100株pvl基因阴性金黄色葡萄球菌毒力基因检测结果 100株pvl基因阴性金黄色葡萄球菌中,溶血素基因的阳性率较高,在所有菌株中均检测到hla和hld基因。黏附素基因fnbA、clfA、clfB、cna、sdrC和sdrE阳性率较高,所有菌株均携带有至少5种黏附素基因,未检测到edin基因。肠毒素基因seh和seo阳性率略高,分别占72.0%和51.0%,其余肠毒素基因和表皮剥脱素基因eta、tsst、lukDE和lukM阳性率较低,未检测到表皮剥脱 素基因 etb和 pvl。MRSA 中 sdrE、sea、seb、seh、tsst、lukDE、lukM、hlb和mpHLG2基因的携带率高于MSSA,其中sea和seh基因的携带率明显高于 MSSA (P<0.05或P<0.01),而其他18个基因携带率均低于MSSA,其中mpHLG1、seo、sed和sej的携带率明显低于MSSA(P<0.05或P<0.01)。见表5。23.7%(9/38)的MSSA同时携带≥15个毒力基因,明显高于MRSA(14.5%)。本研究将携带≥12个基因的菌株进行分型,分为R1~6型,其中MRSA主要以R6型为主(38.7%),R4型较少(3.2%),未检出R1和R2型;MSSA中R1~R4基因型分布较均匀,占13.2%~18.4%,R6型较少(2.6%),未检测出R5型。见表6。

表5 100株pvl基因阴性金黄色葡萄球菌毒力基因携带率Tab. 5Carrying rates of virulence genes among 100 pvl gene-negative Staphylococcus aureus isolates(η/%)

表6 同时携带12种以上毒力基因的pvl基因阴性金黄色葡萄球菌菌株分布特征Tab. 6Distribution characteristics of multiple virulence genes (≥12)among Staphylococcus aureus isolates(η/%)
2.6 100株pvl基因阴性金黄色葡萄球菌生物膜形成能力 根据结晶紫染色检测结果,100株pvl基因阴性金黄色葡葡球菌中有91株(91.0%)为产膜株,9株(9.0%)为非产膜株。MSSA和MRSA中产膜株分别占100.0%(38/38)和85.5%(53/62),MSSA的生物膜形成能力高于MRSA(P<0.05)。MSSA中,强产膜菌株、中产膜菌株和弱产膜菌株分别占5.3%(2株)、26.3%(10株)和68.4%(26株);MRSA中,未检出强产膜菌株,中产膜菌株和弱产膜菌株分别占14.5%(9株)和71.0%(44株) 。
3 讨 论
金黄色葡萄球菌是人类重要的致病菌,常见特点为多重耐药和高致病性,由于抗生素的广泛使用,致使在高选择性压力下出现大量耐药菌株,尤其是 MRSA,对多种抗生素呈现耐药[1-2,13-15]。金黄色葡萄球菌的强致病力,主要由于可以产生多种毒素,继而引起多种形式感染,如局部皮肤软组织感染、心内膜炎、胃肠炎和肺炎,严重的可引起血液感染和脓毒血症等全身感染,而感染后是否能得到有效治疗与其耐药性有密切关联[14-15]。本研究结果显示:MRSA检出科室分布广泛,其中呼吸道标本中MRSA检出最多。MRSA作为医院感染的主要病原菌之一,已成为世界范围内耐药性监测和医院感染预防和控制的重点[16],而MSSA的耐药情况并未引起足够重视。国内研究[17]显示:MSSA除对青霉素耐药较高外,还对红霉素和克林霉素等存在不同程度的耐药。本研究中,38株MSSA菌株中检出了高比例的多重耐药菌株(39.5%),提示MSSA的耐药性不容乐观,应引起临床高度重视。
研究[18-19]显示:agr介导的群体感应(quorm sensing system,QS)系统在金黄色葡萄球菌致病过程中发挥关键的调控作用,正调控多种毒力因子的表达,而对细胞壁表面黏附蛋白表达和对抗宿主免疫反应呈负调控效应。目前,根据agr系统AIP序列和受体多态性将金黄色葡萄球菌分为4型(agr-Ⅰ~Ⅳ)。本研究中100株pvl基因阴性金黄色葡萄球菌菌株,以agr-Ⅰ型分布为主,其次为agr-Ⅱ型,agr-Ⅲ和agr-Ⅳ型总阳性率仅为5.0%;国外研究[18-20]显示:金黄色葡萄球菌中以agr-Ⅰ和agr-Ⅲ基因阳性率最高,与本研究结果存在一定差异,可能是由于不同地域分离株基因背景差异,从而导致agr基因型进化上出现差异。agr-Ⅱ型基因在国内外不同地区分布特征有所不同,国外研究[21-23]显示:MRSA株中agr-Ⅱ型基因阳性率明显高于其他3种agr亚型基因。本研究结果显示:MRSA中主要以agr-Ⅰ为主,agr-Ⅱ型基因阳性率仅为19.7%,与国内报道[24]一致,不同地区分离株agr基因多态性及其毒力调控特征需进一步探究。
金黄色葡萄球菌中agr是全局性调节因子,涉及34个基因的正调控和104个基因的负调控[25]。本研究进一步对agr调控系统调控的32个毒力基因在100株pvl基因阴性金黄色葡萄球菌中的分布特征进行了分析。金黄色葡萄球菌中溶血素基因高度保守,表现为对对宿主细胞的破坏及多种促炎效应[26]。本研究结果显示:溶血素基因hla和hld基因全部表达,与国内一些研究[27-28]结果一致。黏附素主要负责金黄色葡萄球菌与宿主细胞和细胞外基质进行黏附和生物膜的形成,本研究中黏附素基因clfA、clfB和sdrC携带率较高,均≥97.0%,与国外报道[12]结果一致;fnbA、cna和sdrE阳性率也较高(均≥90.0%),与国外一些相关研究[23,29]结果相近,高于国内另外一些研究[26,30]结果。
一项针对金黄色葡萄球菌毒力基因分布研究[29-30]显示:MRSA比MSSA菌株整体毒力基因携带率更高,MRSA携带的最常见毒力基因为sel、sec和tsst,与本研究结果存在一定差异。本研究结果 显 示 : MRSA 中 sdrE、 sea、 seb、 seh、 tsst、lukDE、lukM、hlb和mpHLG2基因的携带率略高于MSSA,而其他毒力基因携带率均低于MSSA,其中23.7%MSSA同时携带≥15个毒力基因,明显高于MRSA(14.5%),与国内报道[31]结果相一致。由于本研究检测毒力基因数量较多,对携带≥12个基因的菌株进行分型,MRSA主要以R6型为主,未检出R1和R2型;MSSA中R1~R4基因型均匀分布,R6型占比较少,未检测出R5型,结果提示:不同地区及不同来源的金黄色葡萄球菌毒力基因在MRSA和MSSA中的分布存在差异,可能与各地流行菌株的遗传背景差异有关。
产生生物膜的微生物可以高效黏附在各种介质(黏膜和导管等)表面,引起慢性难治性感染[32];此外,生物膜的独特结构不仅可有效阻挡抗菌药物的渗透和作用,对临床治疗此类感染带来了更巨大的挑战[33]。本研究结果显示:100株pvl基因阴性金色葡萄菌中产膜菌株占91.0%,明显高于国内外相关报道[32-34]。本研究所选菌株中,生物膜形成相关关键黏附基因fnbA、clfA和clfB携带率均在90%以上。覃金球等[33]研究发现:与非产膜菌比较,金黄色葡萄球菌产膜株对多种抗菌药物的耐药率整体偏高;但本研究及国外其他研究[32]显示:MSSA产膜能力和毒力基因携带率明显高于MRSA,但整体耐药率低于MRSA。因此,临床上应更加关注由MSSA引起的侵袭性感染,应采取更规范的治疗方案,防止因其高产膜特征演变为慢性难治感染。
综上所述,本研究所选pvl基因阴性MRSA和MSSA在耐药性、生物膜形成能力和毒力基因携带方面存在明显差异,MSSA中有较高比例多重耐药株。此外,MSSA毒力因子携带率和生物膜形成能力明显高于MRSA。对于pvl基因阴性MSSA所致侵袭性感染,临床医师应给予更多关注,特别是多重耐药MSSA。

