抗核抗体滴度及p53抗体对原发性肝癌的诊断价值
陈世豪,林耀威,汤翠霞
江门市新会区人民医院检验科,广东 江门 529100
原发性肝癌(primary hepatic carcinoma,PHC)是临床上常见的一类恶性肿瘤,其发病机制目前尚未明确[1-2],早期诊断对于PHC 的临床治疗及预后具有重要意义。然而,单一的影像学手段和血清学指标在早期诊断PHC上的价值有限,目前对于多采用联合诊断的方式进行早期诊断[3]。相关研究发现,在慢性肝病向肝癌发展的过程中通常伴随着两类自身抗体的产生,一类是抗细胞核和(或)细胞浆成分的自身抗体[4],另一类是肿瘤相关抗原(tumor-associated antigen,TAA)的抗体。检测原发性肝癌患者血清中的肿瘤自身抗体能够为肝癌的早期诊断和预后评估提供可靠信息[5]。本研究采集PHC、自身免疫性肝炎(AIH)患者和健康志愿者的血液样本,检测其抗核抗体(ANA)、肿瘤抑癌基因p53 抗体等指标,以探讨上述指标在诊断PHC上的临床价值,现报道如下:
1 资料与方法
1.1 一般资料 选择2020 年2 月至2021 年6 月江门市新会区人民医院收治的50 例PHC 患者作为PHC 组,选择同期50 例自身免疫性肝炎(AIH)患者作为AIH 组。纳入标准:①所有患者均经病理学明确诊断,PHC 组患者符合《原发性肝癌诊疗规范(2011年版)》[6]的相关诊断标准,AIH组患者符合《自身免疫性肝炎诊断和治疗共识(2015)》[7]中的相关标准;②能积极配合完成相关检查,检查结果资料完整。排除标准:①既往有放、化疗治疗史者;②合并严重意识障碍、精神疾病者;③合并严重糖尿病、甲亢、心脑血管疾病者。PHC组中男性34例,女性16例;年龄33~76 岁,平均(57.29±6.47)岁;单发 32 例,双发 18 例;肿瘤最大直径<5 cm 34 例,肿瘤直径≥5 cm 16 例;临床分期:Ⅰ期 9 例,Ⅱ期 17 例,Ⅲ期 14 例,Ⅳ期 10 例;有淋巴结转移33 例,无淋巴结转移17 例。AIH 组中男性 37 例,女性 13 例;年龄 31~78 岁,平均(58.11±6.53)岁。另选择同期50例健康体检者作为对照组,其中男性 36 例,女性 14 例;年龄 29~76 岁,平均(57.46±6.78)岁。三组受检者的性别和年龄比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,所有受检者均知情并签署知情同意书。
1.2 检测方法 三者受检者均采集5 mL血液样本(手术患者于术前1周采集,非手术患者和体检者于入院后1周内采集),以3 000 r/min的速度离心10 min,取上清液保存至-80℃的环境中待测。采用酶联免疫吸附试验法(ELISA)检测血清样本中的p53 抗体和ANA抗体表达,采用免疫印迹法检测ANA核型,试剂盒购自德国罗氏公司。所有指标测定均采用罗氏Cobas e602 全自动电化学发光免疫分析仪进行,试剂盒分别为人p53 抗体ELISA Kit(货号:CSB-E13816h)和人抗核抗体(ANA) ELISA Kit (货号:CSB-E09075h),所有操作均严格按照试剂盒上说明书进行。
1.3 观察指标 (1)比较三组受检者的ANA、p53抗体表达情况。(2)比较PHC组和AIH组患者的ANA核型。(3)分析血清ANA、p53 抗体与PHC 诊断的关系。(4)比较血清ANA、p53抗体及联合检测对PHC的诊断效能。
1.4 统计学方法 应用SPSS19.0 统计软件进行数据分析。计量资料符合正态分布,以均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析;计数资料比较采用χ2检验;采用二元Logistic回归分析法分析各指标检测结果与PHC诊断的相关性;采用多因素Logistic 回归模型,拟合多个变量形成新的联合预测因子,绘制各单一指标和联合预测因子的受试者工作特征曲线(receiver operating characteristic curve,ROC),比较联合预测因子与各单一指标的ROC 曲线面积(AUC)、敏感度、特异度和准确度。以P<0.05为差异有统计学意义。
2 结果
2.1 三组受检者的ANA、p53 抗体表达水平比较 PHC组患者的ANA阳性率、p53抗体水平明显高于AIH组,PHC组、AIH组患者的ANA阳性率、p53 抗体水平明显高于对照组,差异均有统计学意义(P<0.05),见表1。
2.2 PHC组和AIH组患者的ANA核型比较 PHC组患者的中斑点型、核仁型、着丝点型和胞浆型的比例明显高于AIH组,差异均有统计学意义(P<0.05),见表2。
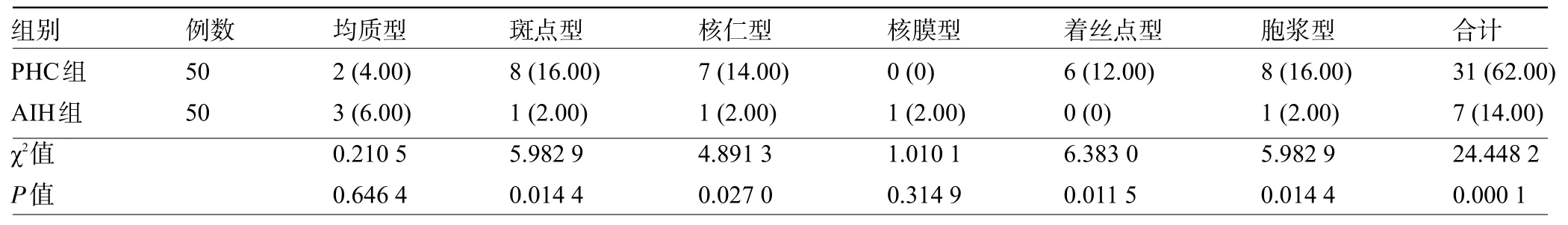
表2 PHC组和AIH组患者的ANA核型比较[例(%)]
2.3 血清ANA、p53抗体与PHC诊断的关系 经Logistic 回归分析结果显示,ANA、p53 抗体均与PHC的诊断密切相关(P<0.05),见表3。

表3 血清ANA、p53抗体与PHC诊断关系的Logistic回归分析
2.4 血清ANA、p53抗体及联合检测对PHC的诊断效能比较 ANA、p53 抗体及联合检测在诊断PHC上的 AUC 分别为 0.730、0.729 和 0.805,联合检测的敏感度、特异度、准确度分别为86.00%、92.00%、89.00%,均明显高于ANA、p53抗体单项检测,差异均有统计学意义(P<0.05),见表4和图1。

表4 血清ANA、p53抗体及联合检测对PHC的诊断效能比较

图1 血清ANA、p53抗体联合检测在诊断PHC上的ROC曲线
3 讨论
早期诊断并积极开展治疗是提高PHC 患者生存率、改善预后的关键。目前,PHC 的临床诊断主要依靠影像学检查、肝组织活检、血清学标志物等手段进行[8]。然而,多普勒超声、CT、MRI 等影像学手段难以发现诸如小肝癌等体积较小的肿瘤病灶。肝组织活检结果准确可靠,但该检查属于有创检查,取样受限较多,患者通常不易接受。与上述检查手段相比,血清学标志物检测具有无创、操作简便等优势,另外,血清学标志物在影像学手段察觉异常前就已出现异常表达,对于肿瘤的早期检测和预警具有积极意义[9-10]。
PHC 发生时,机体通常会产生两种抗体,抗细胞核和(或)细胞浆成分的自身抗体与肿瘤相关抗原的抗体。ANA 能够将自身真核细胞的各种成分作为靶抗原的自身抗体,可有效识别各种细胞核组织[11]。p53是目前研究较为透彻的抑癌基因之一,其定位于染色体17p13.1,具有监视基因组完整性、控制调节细胞分化、凋亡、衰老等多个细胞功能[12]。相关研究表明,ANA、p53 抗体在PHC 患者的血清中存在高表达,且与肿瘤大小、分期、Child-Pugh积分、AFP含量呈正相关[13]。
本研究对PHC 患者、AIH 患者和健康体检者的ANA阳性率、p53 抗体进行比较,结果显示,PHC患者的ANA 阳性率、p53 抗体水平均明显高于AIH 患者,PHC 患者、AIH 患者的 ANA 阳性率、p53 抗体均明显高于健康体检者。Logistic 回归分析结果显示,ANA、p53抗体均是影响PHC诊断的独立因素。陈子若等[14]的研究结果表明,PHC 患者的p53 抗体水平、p53阳性表达率和AFP 水平均明显高于肝脏良性病变者。曹成红等[15]的研究结果表明,病毒性肝炎患者的血清AFP、ANA水平明显高于AIH患者。本研究结果与上述两者的研究结果基本吻合,ANA、p53抗体在鉴别诊断PHC 上具有一定价值。分析原因,AIH 发生后,肝细胞抗原的持续性作用引起过度炎症反应和局部肝细胞坏死,诱发AFP 促使机体免疫调节功能发挥作用,增强肝细胞的自我修复能力,与此同时,患者通常伴有不同程度的肝功能损伤,引发自身免疫功能失衡。从AIH发展到PHC,可进一步加重自身免疫功能失衡[16],ANA、p53 抗体等自身抗体水平出现异常升高,而患者的ANA 核型也更多地表现为斑点型、核仁型、着丝点型和胞浆型。
ROC曲线结果显示,ANA、p53抗体在诊断PHC上的AUC分别为0.730、0.729,均>0.6,提示上述指标在诊断PHC上具有较好的临床价值。上述指标联合检测的AUC为0.805,敏感度、特异度和准确度分别为86.00%、92.00%、89.00%,均明显高于ANA、p53 抗体单项检测,说明联合检测能够显著提高PHC诊断的准确率。
综上所述,ANA、p53 抗体在诊断PHC 上各具优势,两者联合检测能够有助于进一步提升PHC的诊断效能,对于PHC 患者的早期诊断、个性化治疗策略的制定以及预后评估提供重要依据。

