MCU 及复合物与人类相关疾病的研究进展
赵杨,王培,杨颖 综述,习瑾昆,贺永贵 审校
(1.华北理工大学基础医学院,河北省慢性疾病基础医学重点实验室,唐山 063000;2.华北理工大学公共卫生学院,唐山 063000;3.华北理工大学临床医学院,河北省医工融合精准医疗重点实验室,唐山 063000)
线粒体是(ATP)生成的重要场所,也是细胞Ca2+信号传递的积极参与者,它可以通过缓冲作用来维持细胞内Ca2+水平,当胞质内Ca2+浓度升高时,线粒体有效地吸收Ca2+,以维持胞质内Ca2+浓度平衡,这种线粒体Ca2+吸收机制是由高选择性的线粒体钙离子单向转运蛋白(mitochondrial calcium uniporter,MCU)及其复合物介导的[1]。MCU 功能受损,导致线粒体Ca2+超载,触发细胞色素C 释放,活性氧簇(reactive oxygen species,ROS)过度产生,线粒体通透性转换孔 (mitochondrial permeability transition pore,mPTP)开放,线粒体肿胀,最终导致细胞凋亡[2]。MCU及其复合物在疾病的发展过程中具有关键作用。因此,探究其作用与功能可能成为多种疾病治疗的重要靶点之一,文中回顾了MCU 及MCU 复合物的功能,以及在不同疾病中的作用,以期为以后多种疾病的治疗策略提供参考。
1 MCU
MCU 是重要的Ca2+转运蛋白,在大多数真核生物中表达,在细菌基因组中也可检测到MCU 同源物。MCU 蛋白由两个跨膜螺旋与一个含酸性残基的短环相连,MCU 是较大的MCU 复合物中的中心Ca2+转运通道,MCU 有助于线粒体Ca2+的吸收,以应对细胞内Ca2+的小幅度生理性升高和线粒体外Ca2+的大幅度升高[3]。MCU 单向转运Ca2+的作用在不同系统中得到了证实[4-6],研究显示,沉默MCU 可以抑制肝细胞线粒体Ca2+的吸收[4],新生大鼠心肌细胞[5]、神经元[6]中沉默MCU 也有类似的现象。这证实了MCU 是Ca2+急性涌入线粒体基质所必要的蛋白。
2 MCU 复合物
生理情况下,MCU 并非单独发挥功能,它与其他蛋白分子结合,构成线粒体Ca2+转运体复合物,从而共同参与线粒体Ca2+的转运。线粒体Ca2+单向转运蛋白复合体由核心通道蛋白MCU、线粒体钙摄入蛋白(mitochondrial calcium uptake,MICU)、线粒体负性孔隙形成亚基(MCU regulatory subunit b,MCUb)以及其他线粒体钙单向转运体调节蛋白(essential mitochondrial calcium uniporter tegulator,EMRE)共同组成[7]。图1 为MCU 复合物示意图。
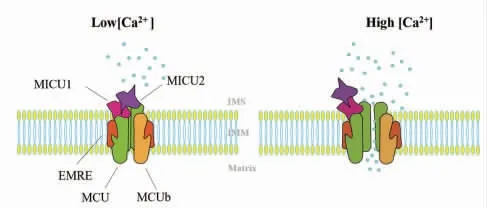
图1 MCU 复合物示意图
2.1 MICU 家族 包括MICU1 和MICU2 两个同源蛋白,其分子量为45~55 KD。MICU1 蛋白位于线粒体内膜(inner mitochondrial membrane,IMM),而与Ca2+结合的两个EF 臂结构面向线粒体膜间隙(intermembrane space,IMS)。研究显示,与Ca2+结合的EF 臂为MCU 通道活性调节器,当细胞内Ca2+浓度下降,MICU1 使MCU 处于关闭状态,防止Ca2+流入线粒体基质;当Ca2+浓度增加,MICU1 的EF 臂结构诱导MCU 开放,使Ca2+流入线粒体基质。因此,MICU1 发挥“守门员”的作用[8]。MICU2 蛋白位于IMS,广泛分布于内脏器官[9]。研究表明,MICU1、MICU2 与MCU 三者之间相互作用[8],在HeLa 细胞中,MICU2 表达降低多由MICU1 的减少所致,而过表达MCU 会促进MICU1 和MICU2 的表达[10]。
2.2 MCUb MCUb 是一个33 KD 的调节蛋白,其与MCU 序列相似性为50%。就蛋白拓扑结构而言,MCUb 与MCU 相似度极高,由于它具有N 端和C端均指向IMS 的两个跨双层膜的结构域,因此MCUb 的表达水平较低。正常细胞中MCUb 的过表达会抑制线粒体Ca2+摄取[11]。
2.3 EMRE EMRE 是10 KD 的单通道跨膜蛋白,是构成单向转运复合物的亚基,位于IMM 上且具有高度保守性,其C 末端区域富含有天冬氨酸。研究证明,EMRE 具有桥接作用,将处于IMS 的钙离子感受蛋白MICU1、MICU2 和处于IMM 上的MCU 结合在一起[12]。EMRE 下调可使线粒体Ca2+水平显著降低,提示线粒体Ca2+摄取需要EMRE 的参与[12]。
3 MCU 及复合物与人类疾病
3.1 MCU 及复合物与肿瘤 线粒体Ca2+水平在肿瘤发生与发展中起着重要作用。MCU 在不同类型癌症中表现出不同的表达水平。MCU 在乳腺癌和结直肠癌中的作用得到了广泛的研究,乳腺癌中,MCU高表达促进了癌细胞上皮间质转化和转移[13]。最近研究显示,MCU 在癌细胞迁移和侵袭中发挥重要作用,MCU 表达与三阴性乳腺癌(triple negative breast cancer,TNBC)的肿瘤大小和淋巴结浸润有关[14]。敲除MCU 可以减弱癌细胞的侵袭能力,抑制肿瘤生长,沉默MCU 可以抑制线粒体ROS 产生并降低低氧诱导因子(HIF)1-α 的表达[14]。在乳腺癌中,MCU水平与HIF1-α 信号转导呈正相关[15]。总之,MCUROS 的相互作用是TNBC 的一个重要调节因素,可以作为TNBC 治疗的一个重要靶点。
在结肠癌中,MCU 的过度激活促进了癌细胞的增殖,而MCU 的敲除和抑制可大大减少癌症的发展,过表达MCU 及复合物可能有助于癌细胞的化疗效果[16]。在胰腺癌和结肠癌中,MICU1 和MICU2的过度表达会降低线粒体Ca2+水平,并防止线粒体Ca2+超载诱导的细胞凋亡[17]。在胰腺癌中,组氨酸三联体核苷酸结合蛋白(histidine triad nucleotide-binding protein,HINT2)能促进细胞死亡,这与MCU 调节和Ca2+流入有关[18]。HINT2 的表达可抑制细胞凋亡,此作用被MCU 抑制剂钌红所阻断,而腺病毒载体过度表达HINT2 会增加线粒体的Ca2+,使MICU1 和MICU2 下调、EMRE 上调[18]。MCU 及其复合物在多种肿瘤中发挥作用,抑制其功能,可以缓解肿瘤的发展。
MCU 不仅参与肿瘤的发生与发展,也与类癌症疾病如肺动脉平滑肌细胞过度增殖、迁移和抵抗凋亡等密切相关,肺动脉高压(pulmonary aterial hypertension,PAH)时血管病变导致MCU 复合体受损,MCU 下调和MICU1 蛋白上调[19]。MCU 功能失调不仅使细胞内Ca2+超载引起细胞增殖和迁移,而且还减少了线粒体Ca2+,从而抑制了丙酮酸脱氢酶和葡萄糖的氧化,而microRNA 介导的MCU 及复合物可以作为调控目标,在疾病的早期阶段,具有关键的指导作用[20]。MCU 及复合物与临床多种肿瘤及相关疾病关系密切,其在不同肿瘤中的作用还需进一步深入探究。
3.2 MCU 及复合物与神经性疾病 神经元作为可兴奋的细胞,不断发射动作电位,并产生大量的Ca2+信号,以增加代谢需求来维持Ca2+的平衡。帕金森病(Parkinson′s disease,PD)是由α-synuclein 在大脑中聚集而引起线粒体Ca2+超载、ROS 生成过多的神经元损伤性疾病[21]。最近报道显示,在PD 发病早期,抑制MCU 或MCU 复合物的功能,MICU1 可以被蛋白连接酶所降解,导致线粒体Ca2+吸收增多和细胞凋亡[22]。因此,MCU 或MCU 复合物在PD 发病过程中发挥关键作用。除了神经退行性疾病外,MCU 及其复合物已被确认在神经肌肉疾病中发挥重要作用,MICU1 的缺失或突变诱发学习困难和进行性运动紊乱,这些症状与线粒体Ca2+超载以及线粒体断裂密切相关[23]。以上研究显示,MCU 及其复合物在神经系统疾病中具有重要作用,适当调节线粒体Ca2+摄取,维持钙稳态,可能是神经性疾病的重大治疗策略。
阿尔茨海默症(Alzheimer′s disease,AD)为临床上出现频率最高的一种神经退行性疾病,β-淀粉样蛋白在AD 患者的脑组织中特异性积累,线粒体功能紊乱是AD 发生的重要特征[24]。β-淀粉样蛋白在脑组织中的积累导致线粒体Ca2+摄取增加,导致细胞因兴奋性中毒死亡[25]。研究显示,用MCU 抑制剂钌红抑制MCU 的作用,可以减缓AD 的发生[26]。MCU及其复合物在AD 中的协同作用机制还需要进一步探究。
3.3 MCU 及复合物与心脏相关疾病 作为MCU复合物的核心通道,MCU 可以介导线粒体Ca2+转运,参与调控ATP 的生成[27]。ATP 生成可以由线粒体Ca2+转运来实现,为心肌提供能量[28]。
通过MCU 通道进入的大量Ca2+可以使线粒体Ca2+超载,在缺血再灌注损伤条件下,导致持续的线粒体Ca2+摄取。这种线粒体Ca2+的持续性升高破坏了生理性的Ca2+出入循环而导致mPTP 激活[29]。mPTP 是一个电压依赖性、高电导率的孔,横跨线粒体外膜(outer mitochondrial membrane,OMM)、IMS、IMM 和基质。触发该孔的两个已知因素是基质Ca2+和ROS 的含量。mPTP 开放导致质子梯度的耗散,抑制ATP 的水解,水和溶质迅速涌入,导致线粒体肿胀,最终导致细胞坏死[29]。mPTP 开放是决定心肌损伤的一个关键因素,也是心肌保护的重要方向。课题组前期研究显示,白藜芦醇、锌离子等均可以通过抑制mPTP 开放发挥心肌保护作用[30-31]。Ca2+超载是诱发mPTP 开放的重要因素之一,Ca2+内流不断增多导致胞质Ca2+大量积累,随着电化学梯度进入到线粒体中,使得线粒体Ca2+超载进而mPTP 开放,抑制MCU的表达有助于减轻Ca2+超载所导致的mPTP 开放[32]。
研究证实,在MCU 基因敲除小鼠中,对小鼠左冠状动脉结扎40 min 再灌注24 h 诱发心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI),心肌肌钙蛋白升高和心肌梗死面积增加,差速离心法分离线粒体并用分光光度计检测mPTP 的开放程度,在Ca2+增加后线粒体未肿胀且吸光度显著降低[33]。上述结果提示,MCU 缺乏可抑制Ca2+进入线粒体基质,阻止mPTP 开放,减弱MI/RI 诱发的心肌细胞的凋亡,发挥有效的心肌保护作用。而改善MI/RI,MCU 的缓慢调节并非可靠的方法,只有迅速抑制MCU 才有可能成为预防MI/RI 诱导细胞凋亡的治疗方案[34]。也有研究认为,心肌再灌注使MICU1表达降低,心肌梗死面积明显增大,心肌细胞凋亡明显增多。其机制可能是通过MICU1 抑制线粒体Ca2+超载来实现的[35]。
在心肌梗死中,心肌细胞缺血可以导致线粒体内Ca2+超载并减少线粒体中MICU1 的表达[36],因此,MICU1 可能通过抑制Ca2+超载缓解心肌缺血性损伤。研究还显示,MCU 复合物相关蛋白EMRE 的过表达,加剧了心肌缺血性损伤,增加了心肌梗死面积,加快了心肌细胞的凋亡,其可能的发生机制与线粒体ROS 产生密切相关[37]。然而,MICU1 在心肌梗死中的具体机制,MICU1、EMRE 是如何通过MCU 调节心肌缺血性损伤还需要进一步详细研究。
线粒体Ca2+可以影响ATP 的生成和线粒体ROS 的产生,进而引起线粒体功能障碍或心肌相关疾病。因此,维护线粒体能量代谢,控制其Ca2+超载、ROS 产生是预防心肌疾病的重要策略[38]。研究证实,MICU1 表达增加可以显著减轻糖尿病小鼠的心室肥大,抑制线粒体ROS 的生成,说明MICU1 具有改善糖尿病心肌病的心脏功能的作用[39]。MICU1 上调后应用siRNA 干扰MCU 的表达,线粒体Ca2+摄取能力显著降低,同时凋亡蛋白表达明显上升[39]。上述研究表明,MICU1 可以通过MCU 抑制心肌细胞线粒体ROS 的生成,有效减少心肌细胞凋亡。而MCU的调节蛋白EMRE 的表达升高会引起线粒体Ca2+超载加剧ROS 的生成,ROS 线粒体释放至胞浆,激活了下游的某些信号通路,使心肌细胞凋亡,最终导致糖尿病心肌病发生[40]。因此,MCU 及其复合物在心肌疾病中发挥重要作用。
综上所述,MCU 及其复合物通过不同的机制对疾病产生多种影响,本文重点探讨了MCU 和MCU复合物的特点和功能及其在协同介导Ca2+转运、线粒体Ca2+摄入中的重要作用。MCU 及复合物在肿瘤、神经退行性疾病、心肌疾病中具有重要作用,表明调控MCU 及其复合物可能是疾病治疗的新靶点。有鉴于此,需进一步探讨MCU 及其复合物与疾病的发生机制,为新药研发提供新思路。

