生理药代动力学模型用于中药风险评估的思考及认识
苏布达,李晓萌,刘 慧,杨珅珅,魏金霞,李遇伯
·专 论·
生理药代动力学模型用于中药风险评估的思考及认识
苏布达,李晓萌,刘 慧,杨珅珅,魏金霞,李遇伯*
天津中医药大学中药学院,天津 301617
中药含有的内源性有毒成分和外源性有害残留物已经成为威胁人体健康安全的危险因素,其严重制约了中药产业的可持续发展。风险评估是控制中药质量、保障用药安全的有效科学手段。通过具体剖析中药毒害物风险评估研究现状及问题,以解决关键性问题为切入点,总结国内外风险评估相关文献,提出了生理药代动力学(physiologically based pharmacokinetic,PBPK)模型的实用性,重点阐述其在风险评估研究中用于组织内剂量预测、跨物种种间剂量外推、不同暴露途径及剂量药动学预测以及不同生命阶段或疾病人群药动学预测的功能优势和局限性,探讨PBPK模型在中药毒害物风险评估研究中的潜在利用价值,以期为中药安全性评价和限量标准制定提供技术参考及新策略。
中药毒害物质;风险评估;生理药代动力学模型;剂量外推;药动学预测;安全性评价
近些年来,中药不仅对常规疾病有较好的治疗作用,还在新型冠状病毒肺炎、埃博拉病毒等传染性疾病以及癌症等疑难重病的治疗中发挥了积极疗效,广泛获得中国民众乃至世界各国人民的信赖[1-3]。然而“马兜铃酸事件”及“中药重金属严重超标”等不良事件时有发生[4-5],警示了中药中的内源性有毒成分,如马兜铃酸、吡咯里西啶生物碱、雷公藤素及蒽醌类成分等,以及在种植加工过程中的污染重金属及有害元素、农药及植物生长调节剂、二氧化硫、色素等在人体内累积造成损害的外源性有害物质,已经成为威胁人体健康的潜在危险因素[6-7]。
1 中药风险评估的现状
健康风险评估是发现毒性风险并预防潜在危害,保障人体健康安全的有效措施,是通过描述某些物质或活动对人体产生有害影响的可能性及危害程度,给出合理、安全的暴露剂量限值的科学评估方法[8]。经典风险评估研究分为危险识别和危害特征描述(统称为危害评估)、暴露评估及风险特征描述4个基本步骤[9]。近年来国内有研究团队主要借鉴了这一经典风险评估模式,并结合中药临床用药特点,构建了适用于中药外源性有害物质的风险评估模型,为中药安全风险控制奠定了坚实的研究基础[10]。由于中药成分复杂多样且有多味药配伍作用的特点使得难以快速明确其毒性物质基础,并且药物本身存在毒性成分时需要权衡风险程度与药物临床效益之间的关系[11-12]。这为中药内源性有毒物质的风险评估带来了一定的难度。目前我国中药风险效益评估仍在初步研究阶段,尚未形成完整的理论体系[13]。
1.1 危害评估
危害评估方法是通过收集大量毒害物相关体外和体内毒理学、毒代动力学(toxicokinetics,TK)及毒效动力学(toxicodynamics,TD)研究和流行病学调查信息进行危害识别和特征描述,主要根据随剂量增加引起的病理变化作为毒性反应结点,综合分析剂量与毒性效应关系,确定毒性初始剂量(points of departure,POD)进而推算安全参考剂量(reference dose,RfD)的过程[14-17]。目前中药外源性有害物危害评估主要参考了联合国粮食及农业组织和世界卫生组织、美国环保署及欧洲食品安全局等国际权威机构发表的最新评估报告及数据[10]。然而经典的危害评估方法依然存在一些问题:(1)毒性信息很大程度上来源于动物实验研究,造成了大量的动物资源和测试成本的消耗[18]。此外实验动物和人的生理生化构造不同以及物种间代谢差异引起的选择性毒性反应等现实问题,直接通过动物研究结果评估人体潜在毒性存在极大的不确定性[19]。(2)剂量反应评估时主要以体外摄入量引起机体病理生化指标变化作为毒性反应结点[20]。而越来越多人认为体外剂量不能准确反映毒害物在体内靶部位的累积毒性,且病理生化结果作为毒性反应结点并不意味着适用于所有物种及个体[21]。(3)流行病学调查主要通过问卷及统计方式获取,无法排除个体间不同的生理、活动及摄入途径引起的差异,且只限于局部地区的人群,大量的毒害物缺乏流行病学或临床相关信息[22-23]。
1.2 暴露评估及风险特征描述
暴露评估及风险特征描述是定性和定量评估毒害物质目标人群及暴露途径、持续时间、频率和程度,并将暴露评估结果与参考剂量进行比较分析,得出合理安全指导建议的过程[24]。暴露评估可分为体外和体内评估。外暴露评估是指通过毒害物质在摄入物中的残留情况和目标人群的摄入模式估算暴露量,反映个体暴露估计值,而内暴露评估则指通过人临床监测研究直接测量人体内暴露量,反映个体真实暴露水平[25]。目前中药外源性有害物质的暴露评估是结合目标人群的中药服用模式和中药中有害物的残留量,通过急性和慢性膳食暴露公式计算获得的体外暴露值[26]。传统的暴露评估及风险特征描述仍有一定的局限性:(1)临床监测研究虽然是人体接触毒害物质的直接证据,但只能提供人排泄生物样本的定量数据,无法得到体内变化信息[27-28];(2)无法针对婴幼儿、青少年、孕妇及老年人等敏感人群以及疾病人群进行精准风险描述[29-31]。
基于以上问题,越来越多专家学者将生理药代动力学(physiologically based pharmacokinetic model,PBPK)模型用在不同物质的风险评估中,其目的为更好地推测毒害物质人体安全参考剂量范围,改善剂量反应评估及暴露评估方法的准确度和变异性,以期提高风险评估的可信度,同时减少动物消耗及检测成本和时间[32-33]。目前PBPK模型主要用于有毒有害物的组织内剂量预测、跨物种种间剂量外推、不同暴露途径及剂量体内药动学(pharmacokinetics,PK)预测以及不同生命阶段或疾病人群PK预测等风险评估的各个研究阶段,已经发展成为科学可靠的定量风险评估工具(图1)[34]。但是还未在中药毒害物质的风险评估中得以充分应用。因此,本文通过总结国内外研究文献,客观描述PBPK模型在健康风险评估中的应用及功能优势和局限性,发现在中药风险评估中的潜在利用价值,为中药安全性评价提供技术参考,以期为中药毒害物质健康风险评估和限量标准的制定提供新策略。
2 PBPK模型在健康风险评估中的应用
PBPK模型是根据机体生理和解剖学特性,将机体分为快速灌注和缓慢灌注2个聚集隔室,其外的每一个器官或组织看作一个房室,通过血液流向将其串联成整体的机体循环系统,结合物质动力学特征构建PBPK结构模型,利用物质化学性质及实验研究数据,通过质量守恒方程定量描述物质在体内的吸收、分布、代谢和排泄(absorption, distribution, metabolism, and excretion,ADME)过程,是预测毒害物质在生物体内经时变化的数学模型[35-36]。毒理学与风险评估领域也将其称之为生理毒代动力学(physiologically based toxicodynamic model,PBTK)模型和生理生物动力学(physiologically based biokinetic model,PBBK)模型[37]。PBPK模型不仅用于单个小分子化学物质,还扩展到了化学混合物[38]、单克隆抗体[39]、蛋白质[40]、核苷酸和纳米粒子[41]及细胞等其他各类物质的模拟。广泛用于药品和食品残留毒物以及环境污染物等有毒有害物质对人体健康和生态环境的风险评估研究[42-43]。
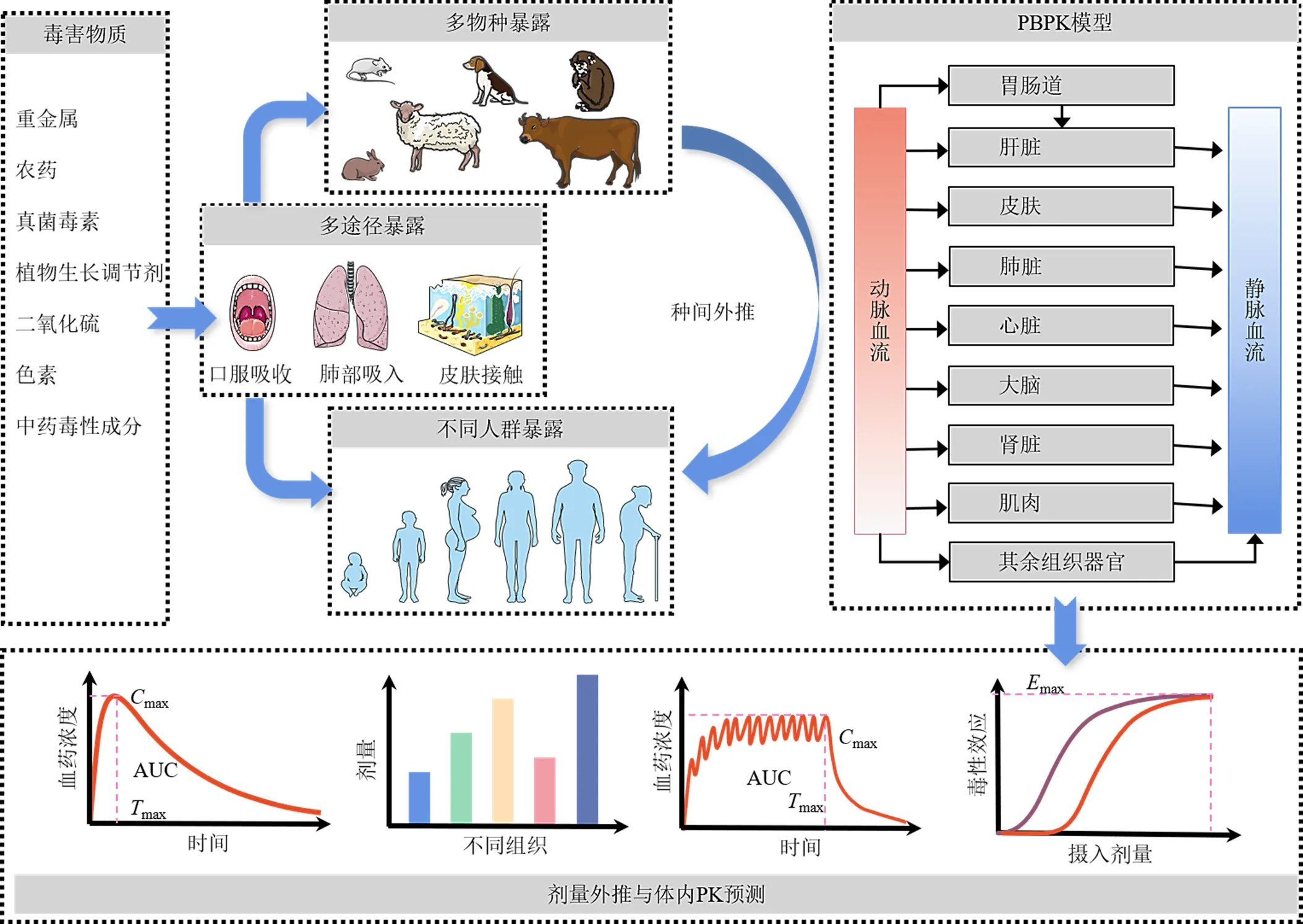
图1 PBPK模型在风险评估中的应用
2.1 用于组织内剂量学预测
剂量反应评估是描述毒害物潜在暴露风险的先决条件,其安全参考剂量预测的准确性直接影响人体健康风险的评估结果[44]。一般来说,大多数毒害物的参考剂量基本由实验动物体外毒性剂量推导所得[45]。然而毒害分子与人体内靶部位相互作用而引起毒性效应,且由于其自身的化学性质在体内发生特定代谢反应以及经胃肠道吸收引起食物效应,导致无法全部进入体循环,影响最终的系统生物利用度。往往许多化学物质组织内剂量和体外剂量之间存在非常显著的非线性关系[46]。因此,人们普遍认为达到靶组织的物质剂量水平比体外摄入量毒性评估的准确性更高[47-48]。因此很多风险评估专家将靶器官或组织内剂量作为推算参考剂量的关键性指标[49-50]。
而PBPK模型的一大优势是能够将毒害物体外和体内剂量相关联起来,结合药效学(pharmacodynamics,PD)模型建立“暴露-剂量-反应”关系,是预测毒害物组织内剂量的首选方法[51-52]。PBPK模型在组织剂量学预测方面有3点功能优势:(1)PBPK模型通过模拟毒害物体内特定的ADME动态机制过程,用于预测毒害物在靶部位内随时间变化的浓度曲线及重复摄入后体内累积剂量[53];(2)PBPK模型是根据生物体组织结构所构建的生理学模型,可用于体内任何一个组织或器官内的剂量预测;(3)PBPK模型中纳入了胃肠道腔内食物流体动力学数据,可用于预测食物摄入对毒害物口服吸收过程中溶解度或溶解速率的影响,有利于提高毒害物组织分布量预测准确度[54]。目前已经有大量的PBPK模型用于组织剂量学预测研究。如由于很难测量人体组织内剂量,Zhang等[55]为了评价饮用水中2种溴乙腈对人体暴露健康风险,构建了PBPK模型用于评估溴乙腈经饮用水摄入人体后的非致癌风险概率。所构建的PBPK模型很好地模拟了溴乙腈在人体不同组织中的浓度随时间的分布变化,预测了不同器官非致癌危险值排序,且表示组织血液分配系数和各组织内血流量主要影响溴乙腈在不同组织中的浓度顺序。
在PBPK模型中预测组织器官浓度最关键的参数为毒害物组织血浆分配系数。该参数可通过动物PK研究、体外平衡透析技术等实验方法或定量构效关系计算机预测方法获取[56-57]。但由于组织血浆分配系数代表稳态条件下组织和血浆之间化合物浓度曲线下面积的比率,受溶解度、血浆/组织游离分数(up/ut)、油水分配系数(lg)、电离常数(pa)、组织/血浆组成等各种物理化学和生理因素的影响[58-59]。因此由于动物个体差异和体外实验结果误差以及计算机预测方法需要进一步验证等问题,使PBPK模型在组织内剂量预测中有数据来源的局限和可变性。
2.2 用于跨物种种间剂量外推
大部分毒害物危害识别数据基本来源于动物毒性研究,因此需要将动物研究确定的POD通过体质量或体表面积比例缩放并除以不确定系数推导出人体安全参考剂量[60]。然而由于动物与人体间的TK差异,动物实验结果并不能真实地反映人体毒性。因此,动物毒性信息到人体风险信号的准确转化成为了主要难点[61]。而PBPK模型的出现,为解决这一难题提供了有效的转化方法[56]。
PBPK模型在跨物种种间剂量外推方面呈现了独特的优势。主要有2点原因:(1)PBPK模型中纳入了文献中不同动物或人体生理学信息,包括体质量、组织体积、心输出量、组织血流量、酶和转运体的丰度以及膜表面积等经验数据[62]。根据物种的生理生化参数的差异可分别搭建不同物种的PBPK模型,更接近于真实的模拟某一物种的生理学特征,可以很好地代替风险评估中通过种属间或种属内不确定系数推算人体参考剂量的保守估计方法,大大提高准确性。如Sharma等[63]先构建了氟他胺及其代谢物大鼠PBPK模型作为基础模型,假设人体与大鼠组织血浆分配系数相同,将组织体积、流经组织的血流量等生理参数调整为符合人体的数值,另外加入了氟他胺人特征性体外代谢参数,从大鼠模型外推建立了人体PBPK模型,并采用临床单次及多次口服不同时间点的血药浓度数据验证了模型的可行性,构建成功的PBPK模型可用于氟他胺人体参考剂量的外推。(2)PBPK模型不仅适用于哺乳动物,如老鼠、猴子和人类,也适用于食物生产物种,如牛、猪、羊、鸡、狗、马,以及一些鱼类和软体动物,其应用范围非常广泛[37]。如有研究人员基于全氟辛烷磺酸TK特征分别建立了全氟辛烷磺酸小鼠、大鼠、猴子和人体PBPK模型,并通过不同物种的实验观测值验证了模型的预测性能,将模型成功用于全氟辛烷磺酸的人体参考剂量外推[64]。
由于PBPK模型中纳入了多来源的生理参数,以及个体差异或随年龄、遗传多态性和疾病状态的生理学改变,导致这些参数存在不完全拟合某一特定物种或品系的情况[65]。除此之外,人体和动物体内组织及代谢构成有较大差异[66],因此,PBPK模型中代谢相关数据是不同物种间剂量外推的主要影响参数,包括肝脏、肾脏及肠道内清除率(CL)及其固有清除率(CLint)、代谢酶反应速率常数(max)和米氏常数(m)等[67]。这些参数主要来源于动物和体外研究,并且很多研究人员为了提高参数的准确度,开发了各种异速放大方程用于不同物种间和体外到体内参数的转换[47]。常用的异速放大算法有游离分数校正的幂指数法、单种属法和游离分数截距校正法等[68]。当前普遍通过人源体外代谢实验获取PBPK模型所需的代谢相关参数,但由于生物转化酶在体内和体外系统中所处的环境不同,会导致底物利用率和酶性能的差异表现,实验结果与体内效应出现一定偏差[69]。因此,在PBPK建模过程中代谢数据的稳定性非常关键。
2.3 用于体外到体内剂量外推
近些年,美国国家研究委员会等权威机构开始呼吁进行基于人体细胞、细胞系或类组织器官的毒性机制研究[18],通过识别毒害分子有害结局路径阐明其毒作用模式[70],取代通过病理变化识别毒性的动物研究,为人健康风险研究提供高通量、快速有效的危害识别方法[71]。然而如何将体外的局部效应浓度定量地转化为体内摄入量成为巨大的挑战。PBPK模型能够将局部(细胞、器官和内分泌系统)毒性效应水平与全身暴露联系起来[72]。因此很多研究人员将体外获得的毒性效应浓度作为POD并与体内靶组织浓度相关联,通过PBPK模型以反向剂量法推导毒害物人体安全参考摄入量,该方法简称为体外到体内定量外推法(quantitativetoextrapolation method,QIVIVE)[73]。
PBPK模型在体外到体内剂量外推的应用中呈现3点优势:(1)在非动物实验模式下,PBPK模型可将体外获得的毒害物ADME相关实验结果整合成完整的PK进程模型[74];(2)可在PBPK建模方程中灵活的调整或增加体外衍生的化学特异性影响参数,建立符合毒害物特定TK行为的专属模型;(3)由于PBPK是机制驱动模型,可结合定量构效关系技术对毒害物暴露于体外细胞的剂量水平及时间分布提供重要的预测信息,可用于指导设计合理的体外实验方案[75]。目前PBPK模型在QIVIVE研究中有了很好的实践应用。如Lin等[76]利用ToxCast体外高通量筛选技术结合QIVIVE法进行了双酚A及其类似物共同暴露于人群的风险评估,利用PBPK模型将体外雌激素受体生物活性浓度转换为人体口服剂量。
对体外系统来说,细胞来源和体外培养环境与人体的相关性对于准确反映毒害物的体内TK/TD行为起关键作用[77],且很多研究人员指出毒害物与蛋白结合特征及清除率是引起化合物体外和体内活动差异的主要影响因素[78-79]。需要注意的是任何体外模型都是极简化的人体局部模型,无法完全复制机体内部整体的相互作用。因此,当基于体外研究建立PBPK模型时,确保关键影响参数的数据质量,将有助于减少模拟误差有效增强模型预测性能。另外,在进行体外TD研究时,根据毒性关键分子事件选择合理的效应-浓度指标作为体外POD,一定程度上可提高利用PBPK模型预测体外安全剂量的准确度[80]。虽然体外系统仍无法克服动物实验的缺点,但可作为有力的补充。现如今研究者们投入了大量精力致力于开发3D培养系统及类器官模型等微物理系统和人类基因芯片等新兴技术,以期构建更接近生物体的体外模型,这将有利于改善体外系统与人体的相关性[80]。
2.4 用于不同暴露途径及剂量体内PK预测
毒害物质常以饮食摄入、空气吸入、皮肤接触等多种途径暴露于人体。由于通过不同的接触部位进入体内,会显著改变毒害物吸收和分布过程,因此针对不同途径进行相应的体内PK评估,对于明确毒害物多途径暴露于人体的潜在安全风险非常关键[81]。PBPK模型是最有效的多途径和不同剂量PK预测工具[82]。其功能特点有:(1)PBPK模型根据吸收途径的生理结构特征构建房室模型,细化模拟毒害物进入体内的吸收过程。如毒害物最主要的暴露途径为口服吸收,PBPK模型可细分各个胃肠段形成高级吸收房室模型,模拟毒害物沿胃肠道管腔直到通过肠细胞层顶膜的溶解、吸收及溶出整个过程[83]。皮肤接触途径根据实际皮肤层分为3层:角质层、活表皮、真皮层[36]。PBPK模型可模拟毒害物在皮肤表面沉积后,扩散到角质层和活表皮层形成一个储存库,再缓慢吸收到真皮和血流中的过程构成皮肤吸收房室模型[84]。而PBPK呼吸道吸入房室模型鼻腔和上气道由组织间隔分为腔、上皮和黏膜下组织层[85]。(2)PBPK模型已经广泛用于毒害物口服吸收、注射给药、肺部吸入、皮肤渗透等多途径的PK预测。另外,根据实验操作的实际情况,可构建ig、sc和ip等途径的动物PBPK模型[86]。(3)PBPK模型可通过调整剂量进行高剂量到低剂量的有效外推。实际场景中毒害物多以低剂量暴露于人体,但动物实验往往在高剂量条件下进行毒性研究,使得有些物质在体内出现代谢饱和现象,导致外暴露剂量与中毒风险之间形成非线性关系,造成风险评估误差。PBPK模型中纳入了代谢信息,既可以用于描述物质线性动力学过程,也可通过非线性方程描述饱和清除过程[87]。
2.5 用于不同生命阶段或疾病人群PK预测
不同健康以及疾病人群,随着年龄增长及生病过程中体内生理特征会发生改变[88],如老年人代谢活性下降、新生儿肾脏清除率低、怀孕人群血浆白蛋白浓度下降到正常水平的2/3左右等[89]。老年人、孕妇、儿童等敏感群体比成年人更容易受到毒害物的不良影响,尤其是疾病人群,免疫功能的下降使其极易受到身体损害,导致这类人群的风险大大加剧。由于难以获取这些敏感和疾病人群的临床监测数据,PBPK模型提供了一个虚拟的模拟平台,用于预测这类人群体内PK和组织内剂量,为风险评估研究提供有效数据信息[90]。
PBPK模型有3点用途:(1)PBPK模型中纳入各个生命阶段人体生理信息,不仅适用于不同性别健康成人,也适用于其他生命阶段,如胎儿、新生儿、婴儿、儿童、孕妇和哺乳期妇女及老年人群[65],模型可通过纳入年龄或性别依赖性变化信息,评估这些变化对毒害物TK的影响。已经有研究人员通过整合人体整个生命周期的生理和解剖详细信息,开发了一种适用于所有年龄段(0~80岁和产前人群)的通用型人体PBPK模型,并在1,3-丁二烯和硫丙磷2种有机危害物中进行了短期或长期暴露于体内的剂量学预测,将模型预测结果和实际数据进行一致性评价验证了模型的预测性能[65]。(2)PBPK模型可结合各种统计算法分析建模主要影响因素,并评估不同个体及群体间变异性,有助于降低预测误差率。如通过个体和子群体划分法观察个体间变异性对模型输出的影响,或用概率界方法估计群体概率分布的上下界限以及利用蒙特卡罗和贝叶斯方法对输入参数进行敏感性分析[91-93],确定对模型输出的整体不确定性水平贡献最大的关键参数[48]。(3)PBPK模型可用于疾病人群的PK预测[94]。目前有一些研究人员根据生理学变化特征建立了肝衰竭、肾衰竭及肥胖症的人体PBPK模型[95-97]。但由于不同人群病症类型及程度存在一定的差异,需要根据实际应用纳入更多的关键病理特征并区分不同症状类型和程度,建立更精确的疾病人体模型[98]。因此疾病人群PBPK模型还待进一步完善和实践验证。
3 PBPK模型在中药毒害物风险评估研究中的价值
随着计算机技术和数字化信息的快速发展,人们对计算机虚拟实验替代方法价值的认识逐渐提高。美国食品药品监督管理局等权威监管机构已经意识到PBPK模型的重要性,将其列入了新药注册的审查环节[99-100]。PBPK是基于系统先验信息构建的生物机制模型,研究模式属于“自下而上”的方法,其结构不受实验数据的影响。总结其结构特点有:(1)考虑到物质本身的性质特点,模型中纳入了lg、pa、溶解性等化学特征参数[49];(2)考虑到不同生物体的生理学多样性,模型中引入了不同动物与人体相关的生理学参数,包括器官体积、血流量、组织质量、吸收速率、跨细胞膜扩散、心输出量等[58];(3)考虑到化学物质与机体的相互作用特性,模型中包含了渗透率、up/ut、全血血浆浓度比、组织血浆分配系数及肝和肾等代谢器官中的CL,以及转运体或代谢酶动力学相关参数(m与max)等特征性参数[101]。由于模型参数不受任何限制,可通过调整优化获得最佳拟合模型。PBPK模型的实际应用需要融合各种建模技术,从经验算法到经典统计模型,再到各种复杂的微分方程来描述化合物在每个房室中的运输、代谢、结合和清除[57]。与所有建模和实验技术一样,随着模型结构的复杂程度,错误风险也会增加[36]。因此,以化合物的生物学机制及其物理化学性质为导向选择合理的组织房室模型,保证建模参数和验证数据的可靠性,确保与使用场景的相关性同时尽可能减少模型结构复杂程度,是有效利用PBPK模型的基本要素[102]。
尽管PBPK模型应用功能强大,但仍需注意以下3点:(1)PBPK模型在2种假定条件下建立:①进入体内的化合物根据是否存在细胞或组织膜扩散障碍,分为膜渗透限速动力学和灌注限速动力学2种扩散方式;②通用模型中假设血液中的化合物全部与组织交换,并均匀分布在器官中,如果化合物在体内以多种水解或结合形式存在假设将不成立,需要另外考虑其他代谢形式的定量分布形式或建立其他PBPK模型[71]。(2)PBPK建模可用于描述由相同途径代谢的化合物之间的定量相互作用的协同动力学效应,而2种或2种以上化学物质之间的相互作用涉及吸收前的相互作用、对共同代谢途径的竞争以及对毒性作用位点的竞争,仅通过PBPK模型很难充分阐明这一复杂过程[46]。(3)PBPK建模需要大量的输入参数支撑,其预测准确度与化学物质的毒性研究丰富程度呈正相关,当缺少毒性相关证据时PBPK模型只能作为推测性结果,需要严谨的实验数据验证基础上用于风险决策,不能用于超出其预期目的的推断[53]。因此,应避免理想化应用,正确认识PBPK模型的作用功能与不足,利用其突出优势合理设计实验方案,充分收集可获取数据信息,有机关联分子生物学及机器学习等技术方法,将人体预测数据用于协助评估物质毒性的安全风险。
4 结语
虽然中药毒害物质风险评估研究已经有了很大的进展,但还有很多需要解决的问题:(1)由于中药毒理研究尚不充分,大多数有毒中药还未明确毒性成分以及相应的限量标准[103];(2)除了一些明确毒性的重金属和农药,中药中还有其他农药、真菌毒素和植物生长调节剂等外源性有害物污染的情况,需要进行系统的风险评估;(3)已规定限量标准的外源性有害物质危害评估基本参考了国外权威机构提出的安全参考剂量,从有害物本身对人体的毒性风险角度制定了安全限量,没有考虑中药与毒害物相互作用对毒性效应的影响;(4)中药有多个毒害物质同时暴露的特点,有引起累积毒性作用的潜在风险,还没有建立中药中多物质共同暴露的混合效应评估法[5]。因此,发现并挖掘合理、先进的风险评估技术和手段是解决中药安全性问题的关键前提。已经有研究学者结合PBPK模型和支持向量机分类方法对雷公藤甲素、大黄素、苦参碱和氧化苦参碱等中药成分进行了肝毒性血药浓度预测[104]。通过总结分析PBPK模型的应用优势以及局限性,PBPK模型在中药中内源性有毒类成分的预测识别和优先排序、外源性有害物单独和联合暴露的危害评估及人体安全剂量预测等临床风险评估方面有极大的利用价值,是提高中药毒性研究和风险评估的科学基础和效率的实用性辅助工具。
利益冲突 所有作者均声明不存在利益冲突
[1] Huang K, Zhang P, Zhang Z H,. Traditional Chinese medicine (TCM) in the treatment of COVID-19 and other viral infections: Efficacies and mechanisms [J]., 2021, 225: 107843.
[2] Chan K W, Wong V T, Tang S C W. COVID-19: An update on the epidemiological, clinical, preventive and therapeutic evidence and guidelines of integrative Chinese-western medicine for the management of 2019 novel coronavirus disease [J]., 2020, 48(3): 737-762.
[3] 朱紫薇, 顾媛媛, 韩玉生, 等. 中医药在癌症治疗中的定位思考与研究 [J]. 辽宁中医杂志, 2018, 45(2): 423-425.
[4] 姜峰, 岳丽君, 朱丹. 马兜铃酸毒副作用研究概述 [J].中国药物评价, 2021, 38(5): 405-408.
[5] 任晓航, 杜锐, 张旭, 等. 中药外源性污染物检测技术的现代研究 [J]. 中草药, 2019, 50(10): 2480-2490.
[6] 洪小栩. 《中国药典》在临床用药安全中发挥的保障作用 [J]. 中国合理用药探索, 2021, 18(1): 1-8.
[7] 李耀磊, 张冰, 张晓朦, 等. 基于毒害成分的中药临床安全性评价与思考 [J]. 中国药物警戒, 2021, 18(6): 520-524.
[8] Chartres N, Bero L A, Norris S L. A review of methods used for hazard identification and risk assessment of environmental hazards [J]., 2019, 123: 231-239.
[9] 杨彬, 李遇伯, 张艳军. 基于单细胞转录组学的多基原有毒中药危害识别研究思路及方法 [J]. 中草药, 2021, 52(13): 3783-3789.
[10] 左甜甜, 王莹, 张磊, 等. 中药中外源性有害残留物安全风险评估技术指导原则[J]. 药物分析杂志, 2019, 39(10): 1902-1907.
[11] 赵梓邯, 张琳, 李文斌, 等. 中药毒性与安全性评价研究进展[J]. 中国实验方剂学杂志, 2018, 24(20): 208-216.
[12] 胡欣燕, 李璐, 郭桂明. 高警示中药品种的安全性分析和归纳[J]. 中国初级卫生保健, 2021, 35(5): 6-8.
[13] 马双成, 王莹, 魏锋. 中药质量控制未来发展方向的思考 [J]. 中国药学杂志, 2021, 56(16): 1273-1281.
[14] Kim S J, Shin H, Lee Y B,. Sex-specific risk assessment of PFHxS using a physiologically based pharmacokinetic model [J]., 2018, 92(3): 1113-1131.
[15] Fernández S F, Pardo O, Corpas-Burgos F,. Exposure and cumulative risk assessment to non-persistent pesticides in Spanish children using biomonitoring [J]., 2020, 746: 140983.
[16] Kulathunga M R D L, Wijayawardena M A A, Naidu R. Heavy metal(loid)s and health risk assessment of Dambulla vegetable market in Sri Lanka [J]., 2021, 193(4): 1-10.
[17] Claire T, Sean H. Integrating toxicokinetics into toxicology studies and the human health risk assessment process for chemicals: Reduced uncertainty, better health protection [J]., 2022, 128: 105092.
[18] Piersma A H, Ezendam J, Luijten M,. A critical appraisal of the process of regulatory implementation of novelandmethods for chemical hazard and risk assessment [J]., 2014, 44(10): 876-894.
[19] Dybing E, Doe J, Groten J,. Hazard characterisation of chemicals in food and diet: Dose response, mechanisms and extrapolation issues [J]., 2002, 40(2/3): 237-282.
[20] Zurlinden T J, Reisfeld B. A novel method for the development of environmental public health indicators and benchmark dose estimation using a health-based end point for chlorpyrifos [J]., 2018, 126(4): 047009.
[21] Chiu W A, Slob W. A unified probabilistic framework for dose-response assessment of human health effects [J]., 2015, 123(12): 1241-1254.
[22] Nieuwenhuijsen M, Paustenbach D, Duarte-Davidson R. New developments in exposure assessment: The impact on the practice of health risk assessment and epidemiological studies [J]., 2006, 32(8): 996-1009.
[23] Pelkonen O, Bennekou S H, Crivellente F,. Integration of epidemiological findings with mechanistic evidence in regulatory pesticide risk assessment: EFSA experiences [J]., 2019, 93(6): 1779-1788.
[24] Dourson M L, York R G. Advances in assessing ingredient safety [J]., 2016, 79: S112-S118.
[25] 杨一兵, 齐媛媛, 杨惠霞, 等. 中药重金属污染风险评估研究进展[A] // 中国环境科学学会学术年会论文集[C]. 成都: 中国环境科学学会, 2014: 1125-1129.
[26] 左甜甜, 张磊, 石上梅, 等. 10种根和根茎类中药材中重金属及有害元素的风险评估及最大限量理论值 [J]. 药物分析杂志, 2020, 40(10): 1870-1876.
[27] Louro H, Heinälä M, Bessems J,. Human biomonitoring in health risk assessment in Europe: Current practices and recommendations for the future [J]., 2019, 222(5): 727-737.
[28] Clewell H J, Tan Y M, Campbell J L,. Quantitative interpretation of human biomonitoring data [J]., 2008, 231(1): 122-133.
[29] Cohen Hubal E A, de Wet T, du Toit L,. Identifying important life stages for monitoring and assessing risks from exposures to environmental contaminants: Results of a World Health Organization review [J]., 2014, 69(1): 113-124.
[30] Felter S P, Daston G P, Euling S Y,. Assessment of health risks resulting from early-life exposures: Are current chemical toxicity testing protocols and risk assessment methods adequate? [J]., 2015, 45(3): 219-244.
[31] Jin Z, Lv J S. Evaluating source-oriented human health risk of potentially toxic elements: A new exploration of multiple age groups division [J]., 2021, 787: 147502.
[32] 牛志广, 臧雪. 生理药代动力学模型及其在健康风险评价中的应用研究进展 [J]. 安全与环境学报, 2015, 15(6): 30-34.
[33] Andersen M E. Toxicokinetic modeling and its applications in chemical risk assessment [J]., 2003, 138(1/2): 9-27.
[34] Ellison C A. Structural and functional pharmacokinetic analogs for physiologically based pharmacokinetic (PBPK) model evaluation [J]., 2018, 99: 61-77.
[35] Fisher J W, Gearhart J M, Lin Z.[M]., 2020: 57-80.
[36] Polak S, Tylutki Z, Holbrook M,. Better prediction of the local concentration-effect relationship: The role of physiologically based pharmacokinetics and quantitative systems pharmacology and toxicology in the evolution of model-informed drug discovery and development [J]., 2019, 24(7): 1344-1354.
[37] Thompson C V, Firman J W, Goldsmith M R,. A systematic review of published physiologically-based kinetic models and an assessment of their chemical space coverage [J]., 2021, 49(5): 197-208.
[38] Ruiz P, Emond C, McLanahan E D,. Erratum to: “Exploring mechanistic toxicity of mixtures using PBPK modeling and computational systems biology” [J]., 2020, 177(1): 302.
[39] Glassman P M, Balthasar J P. Physiologically-based modeling of monoclonal antibody pharmacokinetics in drug discovery and development [J]., 2019, 34(1): 3-13.
[40] Sugimoto H, Chen S S, Qian M G. Pharmacokinetic characterization and tissue distribution of fusion protein therapeutics by orthogonal bioanalytical assays and minimal PBPK modeling [J]., 2020, 25(3): 535.
[41] Li M, Zou P, Tyner K,. Physiologically based pharmacokinetic (PBPK) modeling of pharmaceutical nanoparticles [J]., 2017, 19(1): 26-42.
[42] Deepika D, Rovira J, Sabuz Ó,. Framework for risk assessment of PFAS utilizing experimental studies and in-silico models [J]., 2022, 208: 112722.
[43] Dong Z M, Liu Y J, Duan L C,. Uncertainties in human health risk assessment of environmental contaminants: A review and perspective [J]., 2015, 85: 120-132.
[44] Puskin J S, James A C. Radon exposure assessment and dosimetry applied to epidemiology and risk estimation [J]., 2006, 166(1 Pt 2): 193-208.
[45] Lu F C, Sielken R L Jr. Assessment of safety/risk of chemicals: Inception and evolution of the ADI and dose-response modeling procedures [J]., 1991, 59(1/2/3): 5-40.
[46] Andersen M E. Tissue dosimetry, physiologically-based pharmacokinetic modeling, and cancer risk assessment [J]., 1989, 5(4): 405-415.
[47] Krewski D, Withey J R, Ku L F,. Applications of physiologic pharmacokinetic modeling in carcinogenic risk assessment [J]., 1994, 102(Suppl 11): 37-50.
[48] Tornero-Velez R, Mirfazaelian A, Kim K B,. Evaluation of deltamethrin kinetics and dosimetry in the maturing rat using a PBPK model [J]., 2010, 244(2): 208-217.
[49] Webster E M, Qian H, MacKay D,. Modeling human exposure to indoor contaminants: External source to body tissues [J]., 2016, 50(16): 8697-8704.
[50] Bessems J G, Loizou G, Krishnan K,. Pbtk modelling platforms and parameter estimation tools to enable animal-free risk assessment: Recommendations from a joint EPAA-EURL ECVAM ADME workshop [J]., 2014, 68(1): 119-139.
[51] Keys D A, Bruckner J V, Muralidhara S,. Tissue dosimetry expansion and cross-validation of rat and mouse physiologically based pharmacokinetic models for trichloroethylene [J]., 2003, 76(1): 35-50.
[52] Tan Y M, Clewell H, Campbell J,. Evaluating pharmacokinetic and pharmacodynamic interactions with computational models in supporting cumulative risk assessment [J]., 2011, 8(5): 1613-1630.
[53] Lipscomb J C, Haddad S, Poet T,. Physiologically-based pharmacokinetic (PBPK) models in toxicity testing and risk assessment [J]., 2012, 745: 76-95.
[54] Pentafragka C, Symillides M, McAllister M,. The impact of food intake on the luminal environment and performance of oral drug products with a view toand in silico simulations: A PEARRL review [J]., 2019, 71(4): 557-580.
[55] Zhang Y, Han X M, Niu Z G. Health risk assessment of haloacetonitriles in drinking water based on internal dose [J]., 2018, 236: 899-906.
[56] Leung H W. Development and utilization of physiologically based pharmacokinetic models for toxicological applications [J]., 1991, 32(3): 247-267.
[57] Yau E, Olivares-Morales A, Gertz M,. Global sensitivity analysis of the Rodgers and Rowland model for prediction of tissue: Plasma partitioning coefficients: Assessment of the key physiological and physicochemical factors that determine small-molecule tissue distribution [J]., 2020, 22(2): 41.
[58] Holt K, Ye M, Nagar S,. Prediction of tissue-plasma partition coefficients using microsomal partitioning: Incorporation into physiologically based pharmacokinetic models and steady-state volume of distribution predictions [J]., 2019, 47(10): 1050-1060.
[59] Lin Z, Gehring R, Mochel J P,. Mathematical modeling and simulation in animal health-Part II: Principles, methods, applications, and value of physiologically based pharmacokinetic modeling in veterinary medicine and food safety assessment [J]., 2016, 39(5): 421-438.
[60] Descotes J. From clinical to human toxicology: Linking animal research and risk assessment in man [J]., 2003, 140/141: 3-10.
[61] Kim K B, Kwack S J, Lee J Y,. Current opinion on risk assessment of cosmetics [J]., 2021, 24(4): 137-161.
[62] Thompson C M, Johns D O, Sonawane B,. Database for physiologically based pharmacokinetic (PBPK) modeling: Physiological data for healthy and health-impaired elderly [J]., 2009, 12(1): 1-24.
[63] Sharma R P, Kumar V, Schuhmacher M,. Development and evaluation of a harmonized whole body physiologically based pharmacokinetic (PBPK) model for flutamide in rats and its extrapolation to humans [J]., 2020, 182: 108948.
[64] Chou W C, Lin Z M. Bayesian evaluation of a physiologically based pharmacokinetic (PBPK) model for perfluorooctane sulfonate (PFOS) to characterize the inter species uncertainty between mice, rats, monkeys, and humans: Development and performance verification [J]., 2019, 129: 408-422.
[65] Beaudouin R, Micallef S, Brochot C. A stochastic whole-body physiologically based pharmacokinetic model to assess the impact of inter-individual variability on tissue dosimetry over the human lifespan [J]., 2010, 57(1): 103-116.
[66] Dalaijamts C, Cichocki J A, Luo Y S,. Incorporation of the glutathione conjugation pathway in an updated physiologically-based pharmacokinetic model for perchloroethylene in mice [J]., 2018, 352: 142-152.
[67] Clewell R A, Clewell H J. Development and specification of physiologically based pharmacokinetic models for use in risk assessment [J]., 2008, 50(1): 129-143.
[68] 张逸凡, 徐叶, 李海军, 等. 采用生理药动学模型预测新型泛磷酸二酯酶抑制剂ZSP1601在人体中的药动学 [J]. 药学学报, 2021, 56(12): 3540-3546.
[69] Yang Y, Himmelstein M W, Clewell H J. Kinetic modeling of β-chloroprene metabolism: Probabilistic-extrapolation of metabolism in the lung, liver and kidneys of mice, rats and humans [J]., 2012, 26(6): 1047-1055.
[70] 彭辉, 张丽, 何俊, 等. 药物性肝损伤有害结局路径研究进展 [J]. 中国药理学与毒理学杂志, 2021, 35(11): 868-876.
[71] Hartung T. Perspectives ontoextrapolations [J]., 2018, 4(4): 305-316.
[72] Wetmore B A. Quantitative-to-extrapolation in a high-throughput environment [J]., 2015, 332: 94-101.
[73] Yoon M, Campbell J L, Andersen M E,. Quantitativetoextrapolation of cell-based toxicity assay results [J]., 2012, 42(8): 633-652.
[74] Yoon M, Blaauboer B J, Clewell H J. Quantitativetoextrapolation (QIVIVE): An essential element for-based risk assessment [J]., 2015, 332: 1-3.
[75] Grech A, Brochot C, Dorne J L,. Toxicokinetic models and related tools in environmental risk assessment of chemicals [J]., 2017, 578: 1-15.
[76] Lin Y J, Lin Z M.-in silico-based probabilistic risk assessment of combined exposure to bisphenol A and its analogues by integrating ToxCast high-throughputassays withtoextrapolation (IVIVE) via physiologically based pharmacokinetic (PBPK) modeling [J]., 2020, 399: 122856.
[77] Kenyon E M, Eklund C, Lipscomb J C,. The impact of variation in scaling factors on the estimation of internal dose metrics: A case study using bromodichloromethane (BDCM) [J]., 2016, 26(8): 620-626.
[78] Poulin P, Burczynski F J, Haddad S. The role of extracellular binding proteins in the cellular uptake of drugs: Impact on quantitative-to-extrapolations of toxicity and efficacy in physiologically based pharmacokinetic-pharmacodynamic research [J]., 2016, 105(2): 497-508.
[79] Algharably E A H, Kreutz R, Gundert-Remy U. Importance ofconditions for modeling thedose in humans by-extrapolation (IVIVE) [J]., 2019, 93(3): 615-621.
[80] Wilk-Zasadna I, Bernasconi C, Pelkonen O,. Biotransformation: An essential consideration in the quantitative-to-extrapolation (QIVIVE) of toxicity data [J]., 2015, 332: 8-19.
[81] Poet T S, Timchalk C, Hotchkiss J A,. Chlorpyrifos PBPK/PD model for multiple routes of exposure [J]., 2014, 44(10): 868-881.
[82] Lu C S, Holbrook C M, Andres L M. The implications of using a physiologically based pharmacokinetic (PBPK) model for pesticide risk assessment [J]., 2010, 118(1): 125-130.
[83] Norman A M, Kissel J C, Shirai J H,. Effect of PBPK model structure on interpretation ofhuman aqueous dermal exposure trials [J]., 2008, 104(1): 210-217.
[84] Jongeneelen F J, Berge W F. A generic, cross-chemical predictive PBTK model with multiple entry routes running as application in MS Excel; design of the model and comparison of predictions with experimental results [J]., 2011, 55(8): 841-864.
[85] Sarangapani R, Teeguarden J G, Cruzan G,. Physiologically based pharmacokinetic modeling of styrene and styrene oxide respiratory-tract dosimetry in rodents and humans [J]., 2002, 14(8): 789-834.
[86] Kim D, Andersen M E, Pleil J D,. Refined PBPK model of aggregate exposure to methyl tertiary-butyl ether [J]., 2007, 169(3): 222-235.
[87] Mallick P, Song G, Efremenko A Y,. Physiologically based pharmacokinetic modeling in risk assessment: Case study with pyrethroids [J]., 2020, 176(2): 460-469.
[88] Stader F, Siccardi M, Battegay M,. Repository describing an aging population to inform physiologically based pharmacokinetic models considering anatomical, physiological, and biological age-dependent changes [J]., 2019, 58(4): 483-501.
[89] Fowler B A.[M]. San Diego: Academic Press, 2013: 45-66.
[90] Makris S L, Thompson C M, Euling S Y,. A lifestage-specific approach to hazard and dose-response characterization for children’s health risk assessment [J]., 2008, 83(6): 530-546.
[91] Liao K H, Tan Y M, Conolly R B,. Bayesian estimation of pharmacokinetic and pharmacodynamic parameters in a mode-of-action-based cancer risk assessment for chloroform [J]., 2007, 27(6): 1535-1551.
[92] Tan Y M, Chan M, Chukwudebe A,. PBPK model reporting template for chemical risk assessment applications [J]., 2020, 115: 104691.
[93] Barton H A, Chiu W A, Woodrow Setzer R,. Characterizing uncertainty and variability in physiologically based pharmacokinetic models: State of the science and needs for research and implementation [J]., 2007, 99(2): 395-402.
[94] Jo H, Pilla Reddy V, Parkinson J,. Model-informed pediatric dose selection for dapagliflozin by incorporating developmental changes [J]., 2021, 10(2): 108-118.
[95] Wu X M, Zhang X H, Xu R C,. Physiologically based pharmacokinetic modelling of treprostinil after intravenous injection and extended-release oral tablet administration in healthy volunteers: An extrapolation to other patient populations including patients with hepatic impairment [J]., 2022, 88(2): 587-599.
[96] Shah K, Fischetti B, Cha A,. Using PBPK modeling to predict drug exposure and support dosage adjustments in patients with renal impairment: An example with lamivudine [J]., 2020, 17(3): 387-396.
[97] Ford J L, Gerhart J G, Edginton A N,. Physiologically based pharmacokinetic modeling of metformin in children and adolescents with obesity [J]., 2022, doi: 10.1002/jcph.2034.
[98] 李桦, 庄笑梅. 药代动力学人体预测及其在新药研发中的应用 [J]. 中国药理学与毒理学杂志, 2013, 27(4): 611-615.
[99] Huang S M. PBPK as a tool in regulatory review [J]., 2012, 33(2): 51-52.
[100]Grimstein M, Yang Y, Zhang X Y,. Physiologically based pharmacokinetic modeling in regulatory science: An update from the US food and drug administration’s office of clinical pharmacology [J]., 2019, 108(1): 21-25.
[101]Chiu W A, Barton H A, DeWoskin R S,. Evaluation of physiologically based pharmacokinetic models for use in risk assessment [J]., 2007, 27(3): 218-237.
[102]Becking G C. Use of mechanistic information in risk assessment for toxic chemicals [J]., 1995, 77(1/2/3): 15-24.
[103]安娜, 吕佳康, 韩玲. 中药安全性认识和中药新药研发的风险管理策略 [J]. 中国药理学与毒理学杂志, 2021, 35(2): 90-95.
[104]Li S, Yu Y, Bian X,. Prediction of oral hepatotoxic dose of natural products derived from traditional Chinese medicines based on SVM classifier and PBPK modeling [J]., 2021, 95(5): 1683-1701.
Thinking and understanding of application of physiological pharmacokinetic model in risk assessment of traditional Chinese medicine
SU Bu-da, LI Xiao-meng, LIU Hui, YANG Shen-shen, WEI Jin-xia, LI Yu-bo
School of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
Traditional Chinese medicine (TCM) containing endogenous toxic components and exogenous harmful residues has become a risk factor to threaten human health, which has seriously restricted the sustainable development of TCM industry. Risk assessment is an effective scientific method to prevent and control the quality of TCM, so as to ensure the safety of the medication. In this paper, through a specific analysis of research situations and problems of risk assessment of harmful substances in TCM, relevant research literature on risk assessment at home and abroad are summarized to solve the key issues and put forward the practicability of physiologically based pharmacokinetic (PBPK) model. It focuses on functional advantages and limitations in risk assessment studies, including prediction of tissue dosimetry and interspecific dosimetry extrapolation, pharmacokinetic prediction of different exposure routes and duration, as well as pharmacokinetic prediction in different life stages or pathological populations. Finally, the potential value of the PBPK model in the risk evaluation of toxic substances in TCM was briefly discussed, in order to provide technical reference and new strategies for the safety evaluation and the establishment of limited standards in TCM.
toxic substances of traditional Chinese medicine; risk assessment; physiologically based pharmacokinetic model; dosimetry extrapolation; pharmacokinetic prediction; safety evaluation
R285.61
A
0253 - 2670(2022)15 - 4593 - 11
10.7501/j.issn.0253-2670.2022.15.001
2022-03-08
国家自然科学基金面上项目(81873194);国家中医药管理局青年歧黄学者支持项目
苏布达(1995—),女(蒙古族),博士研究生,研究方向为中药毒性及风险评估研究。E-mail: zhenzhu1004@163.com
通信作者:李遇伯(1978—),女,教授,博士生导师,研究方向为中药安全性评价研究。E-mail: yuboli1@163.com
[责任编辑 崔艳丽]