鲁米诺的合成与振荡化学发光
张一平,邓昆月,赵博轩,张雨豪,陈洲慧,阮永红,周金梅,张慧君,林敏,邓顺柳,曹晓宇,任艳平
厦门大学化学化工学院,化学国家级实验教学示范中心(厦门大学),福建 厦门 361005
1 引言
鲁米诺(Luminol)的化学名称为3-氨基邻苯二甲酰肼,具有化学发光的特性。在犯罪现场,血迹的勘察非常重要,而鲁米诺试剂就在其中扮演着关键角色,它能够与痕量血迹作用发出明显的蓝色荧光。超高的灵敏度使其被广泛用于刑事侦查、化学示踪、免疫分析等重要领域。
鲁米诺的合成及其化学发光是极具展示度的基础化学实验,但目前国内开设相关实验的高校还比较少[1–3],着重点也多为合成,对化学发光性质的探索还仅限于现象的观察。为进一步丰富该实验的理论内涵并提高可推广性,我们对其进行了合成方法改进,并基于其化学发光性质,设计了振荡化学发光实验。
为了提高鲁米诺的产率和纯度,以满足后续振荡化学发光的要求,我们对现有教材中的鲁米诺合成方法进行了改进。首先,采用机械搅拌解决缩合反应体系粘度大的问题,使反应更加充分。其次,原还原步骤所选用的还原剂为连二亚硫酸钠,存在反应剧烈和产品纯度欠佳等缺点,将其替换为稳定、无毒的单质硫[4]不仅使还原反应更加安全、高效,而且显著提高了产品纯度。最后,经过多次尝试,我们发现可将反应溶剂由甲醇替换为水,并且使用微波辐射可将反应时间从1 h缩短至9 min。以上改进使该实验具备绿色、经济、高效等优点,更适合高校基础实验教学。
鲁米诺化学发光现象明显,但转瞬即逝。我们设计了振荡化学发光实验,即鲁米诺/H2O2/SCN-/Cu2+/OH-振荡体系化学发光动力学探究实验,能够观察到周期性的化学发光现象,如同天上闪烁的星辰。目前基础化学实验中涉及的振荡反应一般为碘钟反应和B-Z振荡反应[5,6],现象更为明显的振荡化学发光实验还未见开设。
为进一步丰富该实验的科学内涵,我们设计并搭建了可在荧光光谱仪中使用的简易微型磁力搅拌加热装置,配合荧光光谱仪,可以实时监测不同条件下溶液体系的发光情况,得到鲁米诺振荡化学发光强度与振荡周期等信息。学生可自行设计对比实验,探究反应物浓度、温度、pH等条件对振荡反应过程的影响,并利用这些数据讨论振荡反应机理。还可根据阿伦尼乌斯(Arrhenius)经验公式计算振荡反应的表观活化能。
我们已在基础化学实验教学中进行过一轮尝试。合成部分为学生单人实验,振荡化学发光部分为3–4人的小组实验。如同星辰闪烁般的神奇实验现象充分激发了学生的求知欲。该实验涉及缩合反应、还原反应、动力学、非平衡态热力学、化学发光等多个重要概念,使学生熟练掌握机械搅拌、温度控制、微波合成、分离纯化等基本有机合成操作,并学习荧光光谱仪的原理和使用方法。此外,还培养了学生独立设计实验及分析实验数据的能力。
2 实验部分
2.1 实验原理
2.1.1 鲁米诺的合成
鲁米诺又名发光氨,在常温下为淡黄色晶体或米黄色粉末,化学式为C8H7N3O2。鲁米诺的合成涉及两个重要有机反应(图1):a) 3-硝基邻苯二甲酸与肼的缩合反应;b) 硝基的还原反应。
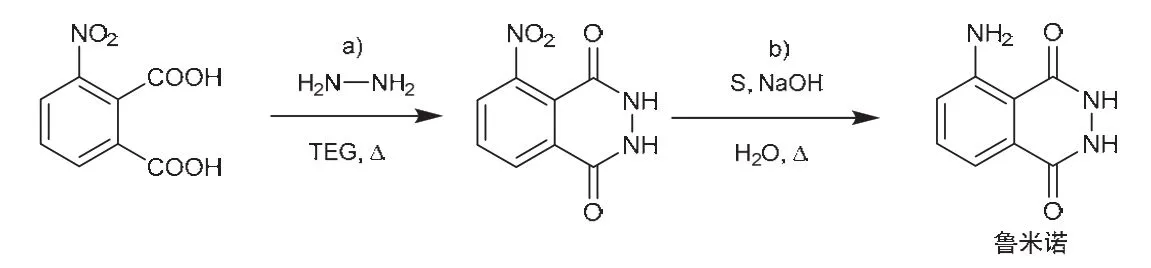
图1 鲁米诺的合成
2.1.2 鲁米诺的化学发光
化学发光是指物质在发生化学反应时伴随产生的一种发光现象。比如,在强碱性质子溶剂中,鲁米诺可与强氧化剂反应,被氧化为激发态的3-氨基邻苯二甲酸阴离子,其回到基态时以发射光子的形式释放能量[7](图2)。
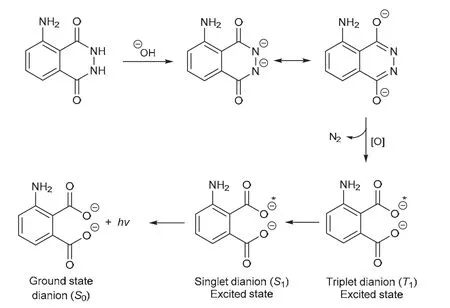
图2 鲁米诺化学发光反应的机理
2.1.3 H2O2/SCN-/Cu2+/OH-振荡体系
化学振荡反应,也称摇摆反应,其是指在一些自催化反应中,反应体系中某些物质的浓度随时间或空间发生周期性的变化。该实验中,我们使用的振荡反应体系为H2O2/SCN-/Cu2+/OH-。一般认为该体系涉及的催化循环如图3所示[8,9]。
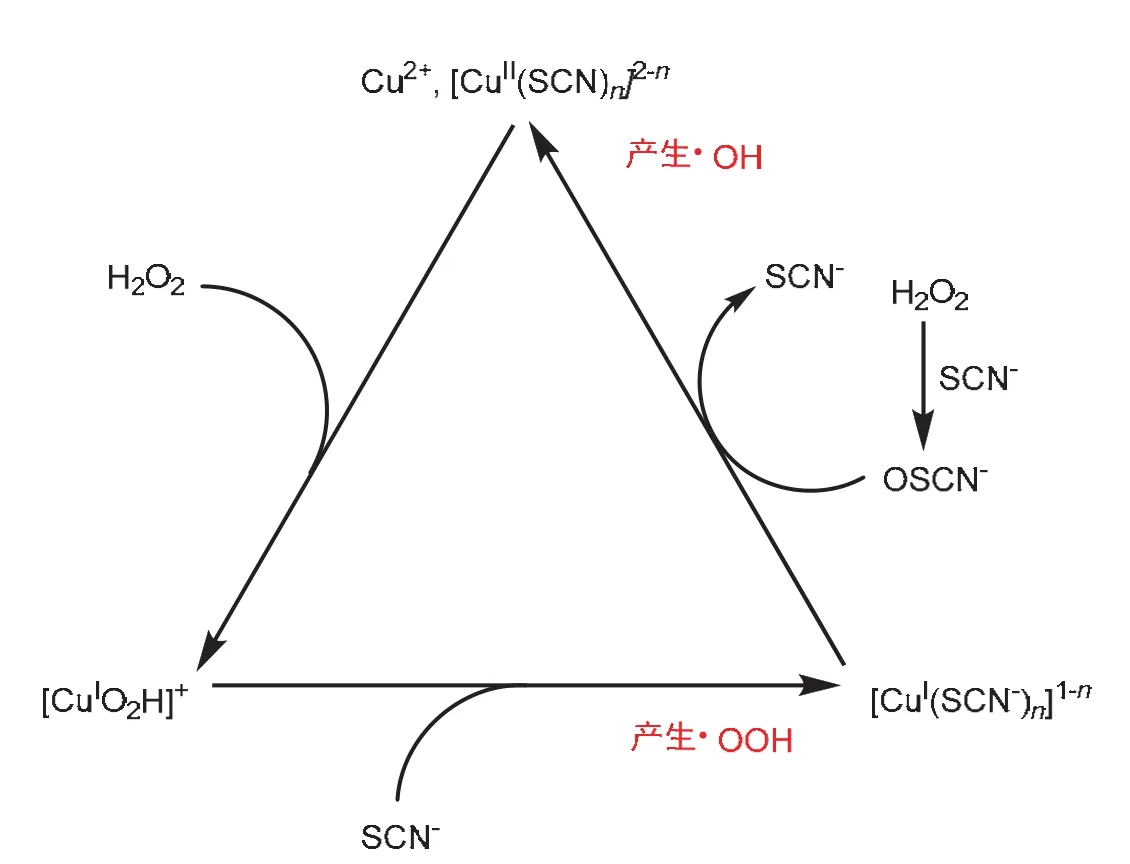
图3 H2O2/SCN-/Cu2+/OH-振荡体系的催化循环过程
在Cu(I)与Cu(II)相互转换的循环周期中,生成含氧自由基(HO·和HOO·),当含氧自由基达到一定浓度后,氧化鲁米诺发出蓝色荧光。这个过程周而复始,从而展现出振荡的化学发光现象。
2.1.4 鲁米诺的振荡化学发光原理
在H2O2/SCN-/Cu2+/OH-振荡体系中,含氧自由基经过一段时间的积累,浓度达到一定值,从而氧化鲁米诺发出蓝色荧光,而后自由基浓度下降开始新的振荡循环。可将荧光强度的极大值与基线的差值定义为振荡振幅(图4)。通过实时监测振荡体系的发光强度,既能得到振荡振幅,也能测定各振幅之间的时间间隔,即振荡周期t。
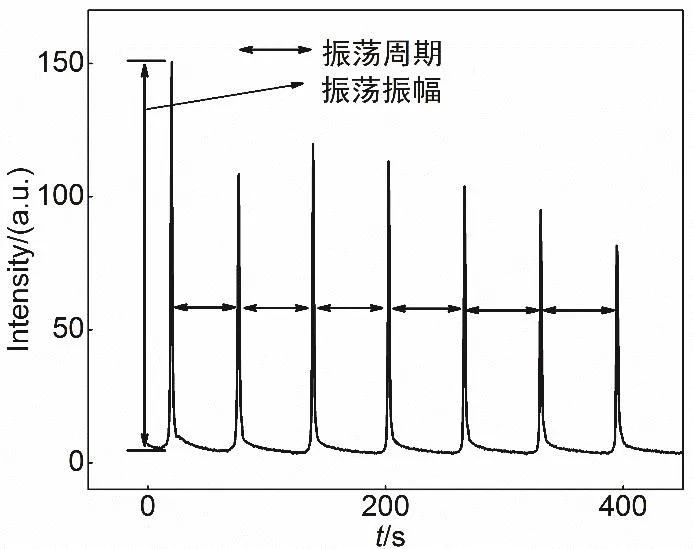
图4 振荡振幅与周期
2.2 试剂
3-硝基邻苯二甲酸(AR)、35%肼水溶液、二缩三乙二醇(AR)、升华硫(AR)、氢氧化钠(AR)、盐酸(AR)、30%过氧化氢(AR)、硫氰酸钾(AR)、五水合硫酸铜(AR)。
2.3 仪器
2.3.1 主要仪器
机械搅拌装置、电热套、抽滤装置、移液枪、MCR-3E常压微波合成萃取仪、MR Hei-Teo磁力搅拌器、SHB-III循环水式多用真空泵、分析天平、核磁共振仪、F-7000荧光光谱仪。
2.3.2 自主设计的简易微型磁力搅拌加热装置
为了控制温度和使反应体系均匀,以实现在荧光光谱仪中对振荡化学发光过程的实时准确监测,我们设计并搭建了简易微型磁力搅拌加热装置(图5)。该装置主要由控制系统、搅拌系统与加热系统构成。该装置的所有零部件均可在网上购买,且价格便宜(约为100元),方便推广。

图5 简易微型磁力搅拌加热装置
2.4 实验步骤
2.4.1 鲁米诺的合成
投料:用夹子将100 mL三颈瓶固定在竖直方向上,在中间瓶口连接机械搅拌装置,在左侧瓶口插入温度计,搭建如图6所示的装置。搅拌下依次加入2.50 g 3-硝基邻苯二甲酸,5.0 mL 8%的肼水溶液和7.5 mL二缩三乙二醇。
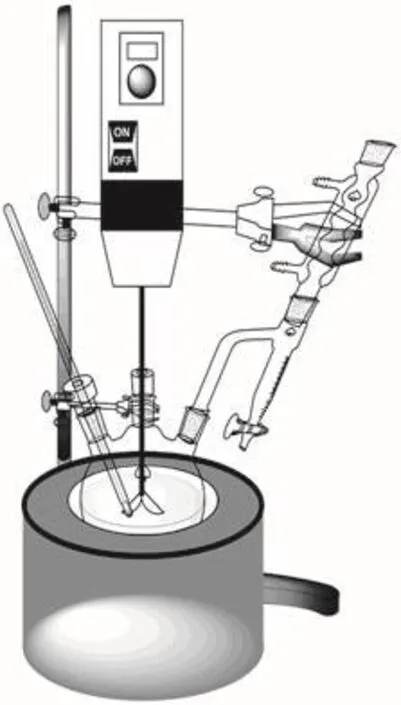
图6 缩合反应装置
缩合:开启机械搅拌,在电加热套上加热,直到固体溶解,溶液变为黄色。继续升温至沸腾,以除去过量的水。水蒸发完全后,温度升至220 °C左右,溶液变为棕红色,3-硝基邻苯二甲酸与N2H4的缩合完成。移去热源,温度降至100 °C左右时,缓慢加入40 mL沸水,出现大量沉淀。降至室温后,冰浴冷却,抽滤析出黄棕色的3-硝基邻苯二甲酰肼固体。
还原:将上步反应得到的3-硝基邻苯二甲酰肼加入三颈瓶中,加入1.50 g硫粉和38.0 mL 10%NaOH溶液,搅拌,反应液加热回流1 h或在400 W微波辐射下反应9 min,用薄层色谱监测反应进程。
后处理与分离:如图7所示,连接恒压滴液漏斗和气体吸收装置(用5% NaOH溶液吸收酸化过程中产生的酸性气体)。搅拌下滴加3 mol·L-1盐酸至体系pH为6 (用精密pH试纸5.5–9.0检测),析出大量淡黄色固体,抽滤,收集粗产品。

图7 后处理反应装置
将粗产品倒入150 mL烧杯中,搅拌下加入30 mL 10% NaOH溶液溶解鲁米诺。抽滤,除去不溶的单质硫。将所得滤液用3 mol·L-1盐酸酸化至pH为6,析出大量米黄色固体,抽滤,冰水洗涤,90oC烘干,收集鲁米诺产品,两步总产率约70%。
2.4.2 鲁米诺振荡化学发光
溶液配制:溶液A (2.0 mol·L-1H2O2);溶液B (0.2 mol·L-1KSCN);溶液C (3.0 × 10-3mol·L-1CuSO4);溶液D (0.2 mol·L-1NaOH和8.0 × 10-3mol·L-1鲁米诺)。
振荡化学发光现象观察:分别量取120.0 mL纯水,20.0 mL溶液B,20.0 mL溶液C和20.0 mL溶液D于250 mL烧杯中。用磁力搅拌器搅拌并加热至45 °C (该温度时现象较明显,有利于肉眼观察),然后加入20.0 mL溶液A。此时可以观察到明显的鲁米诺振荡化学发光现象(图8),记录振荡发光的时间间隔,即振荡周期t。

图8 振荡化学发光现象观察
实时监测振荡发光过程:将微型磁力搅拌加热装置的搅拌模块放置于荧光池正下方,在搅拌器和荧光池的中间放置加热片。加热温度设置为35 °C。打开荧光光谱仪电源,设置好仪器参数。
向荧光池中加入纯水,校准基线。立即移取已提前预热的3.0 mL混合液于荧光池中,开启测量,得到光强随时间变化的曲线。测量完毕后,保存数据,用Origin软件处理数据。
在此基础上,学生可以继续自行设计实验,探究反应物浓度、温度、pH等对该振荡体系的振荡振幅与周期的影响,总结振荡反应规律和讨论机理。还可引导学生通过探究不同温度下振荡周期的变化,结合阿伦尼乌斯经验公式计算振荡反应的表观活化能。
3 结果与讨论
3.1 3-硝基邻苯二甲酰肼还原条件探索
通过探索3-硝基邻苯二甲酰肼的还原条件(表1),我们发现经典方法(Na2S2O4还原)虽然反应时间短[3],但存在反应剧烈和产品纯度欠佳等问题(序号1),选用升华硫[4]作为还原试剂可以安全、高效制备高纯度鲁米诺(序号2–6)。尤其是,该反应可在水相(序号5)进行,更适合于高校基础实验教学。同时,使用微波辐射代替常规加热能够将反应时间从1 h缩短至9 min (序号6)。
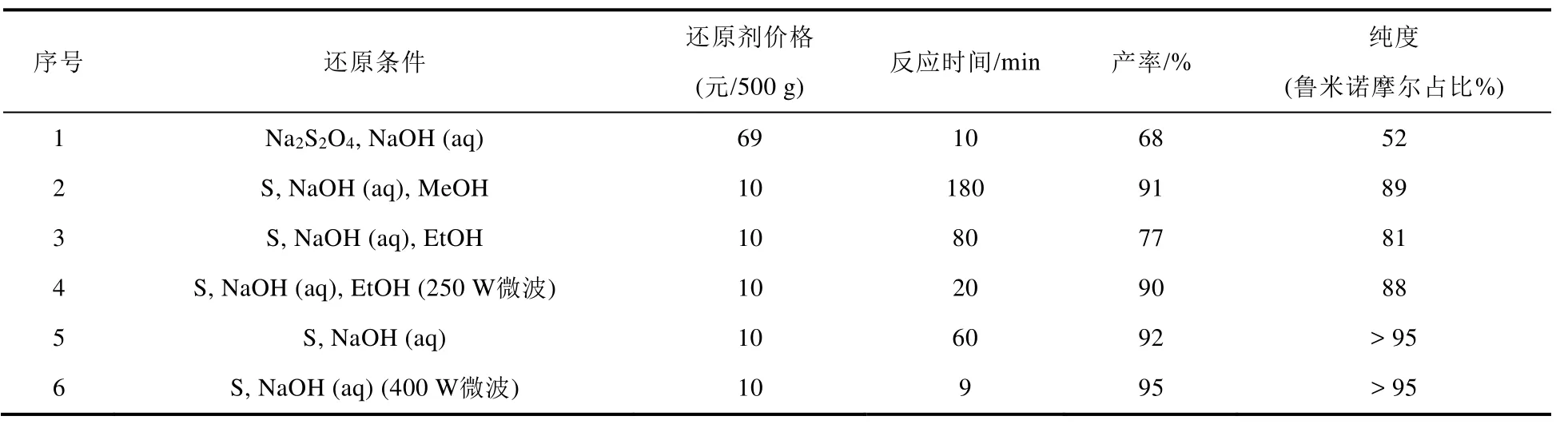
表1 3-硝基邻苯二甲酰肼还原条件探索
3.2 鲁米诺的结构和纯度表征
通过红外光谱和核磁共振氢谱可对产物结构和纯度进行表征。在红外光谱(图9)中可观察到鲁米诺分子结构中酰胺C=O键的伸缩振动特征峰位于~1658 cm-1,酰胺的N―H键伸缩振动特征峰位于~3017 cm-1,芳胺的N―H键伸缩振动特征峰位于~3422 cm-1,与商品试剂红外光谱的特征峰一致。
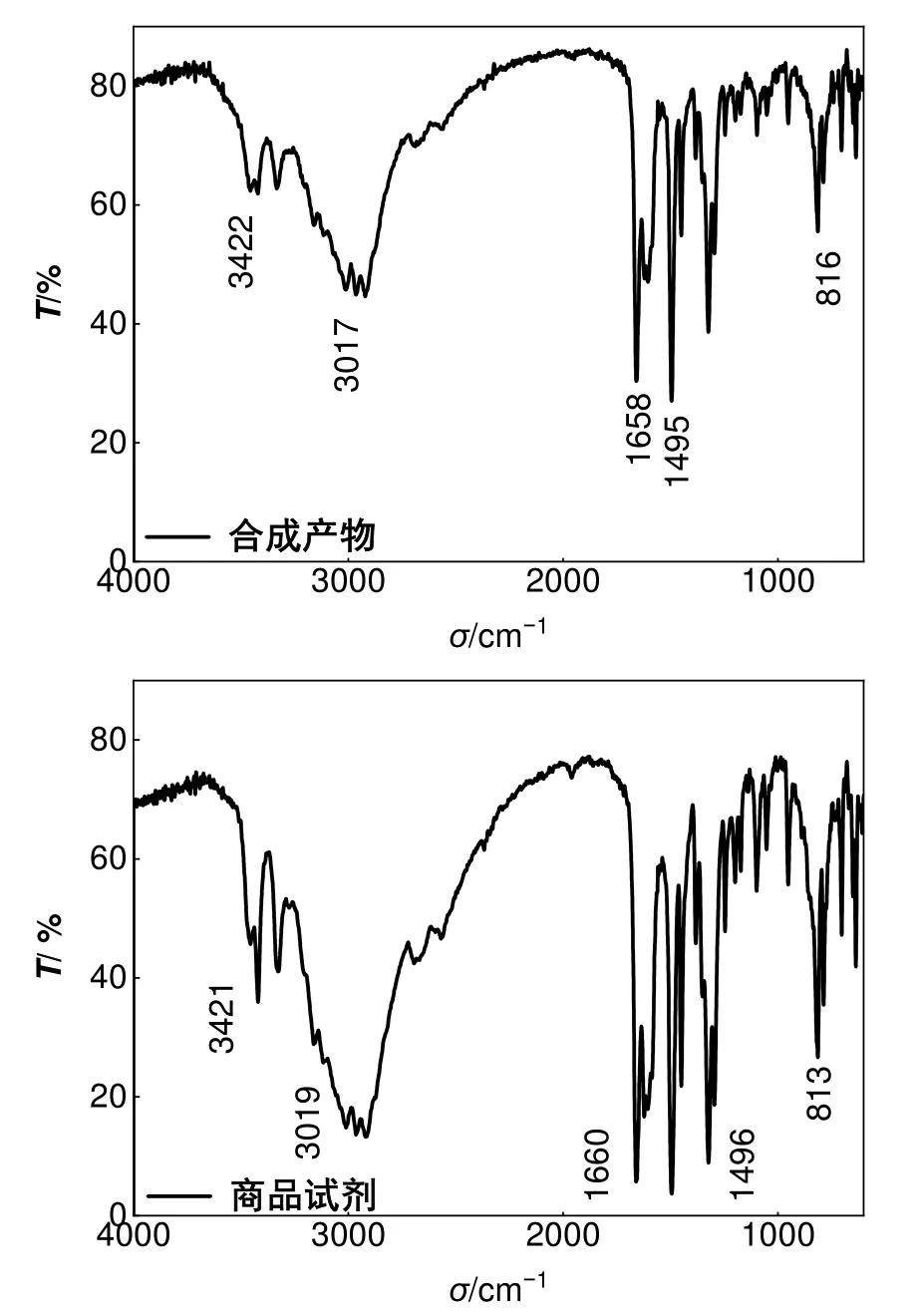
图9 鲁米诺产物与商品试剂红外光谱对比
图10为鲁米诺的核磁共振氢谱,数据如下:1H NMR (400 MHz, DMSO-d6)δ11.17 (s, 2H),7.45(t,J= 7.9 Hz, 1H),7.29 (s, 2H),6.95 (d,J= 7.5 Hz, 1H),6.89 (d,J= 8.2 Hz, 1H)。
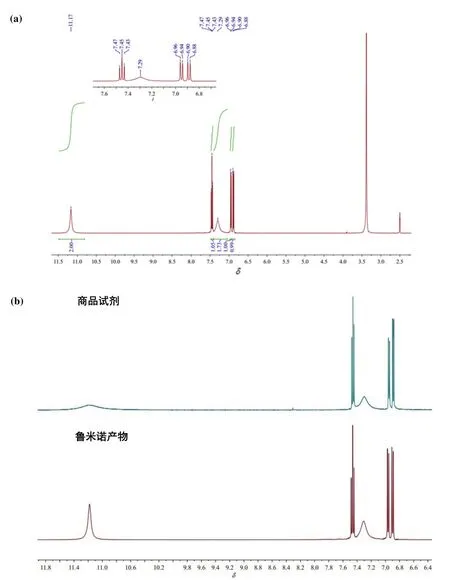
图10 (a) 鲁米诺产品核磁共振氢谱图;(b) 鲁米诺产物与商品试剂谱图对比
3.3 探究影响鲁米诺振荡化学发光反应的因素
3.3.1 鲁米诺浓度的影响
我们监测了35 °C搅拌条件下鲁米诺振荡化学发光光强随时间的变化。根据振荡体系中不同反应物浓度对光强及振荡周期的影响,总结振荡反应规律,供学生参考。
如图11所示,随着体系中鲁米诺浓度的增加,振幅稍增大,但振荡周期的变化不大,因为决定振荡周期的是Cu2+催化H2O2分解的过程,鲁米诺作为发光指示剂,对振荡周期影响不大。
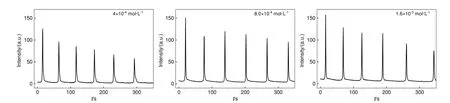
图11 不同鲁米诺浓度下鲁米诺/H2O2/SCN-/Cu2+/OH-振荡体系化学发光动力学曲线
3.3.2 KSCN浓度的影响
如图12所示,随着体系中KSCN浓度的增加,振幅增大,振荡周期变长。因为KSCN浓度增加,促进SCN-与Cu2+的配位形成[CuII(SCN)n]2-n,使得体系中Cu2+浓度下降,因而振荡周期变长。同时,一个振荡周期内累积的含氧自由基浓度增加,振幅增大。
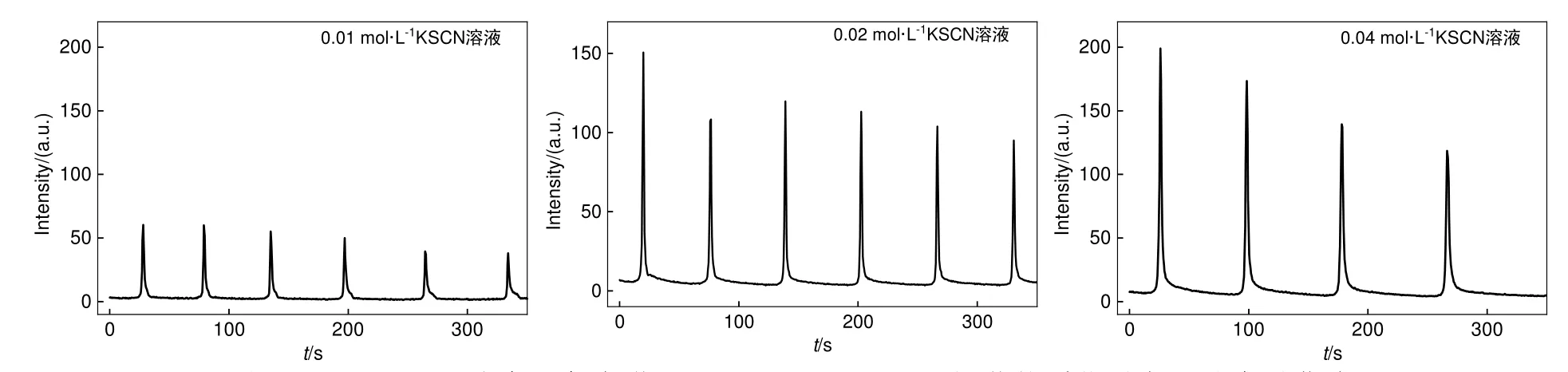
图12 不同KSCN浓度下鲁米诺/H2O2/SCN-/Cu2+/OH-振荡体系化学发光动力学曲线
3.3.3 CuSO4浓度的影响
如图13所示,随着CuSO4浓度的增加,Cu2+作为催化剂,加快振荡反应速率,从而使得周期变短。同时由于单位周期内累积的含氧自由基浓度减小,振幅减小。
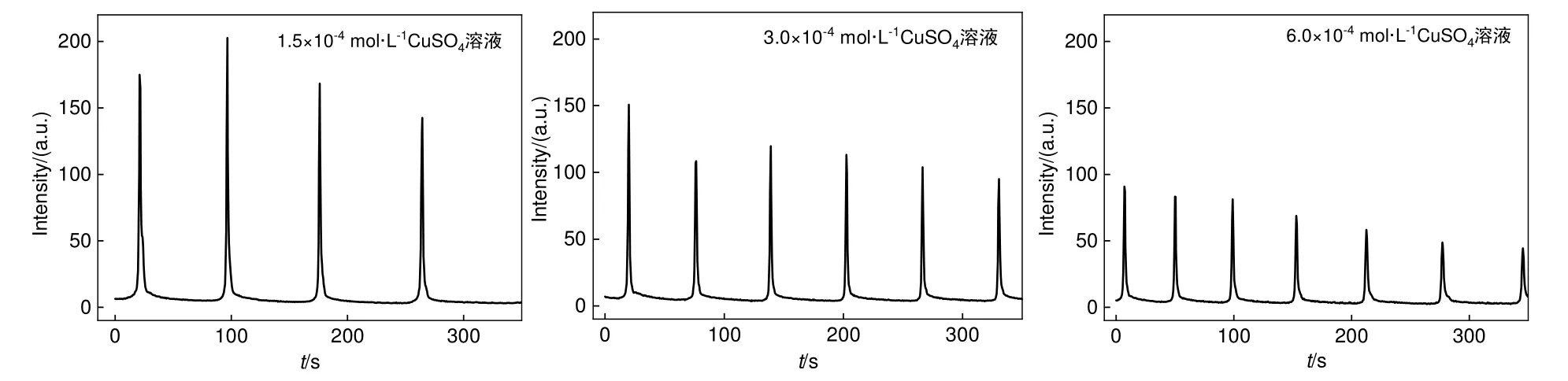
图13 不同CuSO4浓度下鲁米诺/H2O2/SCN-/Cu2+/OH-振荡体系化学发光动力学曲线
3.3.4 H2O2浓度的影响
如图14所示,随着体系中H2O2浓度的增大,振荡周期变短,振幅增大。因为H2O2作为反应物,其浓度增加,使得Cu2+催化H2O2分解的速率变快,振荡周期缩短。同时,H2O2浓度增加使分解产生的含氧自由基的浓度增加,因此振幅增大。
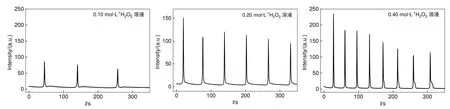
图14 不同H2O2浓度下鲁米诺/H2O2/SCN-/Cu2+/OH-振荡体系化学发光动力学曲线
3.3.5 温度的影响:计算表观活化能
与上述方法类似,我们用F-7000荧光光谱仪测定了不同温度下振荡周期随时间的变化,结果如表2所示。其中各组分浓度为:溶液A (2.0 mol·L-1H2O2);溶液B (0.2 mol·L-1KSCN);溶液C (3.0 ×10-3mol·L-1CuSO4);溶液D (0.2 mol·L-1NaOH和8.0 × 10-3mol·L-1鲁米诺)。
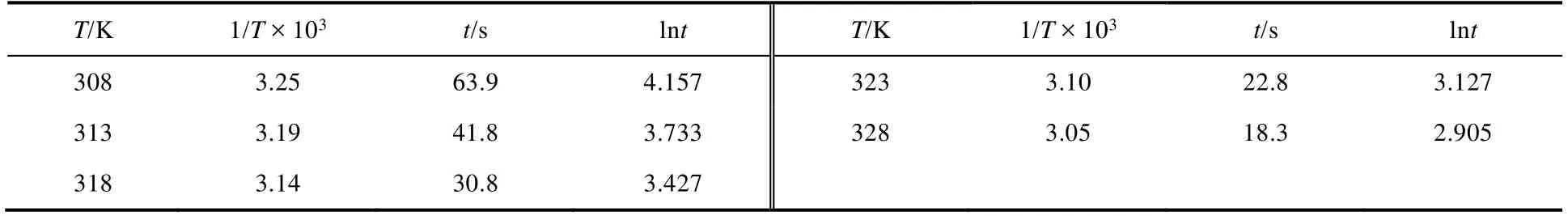
表2 不同温度下的振荡周期变化
根据阿伦尼乌斯方程,振荡周期t与温度T的关系可表示为:lnt= -lnA+Ea/RT。其中,Ea是表观活化能,R是理想气体常数(8.31 J·mol-1·K-1),T是Kelvin温度,A是经验常数。以lnt对1/T× 103作图(图15),从直线斜率可求振荡反应的表观活化能Ea(52.3 kJ·mol-1)。

图15 鲁米诺振荡化学发光反应lnt-1/T×103关系
4 结语
对标国家建设一流课程的“两性一度”(高阶性、创新性和一定的挑战度)要求,我们对“鲁米诺的合成与化学发光实验”进行了改进和拓展,希望能更有效推广这个科学内涵丰富且极具展示度的基础化学实验。
将现有教材中鲁米诺合成过程用到的磁力搅拌、保险粉还原和常规加热改进为机械搅拌、硫粉还原和微波合成,实现了安全、快速、高效制备高纯度鲁米诺的目的。
基于鲁米诺的化学发光性质,设计了振荡化学发光实验,周期性的发光现象就如同天上一闪一闪的小星星;通过自行设计并搭建简易微型磁力搅拌加热装置,与荧光光谱仪配套使用,精确测定振荡化学发光的振幅与周期,并根据阿伦尼乌斯经验公式计算振荡反应的表观活化能。
该实验涉及多学科的重要知识点,仪器简单,可操作性强,易于推广。本校已开展过一轮教学实践,合成部分学生独自开展,振荡化学发光部分以小组合作方式进行,整个实验可在8 h内完成,学生有充足的时间自行设计对比实验,进而总结反应规律并探讨振荡反应机理。开放性的实验设计极大提高了学生提出问题和解决问题的积极性。
5 创新性
1) 引入机械搅拌、硫粉还原和微波合成,确保安全、快速、高效地制备高纯度鲁米诺。
2) 将与非平衡态热力学有关的振荡化学发光反应引入基础实验教学。
3) 借助自主设计的简易微型磁力搅拌加热装置,利用荧光光谱仪实时定量监测振荡化学发光过程。
致谢:感谢厦门大学化学化工学院陈曦教授、王翊如副教授、周剑章副教授、陈毅辉副教授等老师和厦门大学化学国家级实验教学示范中心技术人员的帮助和指导。

