基于深共熔溶剂的电解液用于CuCl2电化学行为研究
毕伟杰,温珏,赖健寅,张文彬,2,朱凤,2,*
1宜春学院化学与生物工程学院,江西 宜春 336000
2江西省高等学校应用化学与化学生物学重点实验室,江西 宜春 336000
电化学是物理化学课程的重要内容,它无论在理论上还是实际应用上都有十分丰富的内涵。物理化学课程中电解质溶液部分主要介绍水溶液体系的离子导电情况,随着科学技术的发展,科学研究者提出了一些新型的电解质概念,如聚电解质、离子液体、共熔电解液、超高盐浓度电解液(waterin-salt)等[1]。而在2017年和2020年两次的物理化学相关教学内容与教学要求建议中[2,3],就“电解质溶液”章节,建议增加固体电解质、聚电解质和离子液体等知识点;并且相比2017年建议稿,2020版将固体电解质、聚电解质和离子液体位置提前。由此可以看出,在本科生课程教学中将科学前沿带入课堂得到越来越多的重视。而在通常的物理化学实验课程中,电化学实验的设置一般为原电池电动势的测定及离子迁移数的测定,难以体现学科的发展。
深共熔溶剂(Deep Eutectic Solvents,DESs)的概念于2003年由Abbott[4]提出,因其同时具备溶剂性质和电解液性质而引起广大研究者的兴趣。通常,DESs是由季铵盐与氢键给体(Hydrogen Bonding Donor,HBD)在一定的组成比例下,通过氢键网络连接形成的共熔混合物,其凝固点比任一组分低,在室温下呈液态,对很多物种有良好的溶解能力,而且具备蒸汽压低、电导率良好、电化学窗口宽、化学和热稳定性好、制备简单等优点,可以称为类离子液体。但与离子液体不同的是,DESs制备简单,而且对水和空气不敏感。通过改变其组成,可以制备106种双混合深共熔溶剂,因此可以称其为可设计的溶剂,这个特点使得DESs在电化学领域展现出独特的优势。
本实验尝试将DESs的制备、物理化学性质测定及在电化学中的应用引入物理化学实验,深共熔溶剂的概念属于物理化学课程“相”章节的内容,是相知识点的一个实际应用;物理化学性质测定主要包括电导率测定和粘度的测定。电导率是电解液的重要性质,水系电解质溶液体系一般采取加入支持电解质的方式以提高溶液的离子导电性,而深共熔溶剂本身具有一定的导电能力,无须额外加入支持电解质,这是深共熔溶剂的优点之一;粘度的测定有助于学生后期开展电化学实验时对传质进行分析,且电导率和粘度的测定亦是物理化学常规的实验手段,易于实现。本实验中将电导率和粘度的性质与电化学行为关联有助于训练学生的综合实验能力。此外,无须额外加入支持电解质和添加剂,将深共熔溶剂应用于CuCl2的电化学行为研究,能帮助学生理解深共熔溶剂作为电解液的应用以及借助循环伏安技术分析电活性物种的氧化还原过程。
1 实验目的
(1) 拓宽对电解液的认知;
(2) 熟悉基于深共熔溶剂的电解液的性质;
(3) 学会利用电化学工作站开展循环伏安实验;
(4) 能将电解液性质、电极材料与循环伏安图进行关联分析。
2 实验原理
2.1 深共熔溶剂的性质
氯化胆碱是最常用的氢键受体之一,出现最早且使用最多的深共熔溶剂是以1 : 2摩尔比混合的氯化胆碱(熔点302 °C)和尿素(熔点133 °C)混合物reline,此深共熔溶剂的熔点为12 °C[2]。
另一个常用的深共熔溶剂是以1 : 2摩尔比混合的氯化胆碱(熔点302 °C)和乙二醇(凝固点-12.9 °C)共熔混合物ethaline,其凝固点为-66 °C[5]。
深共熔溶剂的结构特点使其具备独特的物理化学性质,而这些物理化学性质又影响着其应用。其中,粘度和电导率是深共熔溶剂作为溶剂和电解液的两个非常重要的性质。
粘度是流体的一种属性,是流体内部摩擦的一种表征。和常规的分子溶剂相比,由于各组分之间存在强大的氢键网络,深共熔溶剂的粘度比较大,且与组成和温度密切相关。粘度的测定对分析深共熔溶剂中的传质有着重要的作用。
基于氯化胆碱的深共熔溶剂为离子型溶剂,其本身具有一定的电导率。深共熔溶剂的电导率同样受HBD类型和温度影响,氢键网络越强,离子的移动能力越弱,电导率越小;而温度升高则有利于离子的移动,电导率增大。
此外,大多数深共熔溶剂具有吸湿性,常规条件下制备的深共熔溶剂一般含有一定的水,水的存在会影响深共熔溶剂的物理化学性质,如粘度和电导率。而往DESs中加入一定量的水以优化DESs的物理化学性质是研究者们常采用的一种手段。文献报道,DESs中水含量较低时,DESs内部的氢键网络结构仍能够保持[6],但其粘度却可以降低、电导率得以升高,这有利于提高电化学活性物种在介质中的电化学反应过程。
2.2 深共熔溶剂中CuCl2的电化学行为
循环伏安技术(Cyclic Voltammetry,CV)是最常用的一种电化学技术,其通过三角波形式实现电位的循环扫描。电解液和电极材料是影响循环伏安图的两个重要因素。通过循环伏安图上的峰电流和峰电位,可以得到电活性物种氧化还原信息以及传质或动力学信息。
reline和ethaline中Cl-的化学计量浓度大约为4.5 mol·L-1,CuCl2在这两种DESs中以络合物的形式存在,Cu(I)能稳定存在,所以在进行循环伏安扫描时,循环伏安图上可以观察到两对氧化还原峰,一对来源于Cu(II)/Cu(I)之间的相互转化,另一对氧化还原峰则对应着Cu(I)的还原以及Cu单质的溶出,两对峰对应的反应如式(1)和式(2)所示。

3 实验部分
3.1 试剂与材料
氯化胆碱(国药沪试,AR)、尿素(国药沪试,AR)、乙二醇(国药沪试,AR)、氯化铜(国药,AR)、氯化钾(国药,AR)、卡尔费休试剂(江苏维科特,AR)、超纯水。
Pt盘电极(直径2 mm),玻碳电极(直径2 mm),Ag丝准参比电极,Ag/AgCl参比电极,Pt片电极,恒温水浴电解池。
3.2 仪器和表征方法
磁力加热搅拌器(大龙兴创实验仪器股份公司),电导率仪(DDS-307A,上海雷磁),粘度计(SNB-2,上海精密仪器仪表有限公司),电化学工作站(CHI760e,上海辰华),超声清洗器(KQ-50DE,昆山市超声仪器有限公司),超级恒温水浴(SYC-15C,南京桑力电子设备厂),卡尔费休水分测试仪(WKTA9,江苏维科特),移液枪。
3.3 实验步骤
3.3.1 深共熔溶剂的制备与水含量测试
氯化胆碱和尿素(或乙二醇)以1 : 2的物质的量比置于干燥的烧杯中,烧杯上方保鲜膜封口,磁力搅拌器加热至80 °C时,烧杯中的固体逐渐变为无色透明液体,室温下冷却。制备所得的深共熔溶剂通过卡尔费休水分仪测定其水含量。实验结果表明,基于氯化胆碱和尿素的深共熔溶剂reline水含量一般能控制在2% (质量百分比,下同)左右,而基于氯化胆碱和乙二醇的深共熔溶剂ethaline水含量要略低于前者,一般为1.5%左右。制备得到的深共熔溶剂加入一定量的水,使水的含量保持为5%,后续描述中,将直接制备所得的深共熔溶剂称为reline、ethaline,而加入水后的标记为reline-5% H2O、ethaline-5% H2O。
3.3.2 粘度测试
将reline、reline-5% H2O、ethaline、ethaline-5% H2O 4个样品分别转移至旋转粘度计样品池,样品池通过循环水浴恒定温度为30 °C,选择合适的转子和转速,示数稳定后读取粘度值,每个样品测量3次,取平均值。
3.3.3 电导率测试
用KCl标准溶液校准电导率仪的电导电极常数,电导电极通过超纯水冲洗干净,自然风干或者用纸吸干水分(注意:不能用纸擦拭镀铂黑的铂电极),制备好的4种电解液体系分别置于电解池内,通过恒温循环水浴控制温度为30 °C。将电导电极浸入深共熔溶剂,待示数稳定后读取电导率数据,每个样品测量3次,取平均值。
3.3.4 电化学实验
电化学实验采取三电极体系,以玻碳电极(GCE)或Pt电极为工作电极,Pt片为对电极,深共熔溶剂体系以内置于玻璃管的Ag丝为准参比电极,玻璃管内灌有reline或ethaline溶剂,水溶液体系中以Ag/AgCl为参比电极。GCE或Pt电极分别在0.3 μm和0.05 μm Al2O3浆上抛光打磨,每次打磨后超纯水冲洗,置于有超纯水的烧杯中超声清洗,清洗后的电极自然风干,待用。
首先,在GCE和Pt电极上开展深共熔溶剂的空白CV实验,即不含有CuCl2时,对reline,reline-5%H2O、ethaline、ethaline-5% H2O电解液分别开展CV扫描,在扫描过程中逐渐摸索扩大扫描区间直到有明显的氧化或还原电流产生,不发生明显电化学反应的区间即为电解液在电极上的电化学窗口。
其次,对含有0.1 mol·L-1CuCl2的reline-5% H2O和ethaline-5% H2O分别在GCE和Pt电极上开展CV研究。
此外,为更好地形成对比,以含有0.1 mol·L-1CuCl2的KCl水溶液为电解液,分别在GCE和Pt电极上开展CV实验,所得结果与深共熔溶剂中的CV图做定性比较。
4 结果与讨论
4.1 深共熔溶剂的粘度和电导率
粘度是流体的重要性质,对传质过程有显著的影响,深共熔溶剂的粘度受HBD影响。基于氯化胆碱的深共熔溶剂中,HBD和氯化胆碱形成的氢键网络越强,则粘度越大,离子的移动能力越弱。表1为reline和ethaline的粘度和电导率数据,从表1的粘度数据可以看出,ethaline粘度比reline小很多,当往深共熔溶剂中加入一定量的水,使其中水含量达到5%时,对应的深共熔体系的粘度均有较大幅度的降低。
电导率是深共熔溶剂作为电解液的一个重要性质。30 °C时,4种深共熔溶剂体系的电导率如表1所示,在reline和ethaline体系中,根据投料计量比计算,氯化胆碱(ChCl)的浓度达到4.5 mol·L-1,即表观胆碱离子(Ch+)和Cl-的浓度皆为4.5 mol·L-1。但reline电导率却较小,仅为1.08 mS·cm-1;另外,ethaline电导率远大于reline,这与reline粘度远大于ethaline的结果一致,即reline的高粘度限制了离子的自由移动,导致电导率较小。当往深共熔溶剂中加入水使其含量达到5%时,reline和ethaline体系的电导率均增大,有利于其作为电解液开展电化学实验。
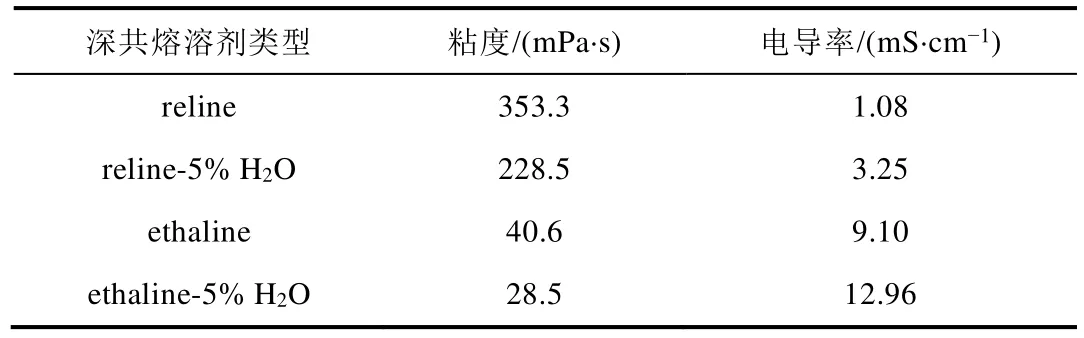
表1 深共熔溶剂的粘度和电导率(实验温度:30 °C)
4.2 电化学实验
4.2.1 reline和ethaline电解液的电化学窗口
图1、图2分别为GCE和Pt电极上reline、reline-5% H2O和ethaline、ethaline-5% H2O的循环伏安图。可以看出,GCE在reline (图1a)和ethaline (图2a)的电化学窗口较宽,而且水含量为5%时的CV和不额外加入水的基本重合,说明此含量的水对reline和ethaline的电化学窗口影响很小;Pt电极在reline (图1b)和ethaline (图2b)中,阴极区出现氢的吸脱附峰,水含量增加至5%时,氢的吸脱附峰变得更明显,这主要跟Pt电极容易跟氢和氧作用有关。不过从后续的电化学实验看,Pt上氢的吸脱附峰并不影响对CuCl2电化学行为的分析。

图1 GCE (a)和Pt电极(b)在reline和reline-5% H2O中的电化学窗口
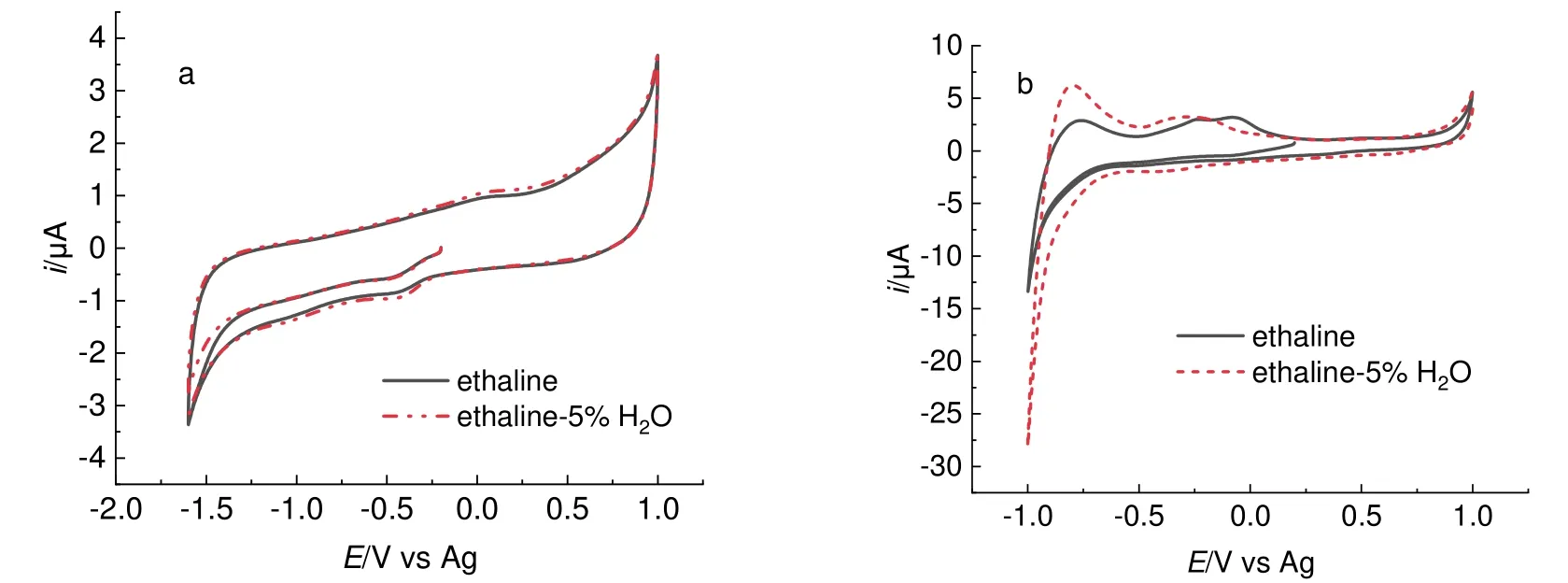
图2 GCE (a)和Pt电极(b)在ethaline和ethaline-5% H2O的电化学窗口
4.2.2 深共熔溶剂中CuCl2的电化学行为
为改善基于DESs电解液的物理化学性质,CuCl2的电化学实验中统一使用含水量为5%的深共熔溶剂。
图3为reline-5% H2O中,CuCl2在GCE (图3a)和Pt (图3b)电极上不同扫速时的CV图,两种电极材料上的CV图都出现两对氧化还原峰,0.5 V左右的一对峰为Cu(II)/Cu(I)之间的相互转化,另一对氧化还原峰则对应着Cu(I)的还原以及Cu单质的溶出。随着扫速的增加,两对峰的峰电流增加,Cu(I)的还原峰电位明显负移。此外,两种电极材料上Cu(II)/Cu(I)的峰形比较接近,而Cu的沉积和溶出峰则差别比较大。GCE上Cu的沉积出现明显的loop环,说明GCE上Cu的沉积为过电位沉积,溶出峰比较钝;而Pt电极上Cu的沉积则未观察到loop环,溶出峰则比较尖锐,这充分说明了金属的电沉积受电极材料影响,Pt电极上Cu(I)/Cu氧化还原过程比GCE上更快。
两种电极材料上Cu(II)/Cu(I)的峰电流和峰电位数据分析见表2,随着扫描速度的增加,GCE上峰电流之比呈增加趋势,而Pt电极上的峰电流之比则基本保持不变;峰电位之差则都随着扫描速度的增加而增加。说明在reline-5% H2O中,GCE和Pt电极上Cu(II)/Cu(I)的氧化还原为准可逆过程。
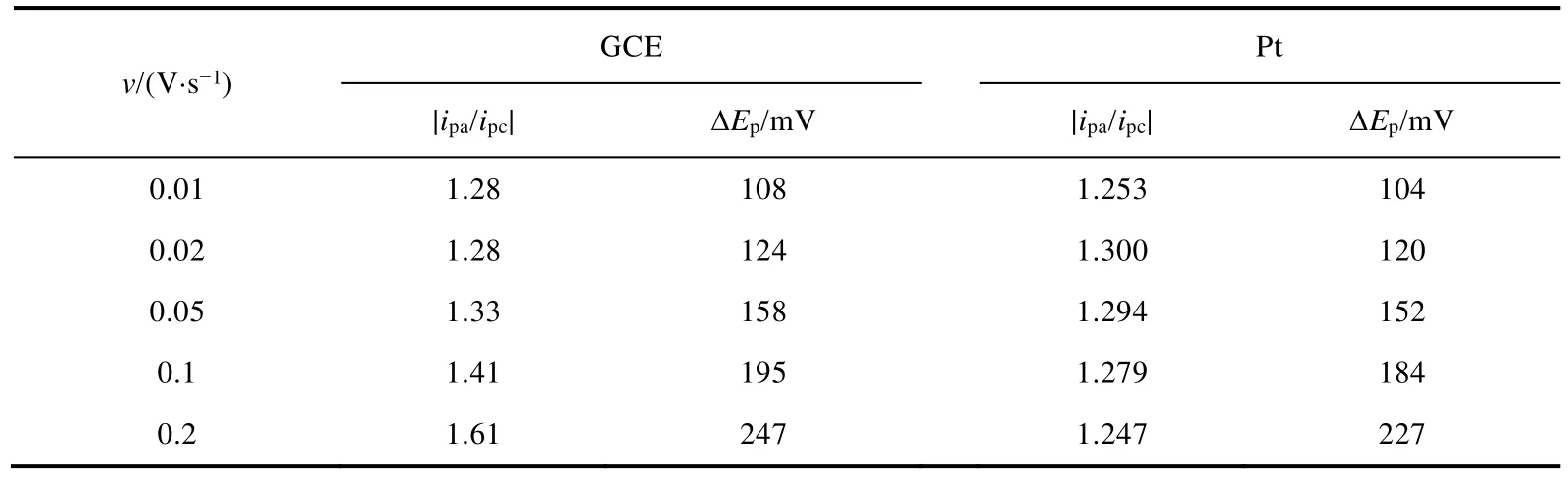
表2 GCE和Pt电极上,0.1 mol·L-1 CuCl2在reline-5% H2O中Cu(II)/Cu(I)的循环伏安结果
图4为ethaline-5% H2O中CuCl2在GCE (图4a)和Pt电极(图4b)上的CV图,ethaline-5% H2O体系中,GCE和Pt电极上CuCl2的氧化还原现象与reline-5% H2O中基本一致。同一种电极材料上,对CuCl2在reline-5% H2O和ethaline-5% H2O的CV图进行比较会发现,ethaline-5% H2O中的氧化还原电流明显比reline-5% H2O中的要大,推测是因为ethaline-5% H2O粘度比较小,电活性物种在ethaline-5% H2O中的传质更快。

图4 ethaline-5% H2O中,不同扫速下,0.1 mol·L-1 CuCl2在GCE (a)和Pt电极(b)上的循环伏安图
对图4a和4b中Cu(II)/Cu(I)氧化还原电对峰电流和峰电位数据分析见表3,可以看出,随着扫描速度的增加,峰电流之比几乎不变;而峰电位之差则随着扫速的增加而增大,这说明ethaline-5% H2O中,Cu(II)/Cu(I)在GCE和Pt电极上的氧化还原为准可逆过程。

表3 GCE和Pt电极上,0.1 mol·L-1 CuCl2在ethaline-5% H2O中的Cu(II)/Cu(I)循环伏安结果
4.2.3 水溶液中CuCl2的电化学行为
此外,为形成有效的对比,我们开展了水溶液体系中CuCl2的电化学实验。在4 mol·L-1KCl的水溶液中,CuCl2在GCE电极和Pt电极上的CV如图5a和5b所示。与reline-5% H2O和ethaline-5% H2O相比,水溶液中GCE上Cu(I)的沉积峰和溶出峰形状有较大变化,随着扫速的增大,Cu的沉积电位基本保持不变,而且溶出峰呈现良好的峰形,说明水溶液中Cu在GCE上的沉积动力学比reline-5% H2O和ethaline-5% H2O中的快。而Pt电极上,峰形则基本相同。此外,从峰电流分析,水溶液中两种电极上的峰电流大约比reline-5% H2O中的大10倍,比ethaline-5% H2O中的约高5倍。

图5 4 mol·L-1的KCl水溶液中,不同扫速下,0.1 mol·L-1 CuCl2在GCE (a)和Pt电极(b)上的循环伏安图
5 结语
深共熔溶剂在电化学中有广泛的应用,本实验尝试将基于深共熔溶剂的电解液引入物理化学实验电化学部分。深共熔溶剂涉及的物理化学内容非常丰富,与物理化学教学内容建议中关于电解液部分的要求相契合,本实验有利于拓宽学生的知识面和培养学生积极思考的能力。
本实验既有对基于深共熔溶剂的电解液性质测定,又含括了此类电解液和电极材料对CuCl2电化学行为的影响,同时与水溶液体系做了对比,非常有利于学生对物理化学课程中电化学部分内容的理解,亦有助于培养学生的思维能力,激发学生开展科学研究的兴趣。
实验组织说明:本实验包括深共熔溶剂的制备、物化性质测定和电化学实验三部分,涵盖丰富的知识点,综合性较强。在教学组织方面,本实验可以作为物理化学实验,亦可以作为高年级的综合化学实验开设,有利于培养学生的科学思维能力。同时,该实验又具有模块化的特点,可以就深共熔溶剂的类型和电极材料进行随机组合。教师可根据学校实验条件、课时数以及不同年级学生的水平安排实验教学的内容。
6 创新性/特点/特色声明
创新性:将科研领域的新型电解液概念与课堂教学和实验教学结合,可以激发学生的科研创新热情。
特点:
(1) reline和ethaline两种深共熔溶剂的粘度和电导率差别都比较大,有助于学生对性质和应用的理解;
(2) 作为一类新型离子液体,本实验中选用的深共熔溶剂制备过程简单,试剂温和,不涉及剧毒易燃易爆腐蚀性,操作性好,具有简单、易行的特点。
特色声明:
(1) 将深共熔溶剂的制备及其应用引入物理化学教学实验,既与物理化学教学建议相契合,又对学生的学习具有很好的启发性;
(2) 在循环伏安法测定电化学行为部分,设计了不同类型深共熔溶剂和不同材料对CuCl2电化学行为的影响,同时与水溶液体系做了对比,有助于学生深入认识电化学的影响因素。

