苯甲醇的绿色选择性氧化
虞宗豪,洪宇轩,曹馨尹,孙宏枚,赵蓓,姚英明
苏州大学材料与化学化工学部,江苏 苏州 215123
1 引言
氧化反应是有机化学中的基本反应之一,在有机合成中具有特殊重要的意义[1]。选择性氧化是有机化学理论教学中的一个重要内容,其中,伯醇的选择性氧化是一个典型例子。因为醛是一种用途广泛的重要有机化学品,但通过伯醇的氧化法制备时容易被直接氧化为羧酸。所以,由伯醇制备醛往往需要特殊试剂或反应条件来控制氧化进程[2]。
苯甲醛是最简单的、也是工业上最常使用的芳香醛。目前,面向本科生的有机化学实验教材中,苯甲醇选择性氧化的实验方案是以Na2WO4·2H2O、(C4H9)4NHSO4和30%的H2O2为催化-氧化体系,在90 °C下反应,再经减压蒸馏得到目标产物苯甲醛,分离产率低(图1,方程式a)[3]。由于Na2WO4·2H2O含有重金属、排放的废液具有环境污染性,同时90 °C下使用H2O2存在安全隐患,尤其是蒸馏时若有残留的H2O2可能引发爆炸。因此,很有必要对这个实验进行改良。
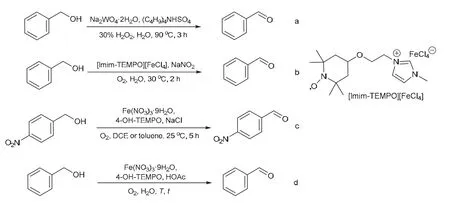
图1 苯甲醇选择性氧化为苯甲醛
通过文献调研,我们发现伯醇的选择性氧化作为有机合成中一个非常重要的官能团转换,受到了广泛的关注。其中一个新进展就是基于铁系催化体系的O2氧化法[4–7]。铁是地壳中含量最丰富的金属元素之一,价格低廉,同时具有很好的生物相容性,是目前开发绿色金属催化剂的首选之一[8],而O2相对其他常用氧化剂而言,也具有价廉、环境友好(如氧化副产物为水)等优势[4]。因此,基于铁系催化体系的O2氧化法为伯醇的选择性氧化提供了一个极具吸引力的新策略。2011年,何良年和张锁江等人[9]设计了一个含Fe3+离子的离子液体,发现它与NaNO2、O2组成的催化-氧化体系可以将苯甲醇选择性地氧化为苯甲醛,反应以H2O为溶剂,但是使用毒性较强的NaNO2限制了该方法的实用(图1,方程式b)。2019年,麻生明等人[10]报道了以Fe(NO3)3·9H2O、4-羟基-2,2,6,6-四甲基哌啶氧化物(4-OH-TEMPO)、NaCl和O2为催化-氧化体系,实现了对硝基苯甲醇的选择性氧化(图1,方程式c)。其中,铁(III)盐和4-OH-TEMPO可以购买,价格也较便宜,但是该方案的优选溶剂是毒性较强的1,2-二氯乙烷(DCE)或者高沸点的甲苯,遇H2O则不能顺利进行。于是,我们希望能够综合上述两个研究成果的优点,以Fe(NO3)3·9H2O和4-OH-TEMPO为催化剂、O2为氧化剂、H2O为溶剂进行反应,将苯甲醇高选择性地氧化为苯甲醛,获得适合本科生基础实验教学的新方案(图1,方程式d)。
2 实验部分
2.1 实验原理
参考文献[4,5],本实验的反应机理涉及两个催化循环过程。如图2所示,在循环1中:首先,铁(III)盐中的Fe3+离子与4-OH-TEMPO结合生成中间体1,然后,中间体1与苯甲醇反应,释放H+形成中间体2,最后,中间体2经过攫氢反应生成苯甲醛,同时生成Fe2+离子和4-OH-TEMPOH;循环2则涉及Fe2+离子和Fe3+离子之间的转变,其中O2和NO2起了关键的作用,这个循环确保了循环1的顺利进行。在催化剂预反应阶段,逐渐产生的催化量NO2来源于铁(III)盐Fe(NO3)3·9H2O。
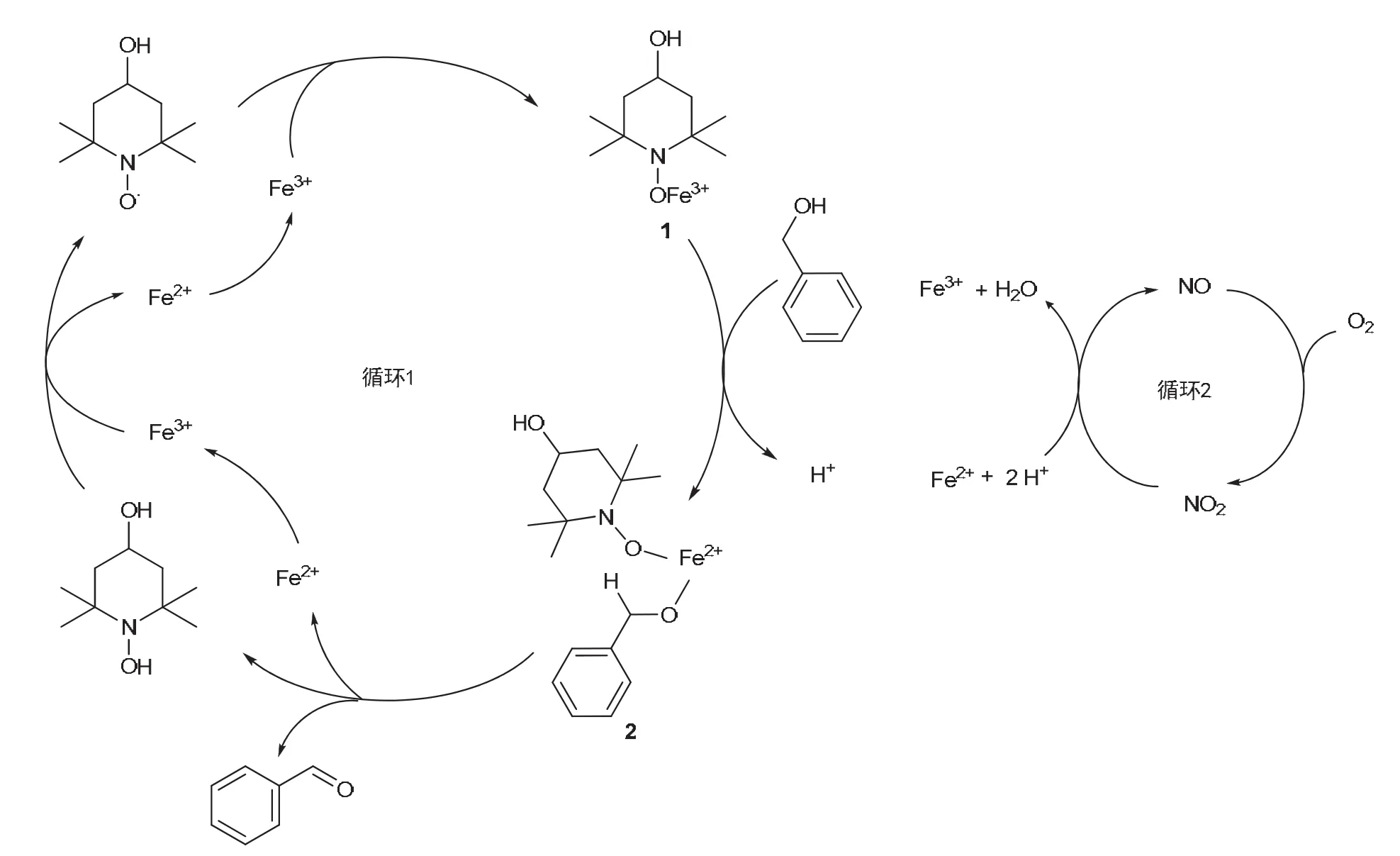
图2 本实验的反应机理
2.2 试剂及材料
实验试剂及材料如表1所示。
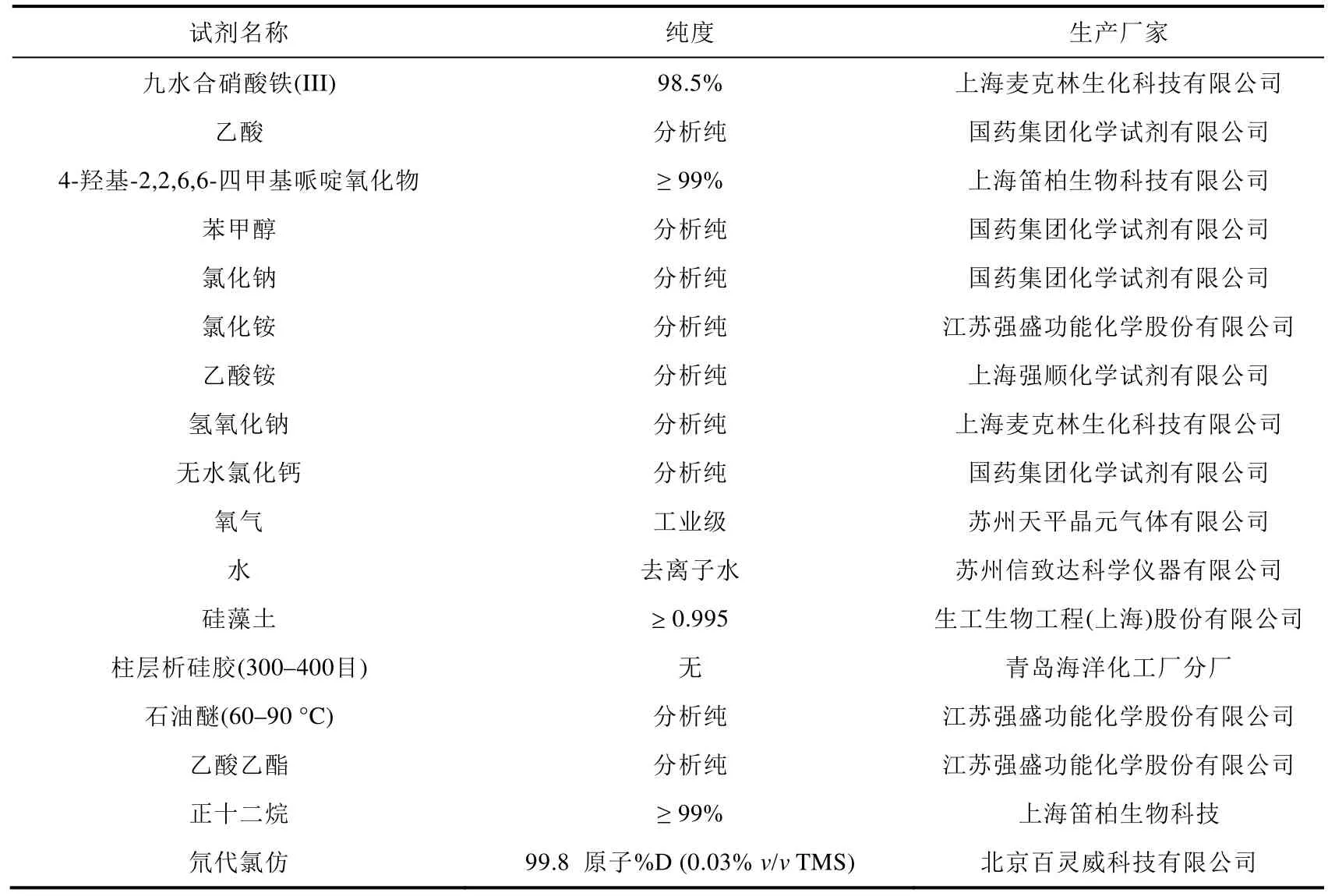
表1 实验试剂及材料
2.3 仪器和表征方法
2.3.1 实验仪器
实验仪器如表2所示。

表2 实验仪器
2.3.2 表征方法
(1) 气相色谱(GC):以乙酸乙酯为溶剂,n-C12H26为内标。色谱柱型号:P/N: 19091J-413(HP-5 30 m × 320 μm × 0.25 μm)。升温程序:初温80 °C保持1 min,程序升温速率20 °C·min-1,终温300 °C保持2 min。运行后在280 °C保持2 min。
(2) 快速制备液相色谱:洗脱剂为V(石油醚) :V(乙酸乙酯) = 9 : 1,安装分离柱并润洗;安装上样柱,启动快速制备程序,用试管自动接收洗脱液。
(3) 核磁共振氢谱(1H NMR):将样品溶于含有0.03% (体积分数) TMS的氘代氯仿(CDCl3)中,转移到核磁管中充分摇匀,室温下测定。
2.4 实验步骤
2.4.1 预反应
如图3所示搭建反应装置,向50 mL三颈圆底烧瓶中依次加入Fe(NO3)3·9H2O (0.56 g,1.4 mmol)、5滴乙酸(HOAc,约0.25 mL)和4-OH-TEMPO (0.48 g,2.8 mmol),塞上堵头,打开弹簧夹,通入O2,室温下搅拌预反应15 min,反应瓶内逐渐有红棕色气体出现。

图3 反应装置示意图
2.4.2 苯甲醇的氧化
用注射器分别量取20.0 mL H2O和2.1 mL (20 mmol)苯甲醇,依次从乳胶管处(图4红色圈注处)注入。将水浴温度控制在50–55 °C之间,反应每1 h用注射器取出极少量反应混合物,通过薄层色谱法(TLC)监控反应进程。TLC的展开剂为石油醚和乙酸乙酯的混合液,体积比为5 : 1。约2 h后反应趋于完全,停止加热和搅拌,接上尾气吸收装置,通过挤压气袋的方式排出尾气,用NaOH溶液吸收。

图4 红圈内为注射器加液体处
2.4.3 苯甲醛的分离、提纯与表征
待反应混合液冷却至室温后,用硅藻土过滤,再用20 mL乙酸乙酯淋洗硅藻土。分液,用5 mL乙酸乙酯萃取水层一次。合并有机相,加入适量无水CaCl2干燥。过滤,将滤液转移至圆底烧瓶中。用旋转蒸发仪除去溶剂,得到橙黄色粗产物。取极少量粗产物,用乙酸乙酯稀释后进行GC分析,其结果见图5。发现其中主要是目标产物苯甲醛。
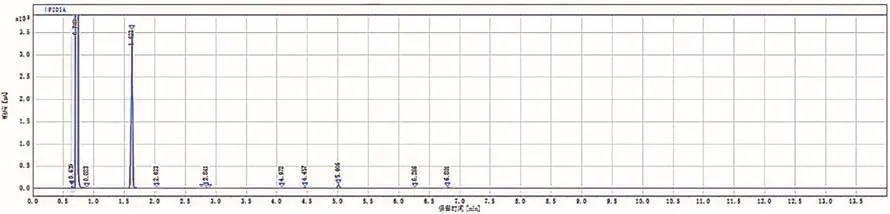
图5 反应混合物的GC谱图
利用快速制备液相色谱仪对粗产物进行分离提纯,根据检测曲线图(图6),并结合TLC的检测结果,确定目标产物苯甲醛所在的接收管。合并目标洗脱液,浓缩得到无色产品。通过减重法计算产物的产量和产率。本实验可以得到1.91 g苯甲醛,分离产率为91%。粗产物也可以通过柱色谱提纯,并用TLC跟踪、检出。
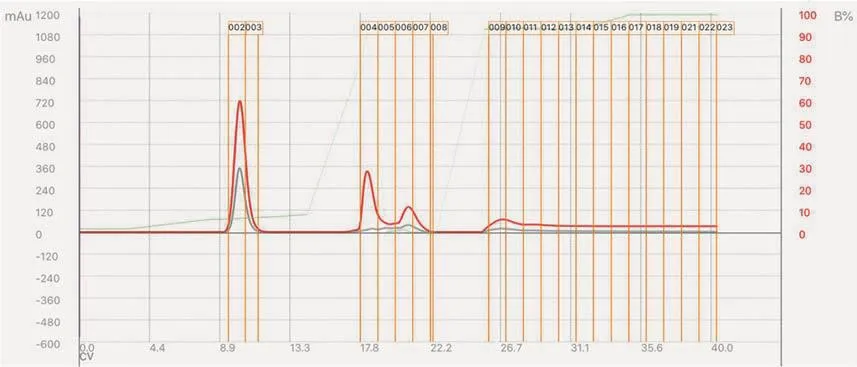
图6 粗产品的快速制备液相色谱仪的分离谱图
所得产物用1H NMR进行表征(图7),确定为苯甲醛。实验到此结束,历时约4–5 h。
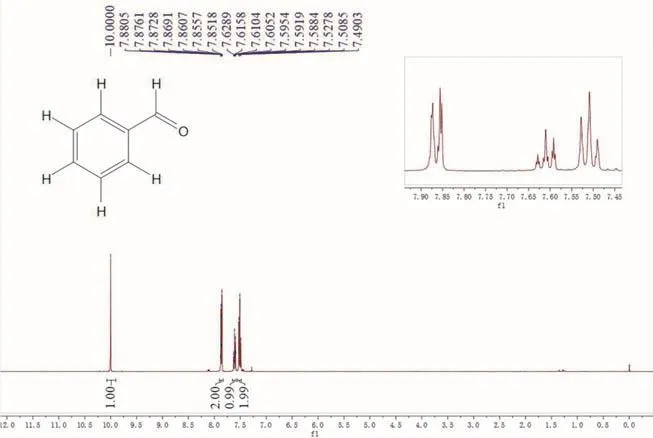
图7 产物苯甲醛的1H NMR谱图(300 MHz,CDCl3)
3 结果与讨论
3.1 实验条件筛选
我们以水为溶剂,对苯甲醇选择性氧化为苯甲醛进行了条件筛选,结果见表3。首先,我们参照文献报道的反应条件,即25 °C,由Fe(NO3)3·9H2O、4-OH-TEMPO、NaCl和O2组成催化-氧化体系[10],仅将溶剂由原来的DCE改成H2O,结果发现经过24 h反应,苯甲醛的GC产率只有15% (表3,序号1)。考虑到HOAc既可能代替上述方案中NaCl的作用,又能提供H+促进Fe2+离子和Fe3+离子之间的转变[10],我们以HOAc代替NaCl进行实验,果然发现苯甲醛的GC产率有所提升(表3,序号2)。又考虑到NO2在此氧化反应中的作用,我们增加了预反应环节,希望通过提升NO2的初始浓度来促进苯甲醛的生成。结果确如我们所料,在室温下经过15 min预反应(最佳时间)后,苯甲醇可以近乎100%转化,苯甲醛的GC产率高达91% (表3,序号3)。相比较,添加NH4Cl和NH4OAc的效果较差(表3,序号4和5)。随后,我们将H2O的用量从6 mL减少至3 mL,同时将水浴温度提高到30 °C,通过GC检测发现反应可以在7 h内顺利完成(表3,序号6)。考虑到本科生实验的课时要求,我们进一步提高反应温度至50 °C,同时又稍微增加了催化剂的用量,使得反应可以在2 h内完成,目标产物的分离产率可达89% (表3,序号7和8)。考虑到本科生实验的可操作性,也为了确保每一位本科生实验的重现性,我们将苯甲醇的用量由3 mmol增加至20 mmol,发现反应在2 h内也可以顺利完成(表3,序号9),水浴温度在50–55 °C之间变化时,目标产物的产率基本不变。
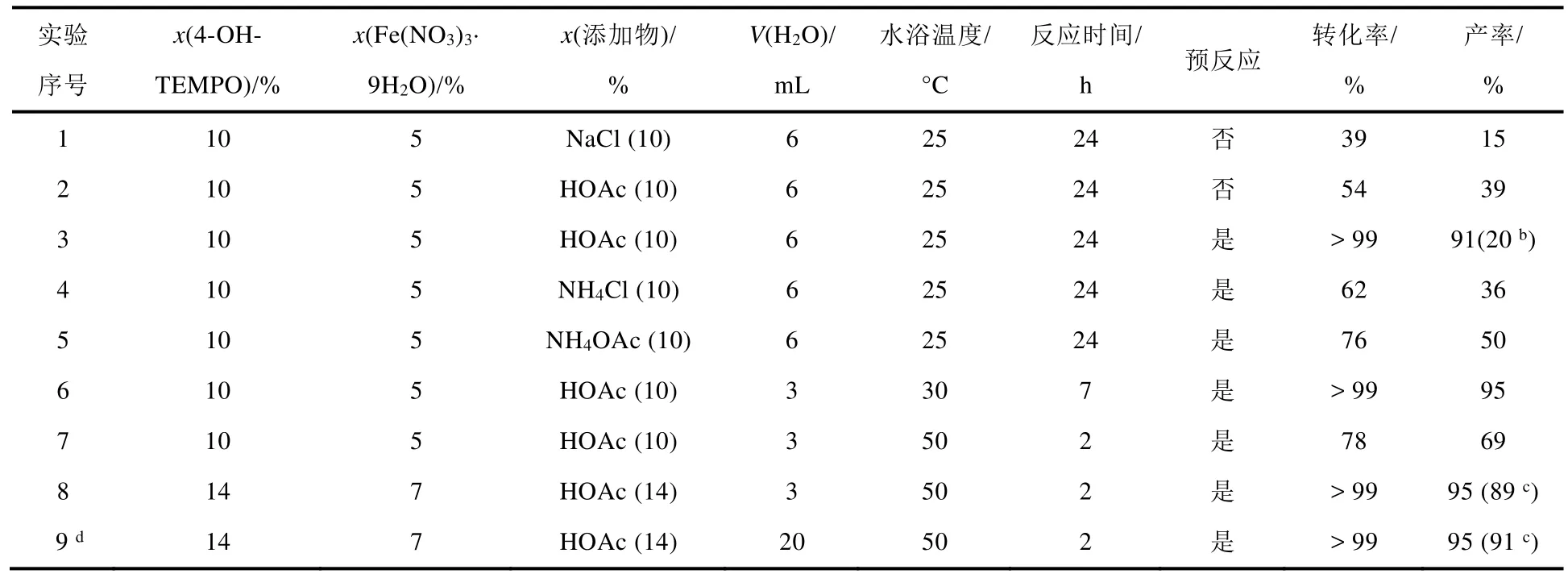
表3 实验方案的优化过程a
通过上述反应条件的筛选,本实验的最佳方案是:2.1 mL苯甲醇(20 mmol),0.56 g Fe(NO3)3·9H2O(x= 7%),n(Fe(NO3)3·9H2O) :n(4-OH-TEMPO) :n(HOAc) = 1 : 1 : 2,氧气袋,20 mL H2O,室温预反应15 min,然后50–55 °C水浴反应2 h,可得到苯甲醛1.91 g,分离产率为91%。
3.2 产物分离与表征
3.2.1 粗产物表征
反应混合物经硅藻土过滤、分液、干燥、浓缩后得橙黄色液态粗产物,将该样品做了GC检测(图5)。为了方便比较,我们还分别对苯甲醇、苯甲醛、苯甲酸和4-OH-TEMPO进行了GC分析,发现它们的保留时间分别为2.033、1.641、3.016和4.115 min。在此基础上,根据图5和薄层色谱的结果,我们发现粗产物中主要是目标产物苯甲醛(保留时间1.623 min),此外还包含4-OH-TEMPO和痕量的苯甲醇,没有观察到苯甲酸。保留时间0.706 min的信号归属于溶剂乙酸乙酯。
3.2.2 粗产物分离
考虑到苯甲醛比较容易氧化且是无色液体,因此我们采用快速制备液相色谱仪对粗产物进行分离提纯,结果如图6所示。
在正相柱色谱分离中,极性较小的有机化合物会较快地被洗脱。因此,根据上述分离谱图,结合TLC分析,可以确定产物收集在2号和3号接收管中。我们合并2号、3号接收管中的洗脱液,通过旋转蒸发得到了目标产物。通过减重法计算出苯甲醛的产量是1.91 g,产率为91%。
3.2.3 产物的表征
产物为无色液体,其1H NMR谱图上有四组峰,δ7.49–7.88的信号归属于苯环上的氢;δ10.00的信号归属于甲酰基上的氢,谱图中各峰面积之比为1 : 2 : 1 : 2 (图7),由此可以确定所得产物为苯甲醛。
3.3 教学可行性
在本实验方案中,选用Fe(NO3)3·9H2O、4-OH-TEMPO、HOAc和O2组成的催化-氧化体系,避免了已有实验教材中钨盐的重金属污染和过氧化氢的安全隐患。其中,Fe(NO3)3·9H2O、4-OH-TEMPO和HOAc可以直接购买使用,价格也比较便宜,使用H2O作为溶剂,因此所需试剂成本低;O2可以直接从氧气钢瓶用气袋接取,实验全程不涉及明火操作,安全性较高且清洁。反应过程中产生的NO2是催化量的,很容易通过NaOH溶液吸收处理。此外,这一氧化反应对温度不是很敏感,水浴温度在50–55 °C都可顺利进行,便于操作。
反应过程中现象明显,催化剂预反应时瓶内会逐渐出现红棕色气体,当反应趋于完全时瓶内几乎看不到红棕色,同时溶液颜色变浅,便于学生对反应进程的监测。
整个反应时间可控制在2 h,教师可以利用这段时间介绍气相色谱仪、快速制备液相色谱仪和核磁共振波谱仪的使用和操作要领。总的实验时间约4–5 h。
本实验设计中除了过滤、分液、干燥、萃取等常规操作以外,还在分离、提纯和表征等过程中引入了TLC、GC、1H NMR和快速制备液相色谱等技术手段,提升了本科生的实验技能,拓宽了本科生的专业视野,与工业生产实际紧密联系,符合现代化学实验教学对“实验基本操作–小型综合实验–综合实验”的多层次改革要求。
综合上述要点,我们认为本次创新性实验设计适合推广至大规模的本科生基础实验教学。
4 结语
本文报道了将苯甲醇高选择性氧化为苯甲醛的一个创新性改进实验方案。由于采用了绿色环保且价廉的铁系催化剂、O2为氧化剂,H2O为溶剂,使得反应绿色、安全性较高,同时兼具高选择性和良好的重现性。此外,在实验过程中,我们还采用了TLC和GC监测反应的进程,使用快速制备液相色谱仪和旋转蒸发仪对粗产物进行分离和提纯,采用1H NMR对目标产物进行表征。因此,这样的创新设计不仅满足了本科生基础实验的要求,还提升了本科生的实验技能和专业素养,与目前科学研究和生产实际联系更加紧密。同时也将有助于培养本科生的绿色化学理念,树立安全意识、环保意识和社会责任感。

