响应面分析法优化藜麦花青素提取工艺
张文刚,兰永丽,党 斌,张 杰,杨希娟
(青海大学农林科学院,青海省青藏高原农产品加工重点实验室,青藏高原种质资源研究与利用实验室,省部共建三江源生态与高原农牧业国家重点实验室,青海大学,青海 西宁 810016)
藜麦(ChenopodiumquinoaWilld.)为一年生双子叶“假谷物”,亦称南美藜、奎奴亚藜、藜谷等,在我国山西、青海、西藏、甘肃、云南、浙江、吉林等地均有分布[1]。藜麦富含蛋白质、不饱和脂肪酸、膳食纤维、矿物质、维生素、皂苷和多酚等成分,可满足人体基本的营养需求,并在预防癌症、心血管疾病、炎症等方面具有突出优势,被国际营养学家称为“超级谷物”[2]。鉴于其食用和药用价值,藜麦活性成分的分离纯化及功能特性研究、相关食品开发引起了国内外学者的广泛关注[3]。花青素(Anthocyanidins)属于黄酮醇类化合物,色泽鲜亮,无特殊气味,食用安全,具有清除自由基、护肝、降血脂、抗突变等特点,是谷物一类重要的天然抗氧化物质[4]。藜麦有红、白、黑等不同粒色,而花青素可能是除甜菜素外赋予籽粒颜色的关键化合物,掌握彩色藜麦花青素的提取与利用对探究藜麦的保健功能具有重要意义[5]。花青素的提取方法较多,包括溶剂萃取法、酶水解法、树脂法、超声萃取法和微波法等[6-8]。其中溶剂萃取法是提取花青素的传统方法,常选用甲醇、乙醇、石油醚、乙酸乙酯等作为有机溶剂,盐酸、磷酸、醋酸、柠檬酸等作为酸化剂。该方法操作简单,萃取效率和纯度较高,在花青素富集中应用广泛[9-11]。目前,有关不同粒色藜麦花青素分离提取的研究较少。因此,本研究以青白藜1号(白藜麦)、青藜2号(黑藜麦)和贡扎4号(红藜麦)为试验材料,采用Box-Behnken设计和响应面分析法探讨溶剂体系、提取参数等对不同粒色藜麦花青素提取的影响,为藜麦花青素的制备和开发提供理论依据。
1 材料与方法
1.1 试验材料
青白藜1号(白藜麦)、青藜2号(黑藜麦)和贡扎4号(红藜麦)由青海大学农林科学院作物所提供;矢车菊素-3-O-葡萄糖苷标准品(美国Sigma公司);醋酸钠、醋酸、氯化钾、盐酸、磷酸、柠檬酸、乳酸、硫酸、乙酸、甲醇、无水乙醇、丙酮等(天津科密欧试剂公司)。
1.2 试验仪器与设备
FW200高速中药粉碎机(天津华鑫仪器厂);N4S型紫外可见分光光度计(上海仪电分析仪器有限公司);TGL-20M型高速冷冻离心机(湘仪离心机仪器有限公司);PHS-3C型pH计(上海雷磁仪器厂);SHA-C型恒温振荡器(国华电器有限公司)。
1.3 试验方法
1.3.1 花青素的提取 藜麦籽粒除杂、清洗后45 ℃烘干,粉碎过60目筛。称取1.000 g藜麦粉置于50 mL离心管,加入酸化乙醇,混合均匀后在一定温度下浸提,12 000 r/min、4 ℃ 离心10 min,收集上清液。
1.3.2 单因素试验 以花青素提取量为指标,探讨溶剂(水、60%甲醇、60%乙醇、60%丙酮,V/V)、溶剂体积分数(20%、30%、40%、50%、60%、70%、80%)、酸化剂(盐酸、磷酸、柠檬酸、乳酸、硫酸、乙酸,4 mol/L)、pH(3.0、4.0、5.0、6.0、7.0)、料液比(1∶2、1∶4、1∶6、1∶9、1∶12、1∶15、1∶18、1∶21、1∶24 g/mL)、浸提温度(20、30、40、50、60、70、80 ℃)及浸提时间(20、40、60、90、120、150、180 min)对提取藜麦花青素的影响。各因素固定条件:60%乙醇,盐酸,pH 4.0,料液比1∶4 g/mL、浸提温度50 ℃,浸提时间60 min。
1.3.3 响应面试验设计 在单因素试验基础上,以藜麦花青素提取量为响应值,选择料液比、浸提温度、浸提时间为因素,采用Design-Expert 11软件进行Box-Behnken三因素三水平响应面设计(表1)。

表1 响应面试验因素与水平设计Tab.1 Design of factors and levels of response surface test
1.3.4 藜麦花青素含量的测定 利用双波长pH示差法[12]测定花青素含量。取1 mL花青素提取液,加入9 mL 0.4 mol/L、pH 4.5的NaAc-HAc缓冲液或0.25 mol/L、pH 1.0的KCl-HCl缓冲液,混合均匀后倒入1 mL比色皿,以蒸馏水替代样品作空白对照,分别在510 nm和700 nm下测定光密度(optical density,OD)。
花青素提取量(μg/g)=A×Mw×DF×V/(ε×1×W)
式中:A=(OD510 nm,pH 1.0-OD700 nm,pH1.0)-(OD510 nm,pH 4.5-OD700 nm,pH 4.5),Mw为矢车菊素-3-O-葡萄糖苷摩尔质量 449.2 g/mol,DF为待测液稀释倍数,V是提取液体积(mL),ε为矢车菊素-3-O-葡萄糖苷摩尔消光系数26 900 L/(mol·cm),W为藜麦粉干重(g)。
1.3.5 红外光谱分析 采用KBr压片法[10]测试藜麦花青素红外光谱。取藜麦花青素提取物粉末与干燥KBr混合均匀,压片后在4 000~400 cm-1范围内、分辨率4 cm-1条件下扫描红外光谱。
2 结果与分析
2.1 单因素试验
2.1.1 提取溶剂的影响 由图1a可知,藜麦粒色不同,所适宜的酸化剂也有差异。白藜麦提取量为乙酸>硫酸>磷酸,黑藜麦提取量为磷酸>柠檬酸>乳酸,红藜麦提取量为柠檬酸>乳酸>磷酸。为便于操作,选择对三种粒色藜麦花青素提取量均较高的磷酸作为优选酸化剂。由图1b看出,不同溶剂对藜麦花青素提取效果均表现为乙醇>甲醇>丙酮>水,乙醇显著高于其他溶剂(P<0.05)。因此,选择乙醇溶液作为最适提取溶剂。
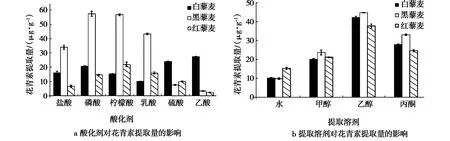
图1 提取溶剂对花青素提取量的影响Fig.1 Effects of extraction solvent on anthocyanins extraction
2.1.2 不同提取条件的影响 由图2a可知,藜麦花青素提取量随乙醇体积分数的增大先增大后减小,乙醇体积分数为70%时藜麦花青素提取量达到最大值。图2b表明,藜麦花青素提取量随着溶剂pH的升高而降低,pH为3.0时花青素提取量最大。图2c表明,藜麦花青素提取量随料液比的减小先增大后减小,料液比为1∶6 g/mL时效果最佳。图2d表明,藜麦花青素提取量随温度的升高先增大后减小,50 ℃时提取量最大。图2e表明,藜麦花青素提取量随浸提时间的延长先增大后减小,浸提时间为120 min时提取量最大。

图2 提取参数对花青素提取量的影响Fig.2 Effects of extraction parameters on anthocyanins extraction
2.2 响应面分析
2.2.1 试验结果 响应面试验结果见表2。经二次多项式回归拟合并在α=0.05水平剔除不显著项,得出藜麦花青素提取量与各编码因素间的方程:
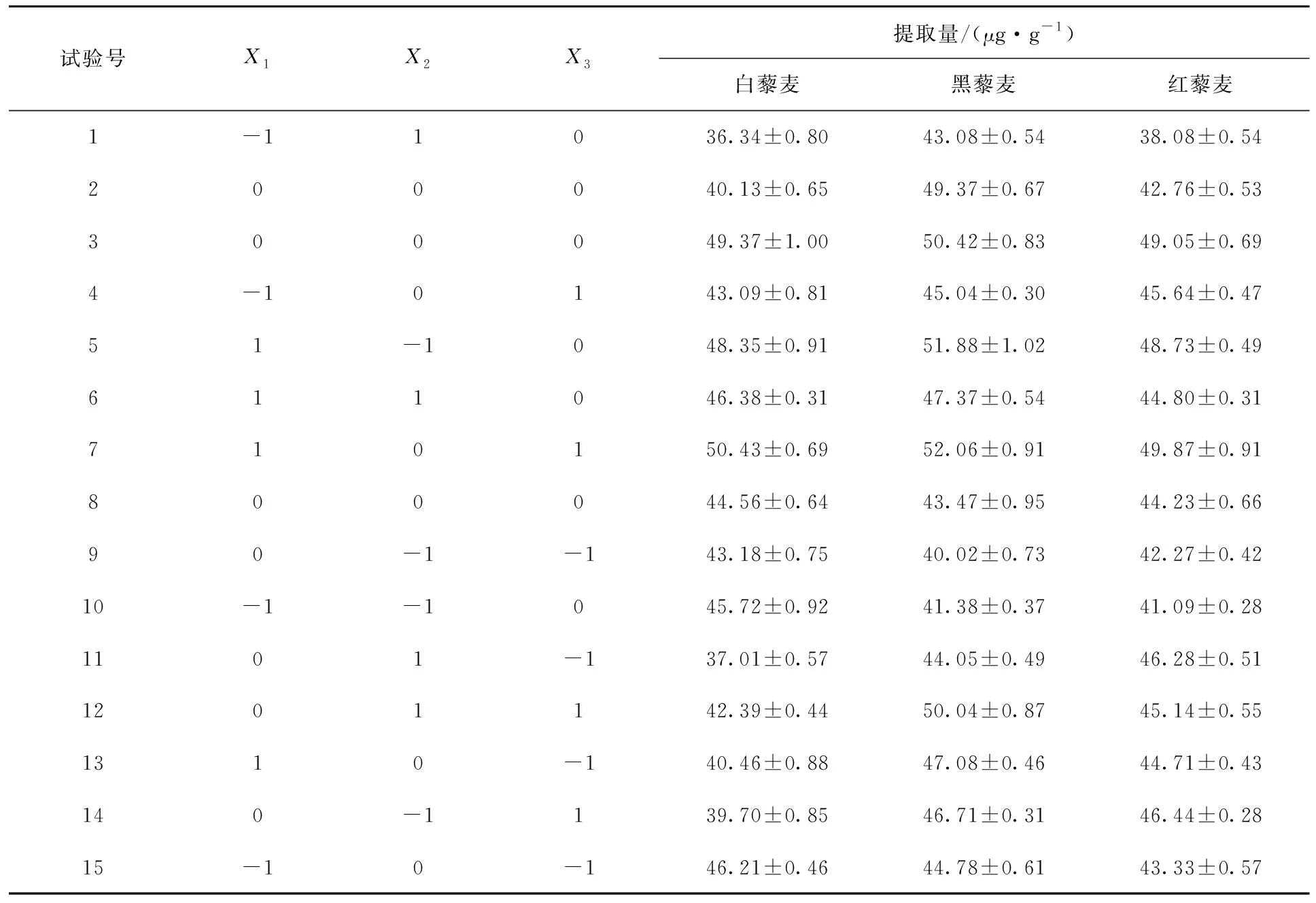
表2 响应面试验设计与结果Tab.2 Design and results of response surface test
白藜麦:YW=49.61-1.51X2+2.93X1X2-3.00X2X3-4.82X12-2.41X22-3.92X32
黑藜麦:YB=51.82+1.26X1-2.03X2+1.63X3-2.08X1X3-2.75X12-3.72X22-3.27X32
红藜麦:YR=49.73+1.76X1-1.05X2+1.51X2X3-3.98X12-3.06X22-1.71X32
由表3可知,不同粒色藜麦花青素提取拟合模型的P<0.01,表明建立的模型极显著。失拟项均不显著(P>0.05),方程拟合度高。模型R2为0.954 1~0.964 4,说明响应值的95.41%~96.44%来自所选变量。RAdj2为0.871 5~0.900 3,说明模型可解释87.15%~90.03%的响应值变化。C.V.值为2.50%~3.46%,表明试验受外界因素影响较小。根据一次项P值可知,各因素影响主次顺序具体为X2>X3>X1(白藜麦)、X2>X3>X1(黑藜麦)、X1>X2>X3(红藜麦)。

表3 二次模型方差分析Tab.3 Variance analysis of quadratic model
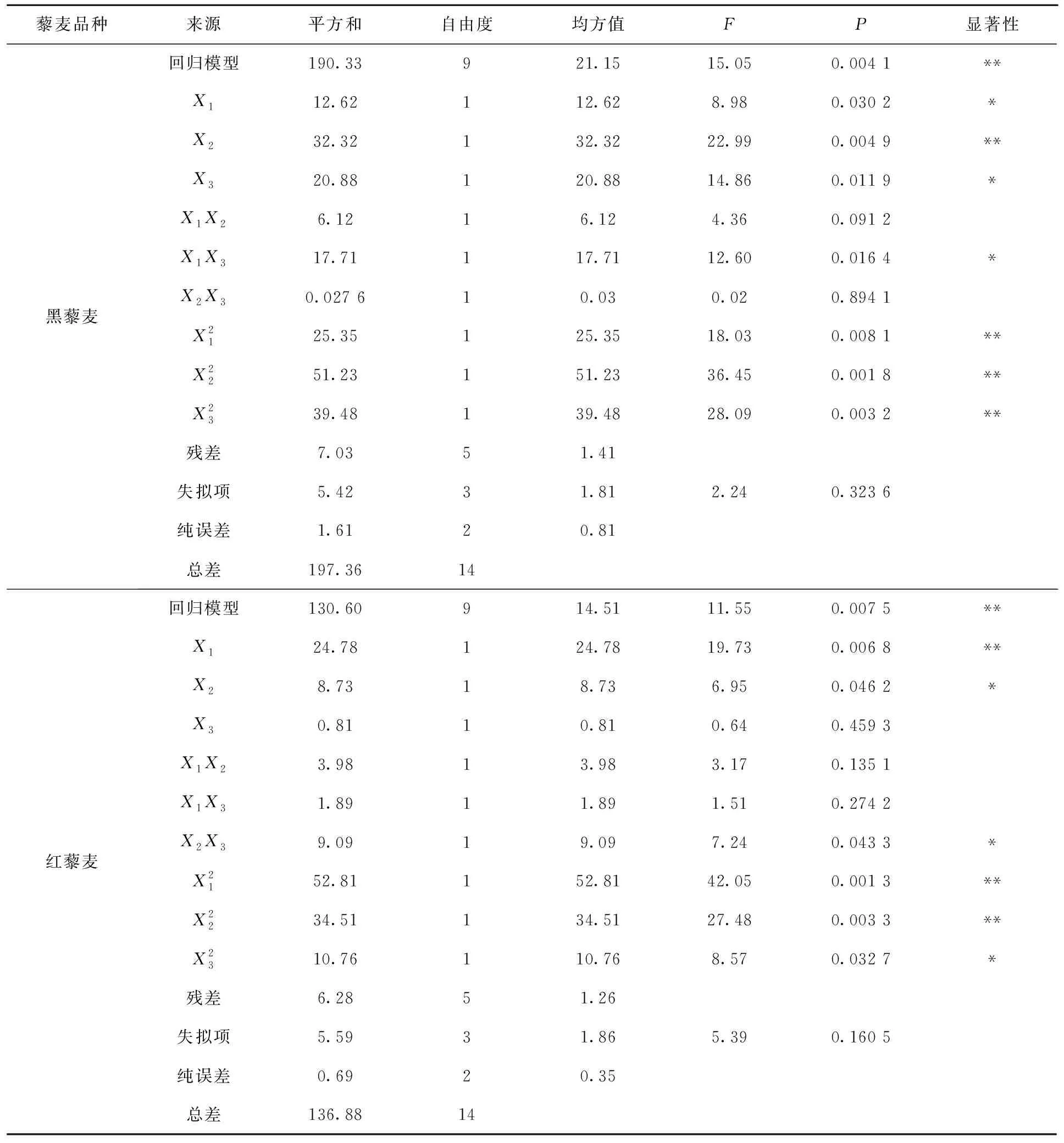
表3(续)
2.2.2 交互作用分析 由图3可知,藜麦花青素提取量随料液比、浸提温度和时间的增大先增大后减小,效应曲面均较陡。由图3A、图3B、图3C可知,温度对效应曲面的影响更明显,依次为浸提温度>浸提时间>料液比,与表3结果一致。由图3D、图3E、图3F浸提温度对效应曲面弯曲程度的影响最大,控制好浸提温度对黑藜麦花青素提取较为关键。从图3G、图3H、图3I看出,料液比对红藜麦花青素提取量的影响最大,表现为图3G和图3H曲面陡峭,图3C较为平缓,各因素影响顺序为料液比>浸提温度>浸提时间。此外,由图3A~图3I的等高线形状和密集度可知,白藜麦X1X2交互作用明显,X2X3次之;图E中椭圆明显,表明黑藜麦X1X3交互作用显著;红藜麦X2X3交互作用显著。
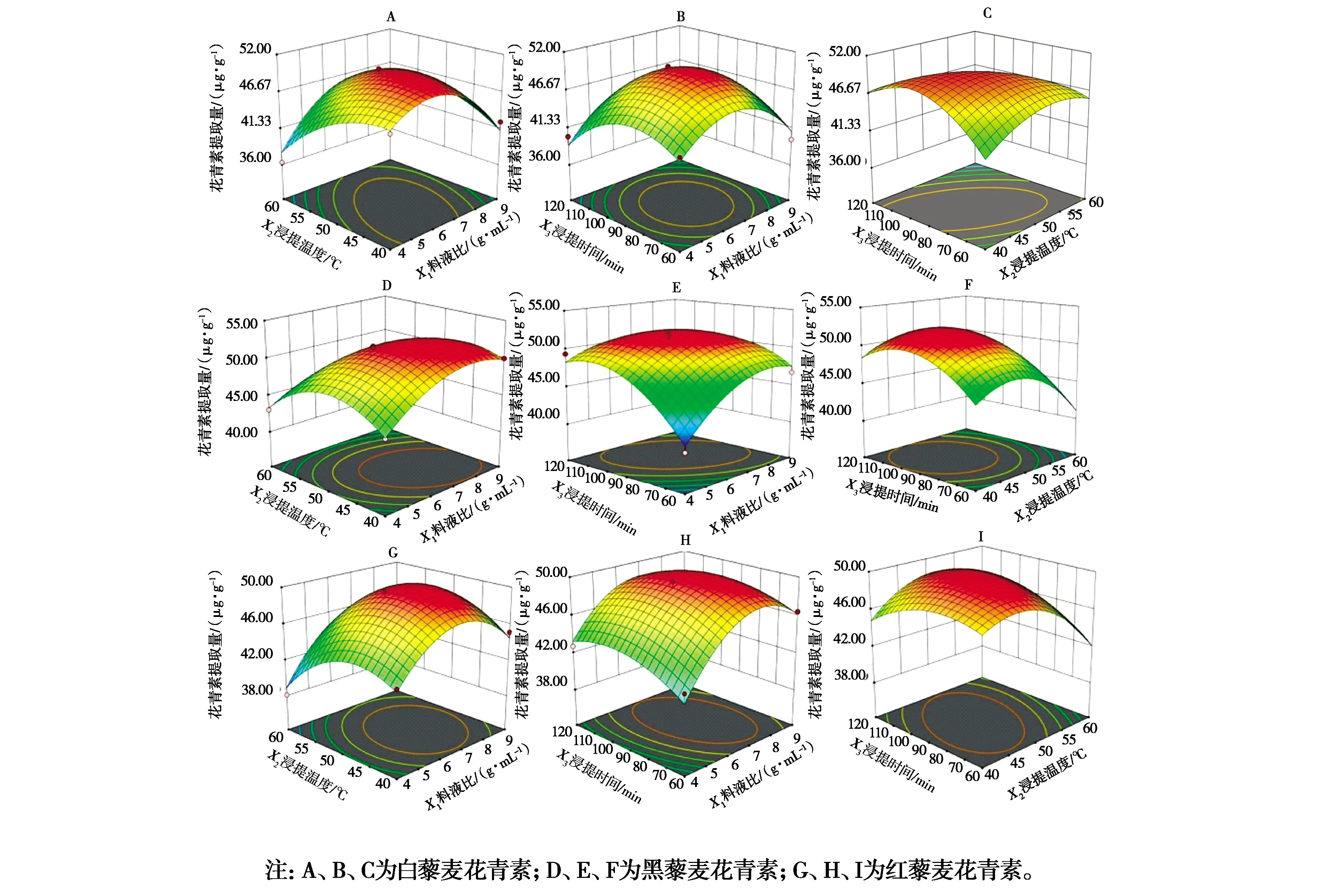
图3 各因素交互作用对三种粒色藜麦花青素提取量的影响Fig.3 Effects of interaction of various factors on anthocyanins extraction from three colors of Chenopodium quinoa Willd.
2.2.3 试验验证 由回归方程预测的白藜麦、黑藜麦、红藜麦花青素最佳提取参数分别为料液比6.25∶1、6.69∶1、7.11∶1 mL/g,浸提温度46.10、47.40、47.66 ℃,浸提时间90.78、98.92、86.29 min,预测提取量49.88、52.34、49.47 μg/g。为便于操作,将各参数修正为料液比6.3∶1、6.7∶1、7.0∶1 g/mL,浸提温度49.0、47.0、48.0 ℃,提取时间90、100、85 min,得到3种粒色藜麦花青素平均提取量为49.15、52.27、49.06 μg/g,与响应预测值基本接近,表明建立的模型可行。
2.3 红外光谱分析
由图4可知,藜麦花青素提取物的红外光谱特征峰基本一致,集中在800~500 cm-1指纹区和1 700~1 000 cm-1高频区。3 376 cm-1的强吸收由花青素分子中缔合态酚羟基产生,2 926 cm-1处为饱和—C—H的反对称伸缩,对应烷基—CH3,而2 855 cm-1处是饱和—C—H的对称伸缩,对应结构为—CH2;1 680~1 450 cm-1是芳香环的饱和骨架振动,1 728 cm-1的吸收峰由C=O 引起,1 300~1 000 cm-1属于醇、酚等C—O的伸缩振动,其中1 055 cm-1和1 236 cm-1可能是花青素分子中C—O—C的伸缩振动980~650 cm-1的吸收峰由O—H的面内外弯曲振动引起[10,13]。综上所述,藜麦花青素是具有醇羟基和酚羟基的芳环结构化合物。
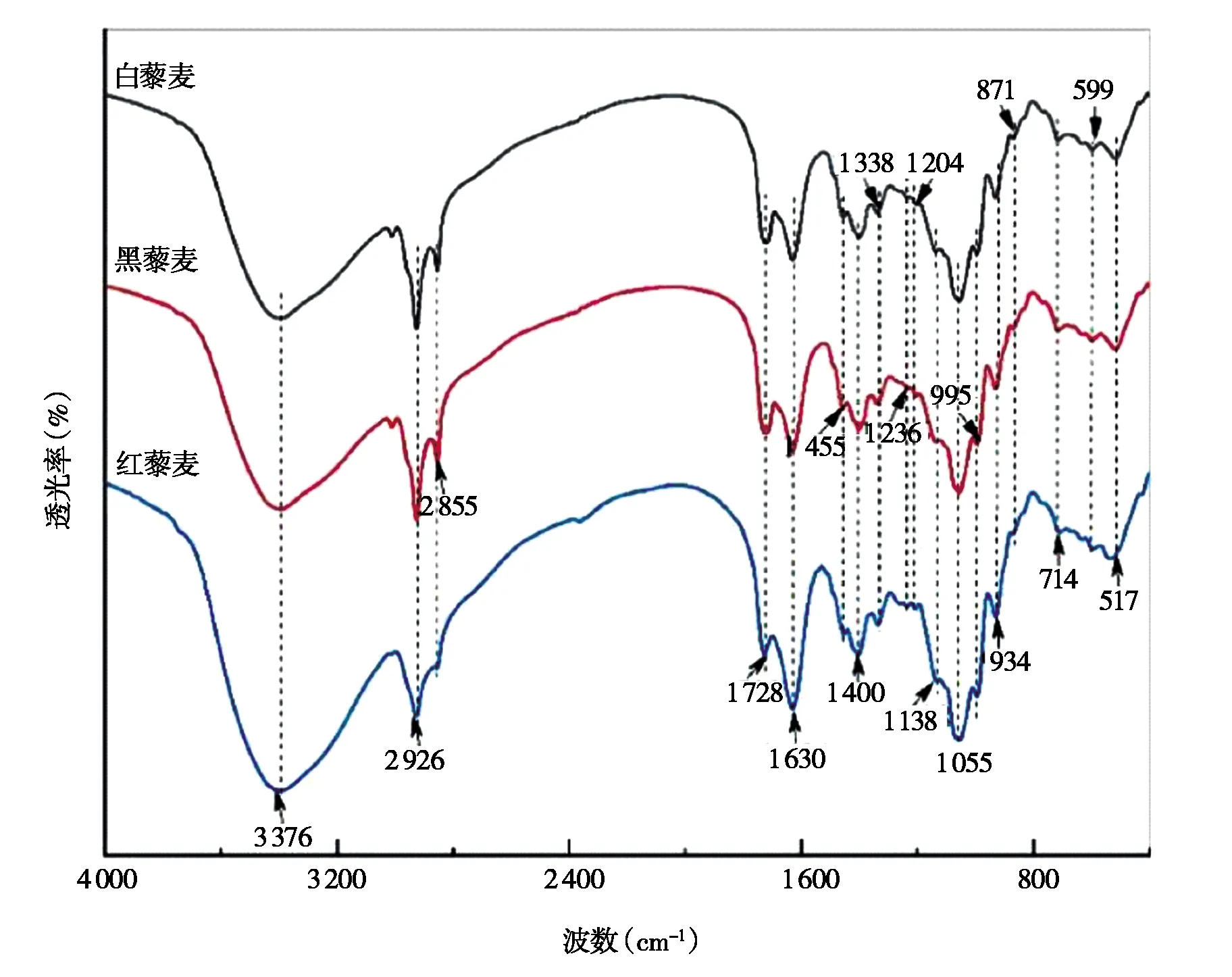
图4 藜麦花青素提取物的红外光谱图Fig.4 Infrared spectrogram of anthocyanins extract from Chenopodium quinoa Willd.
3 讨论与结论
研究藜麦花青素的提取可为藜麦资源的功能化开发与利用提供一定的理论依据,前人主要对藜麦中甜菜素类色素成分做了初步探究。Escribano等[14]发现4种甜菜黄素是橙黄色藜麦籽粒颜色形成的重要原因。Laqui-Vilca等[15]优化了藜麦壳中甜菜花青素和甜菜黄素的超声辅助提取工艺。除甜菜素外,花青素也是赋予籽粒颜色特征的关键成分,但目前有关藜麦花青素的提取和分析鲜有研究。因此,本文以青白藜1号(白藜麦)、青藜2号(黑藜麦)和贡扎4号(红藜麦)为试验材料,采用Box-Behnken设计和响应面分析探讨溶剂体系、提取参数等对藜麦花青素提取影响,并得到如下结论:
(1)三种不同粒色藜麦中,黑藜麦花青素更为丰富。影响白藜麦和黑藜麦花青素提取量的因素主次顺序为浸提温度、浸提时间和料液比,而影响红藜麦花青素提取量的因素主次顺序为料液比、浸提温度和浸提时间。
(2)优化得到的藜麦花青素提取条件为磷酸作酸化剂、70% pH 3.0的乙醇作溶剂、料液比6.3~7.0 g/mL、浸提温度47~49 ℃、浸提时间85~100 min,花青素提取量达到49.06~52.27 μg/g,与模型预测结果较为一致。

