禾谷镰刀菌胞外多糖诱导SGC-7901细胞凋亡作用及其机制研究
王姣姣,袁平川,许寒池,陈 颖,张斯佳,田梦云,余子琪,柳春燕*
1皖南医学院安徽省多糖药物工程技术研究中心 皖南医学院药学院药物研发中心;2活性生物大分子安徽省重点实验室;3安徽省皖南地区植物药活性筛选与再评价工程实验室,芜湖 241000
胃癌是全球第五大常见癌症和第三大癌症死亡原因[1],在进展期多采用化疗,常见化疗药物如顺铂和5-氟尿嘧啶等,然而化疗药物的耐药性和毒性导致患者生存率较低[2,3]。多糖作为天然高分子聚合物及其衍生物,空间结构复杂,生物活性多样[4]。许多研究表明,多糖在防止肿瘤发生和抑制肿瘤生长中具有良好的效果[5],其能够通过调控肿瘤细胞中多种信号转导途径和癌基因的表达,从而改变细胞膜流动性,抑制肿瘤侵袭和转移,以及诱导细胞发生凋亡和周期阻滞等[6-8]。
本课题组长期致力于从真菌发酵液中分离和发现具有抗肿瘤作用的活性多糖,在广泛的筛选中我们发现,从苹果链格孢菌发酵液中分离出的胞外多糖具有良好的抗肿瘤活性[9],这提醒我们植物病原菌可能是抗肿瘤活性多糖的一个重要来源。禾谷镰刀菌又名禾谷镰孢菌(Fusariumgraminearum),能够侵染小麦,致使病穗上出现粉红色或橘红色的霉状物,引发植物赤霉病[10,11]。本研究首次从禾谷镰刀菌发酵液中分离得到禾谷镰刀菌胞外多糖,经过体外筛选发现,FGEPS能够显著抑制人胃癌细胞SGC-7901的增殖。本文通过对禾谷镰刀菌胞外多糖体外抗胃癌SGC-7901作用及其机制的探究,为开发抗胃癌活性多糖药物提供实验基础。
1 材料和方法
1.1 主要仪器与材料
1.1.1 主要仪器
LC-20AP半制备高效液相色谱仪(日本Shimadzu);Epoch全波长酶标仪(美国BioTek);G3000pwxl型色谱柱(日本TOSOH BIOSCIENCE);CO2培养箱(美国SIM INTERNATIONAL GROUP);FACSVerse流式细胞仪(美国Becton,Dickinson and Company);BX53荧光正置显微镜,IX51荧光倒置显微镜(日本Olympus Corporation);WIX-miniPR02迷你垂直电泳槽,WIX-miniBLOT迷你转印槽,WIX-EP600通用电泳仪电源(伟克斯科技有限公司);Amersham Imager 600全自动化学发光凝胶成像分析系统(美国General Electric Company)。
1.1.2 主要试剂
RPMI 1640基础培养基(Cat.NO.:8121075,GIBCO公司);胎牛血清(Cat.NO.:S711-001S,LONSA SCIENCE SRL公司);CCK-8试剂盒(Cat.NO.:C0037)、Annexin V-FITC细胞凋亡检测试剂盒(Cat.NO.:C1062M)、Hoechst 33258染色试剂盒(Cat.NO.:C0003)、JC-1(Cat.NO.:C2006)、SDS-PAGE配胶试剂盒(Cat.NO.:P0012A)、SDS-PAGE蛋白上样缓冲液5×(Cat.NO.:P0015)、BCA试剂盒(Cat.NO.:P0009)、RIPA裂解液(Cat.NO.:P0013B)购自碧云天生物科技公司;彩色预染蛋白标准品(Cat.NO.:26616,Thermo Science公司);Bcl-2(Cat.NO.:A0208)、Bax(Cat.NO.:A7626)、Cleaved Caspase-3(Cat.NO.:A0214)、Cleaved Caspase-9(Cat.NO.:A2636)、ACTB(Cat.NO.:AC026)抗体购自ABclone Technology公司。
1.1.3 实验细胞与菌种
人胃癌细胞SGC-7901(Cat.NO.:C6795)、BGC-823(Cat.NO.:C6123)和MGC-803(Cat.NO.:C6582)购自碧云天生物技术有限公司,已在原公司完成细胞STR鉴定;禾谷镰刀菌菌种来自于山东省农业科学院植物保护研究所齐军山研究员馈赠,细胞及菌种现保存于安徽省多糖药物工程技术研究中心。
1.2 实验方法
1.2.1 禾谷镰刀菌的培养和发酵
PDA培养基配制[12]:200 g马铃薯切碎并加水煮沸30 min,纱布过滤后加入17 g琼脂并加热溶解,继续加入15 g葡萄糖后补水至1 L,分装后高压蒸汽灭菌。液体培养基配制[13]:葡萄糖10 g,酵母膏2 g,0.5 g KH2PO4,0.5 g MgSO4·7H2O,0.25 g CaCl2,加纯水定容至1 L。300 mL锥形瓶分装,每瓶200 mL,灭菌备用。菌种使用PDA平面培养基在28 ℃恒温培养,并活化3~5天,在菌丝长势良好但未产生孢子前,挑取边缘菌丝接入液体培养基中,在28 ℃、150 r/min的条件下恒温发酵培养7天[14,15]。
1.2.2 FGEPS的制备
发酵液过滤去除菌丝体,60 ℃减压浓缩,加入四倍体积95%乙醇混匀,4 ℃下静置12 h。离心保留沉淀并加入超纯水在60 ℃加热溶解,再次离心后保留上清。D101大孔树脂脱色[16],蒽酮硫酸法检测并收集洗脱液,进一步使用Sevage试剂法[17](V三氯甲烷∶V正丁醇=4∶1,V多糖溶液∶VSevage试剂= 4∶1)对多糖溶液进行脱蛋白。0.22 μm滤膜过滤除菌后,使用再生纤维素透析袋(截留分子量3 500 Da)于4 ℃下透析72 h,收集截留液冷冻干燥得到胞外多糖FGEPS。
1.2.3 红外和紫外光谱扫描
FGEPS使用KBr压片,并于傅里叶红外光谱仪在4 000~400 cm-1范围进行扫描[18]。精密称取FGEPS使用超纯水配制成5 mg/mL溶液,使用紫外可见分光光度计在190~400 nm波长范围进行扫描。
1.2.4 高效凝胶渗透色谱
采用高效尺寸排阻色谱法测定分析FGEPS,色谱条件:RID-10A示差折光检测器,G3000pwxl型色谱柱(内径×长度:7.8 mm × 30 cm,东曹株式会社),柱温40 ℃,流速0.7 mL/min,流动相为超纯水,定量环20 μL,样品浓度5 mg/mL。
1.2.5 细胞培养及CCK-8测定细胞增殖抑制
人胃癌细胞系SGC-7901、BGC-823和MGC-803细胞株使用1640完全培养基(含10%胎牛血清和1%双抗的1640基础培养基)培养,在5%的CO2、37 ℃条件下恒温培养,细胞处于对数生长期时可用于实验。
取对数期SGC-7901细胞,培养于96孔细胞培养板内。每孔加入100 μL细胞悬液(5×104个/mL),培养箱中孵育12 h待细胞贴壁后,每孔分别加入100 μL含有不同浓度FGEPS的完全培养基,使其终浓度为0、0.4、0.8、1.2、1.6、2.0 mg/mL(每组设5个复孔),继续培养24 h。采用CCK-8试剂盒进行细胞增殖检测。BGC-823和MGC-803细胞的培养、给药处理及增殖抑制测定的方法同上。

式中,A对照组:不含药物组的吸光度;A给药组:加入各浓度FGEPS处理组的吸光度。
1.2.6 细胞形态分析
取对数期SGC-7901细胞,六孔板每孔加入1 mL细胞悬液(3×105个/mL),吹打分散均匀。贴壁后弃去培养基并以PBS润洗后,加入1 mL含FGEPS完全培养基(0、0.5、1.0、1.5 mg/mL),处理24 h后,使用倒置显微镜观察并拍照。
1.2.7 Hoechst 33258染色
取对数生长期SGC-7901细胞,调整细胞密度至1.5×105个/mL。在6孔板中放置细胞爬片盖玻片,每片上加入细胞悬液200 μL继续培养。细胞贴壁后在细胞密度为50%~80%时,弃去培养基并加入含FGEPS(0、0.5、1.0、1.5 mg/mL)完全培养基。处理24 h后,弃去培养液,加入0.5 mL固定液在4 ℃下固定12 h。弃去固定液后,PBS清洗两遍。加入0.5 mL的Hoechst 33258染色液,染色5 min。PBS清洗两遍,抗荧光淬灭封片液封片,使用正置荧光显微镜观察并拍照。
1.2.8 AnnexinV-FITC/PI染色
取对数生长期SGC-7901细胞,六孔板每孔加入1 mL细胞悬液(3×105个/mL)。贴壁后弃去培养基并以PBS润洗,分别加入1 mL含FGEPS的完全培养基(0、0.5、1.0、1.5 mg/mL)。处理24 h后消化、离心收集细胞。结合液重悬分散细胞后,各组依次加入5 μL的AnnexinV-FITC荧光探针和10 μL的PI染液,混匀后在20~25 ℃下避光孵育20 min。流式细胞仪检测,Flowjo软件分析。
1.2.9 JC-1染色
取对数生长期SGC-7901细胞,调整细胞密度至3×105个/mL。在6孔板中放置盖玻片,每孔加入细胞悬液1 mL继续培养。细胞贴壁后在细胞密度为50%~80%时,弃去培养基并加入含FGEPS完全培养基(0、0.5、1.0、1.5 mg/mL)。处理24 h后,弃去培养液,PBS洗涤后加入1 mL胰酶消化液(不含EDTA)消化细胞,待消化结束后移除胰酶消化液,加入新的培养液,吹打后慢速离心收集细胞,0.5 mL培养液重悬后加入0.5 mL JC-1染色工作液,轻弹混匀,37 ℃孵育20 min。孵育结束后用预冷的JC-1染色缓冲液(1×)洗涤2次并重悬,使用流式细胞仪分析。
1.2.10 Western blot
取对数期SGC-7901细胞,培养于6孔板中。每孔加入1 mL细胞悬液(5×105个/mL)。贴壁后,弃去培养基并以PBS润洗,分别加入1 mL含FGEPS的完全培养基(0、0.5、1.0、1.5 mg/mL)继续培养24 h。弃去培养基冰上裂解后,4 ℃下以12 000 g离心10 min,提取细胞总蛋白。BCA法调整各组样品蛋白浓度后,按体积比4∶1将样品蛋白与上样缓冲液5×混合后,煮沸变性。实验组每孔上样蛋白20 μg,体积10 μL,进行电泳、转膜、封闭,一抗孵育(1∶1 000稀释)和二抗(1∶10 000稀释)孵育,使用化学发光显影曝光,Image J软件分析。
1.2.11 统计学分析
所有数据均采用均数±标准差进行统计和描述,使用SPSS 13.0软件进行分析,多组均数的比较,使用单因素方差分析,两组间差异采用Dunnett-t检验,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 多糖提取及分离
如图1所示,禾谷镰刀菌菌种活化后长势良好,挑取边缘菌丝接种到共8 L液体培养基中,发酵7天后收集发酵液,经过醇沉、脱色、脱蛋白、透析和冻干后,得到禾谷镰刀菌胞外多糖670 mg,多糖得率为83.75 mg/L。

图1 禾谷镰刀菌胞外多糖的制备Fig.1 Preparation of FGEPS
2.2 IR、UV光谱分析
图2A为FGEPS的红外光谱。3 600~3 200 cm-1处的吸收带是-OH的伸缩振动吸收峰,此区域的吸收峰为糖类的特征吸收峰。3 377 cm-1为O-H的伸缩振动吸收峰,是糖类的特征峰;2 929 cm-1处的吸收峰是多糖的C-H伸缩振动;1 649 cm-1处的吸收峰为结晶水引起;1 539 cm-1处的吸收峰为C=O的伸缩振动峰;1 415 cm-1处的吸收峰是C-O的伸缩振动峰;1 030 cm-1处的吸收峰为O-H的变角振动引起。红外光谱表明通过方法“1.2.2”制备最终得到的成分是多糖。如图2B所示,FGEPS在260~280 nm内无紫外吸收,表明该多糖中不含有多肽及核酸类物质。

图2 FGEPS的红外和紫外光谱Fig.2 Infrared and ultraviolet spectra of FGEPS
2.3 HPGPC分析
脱色脱蛋白及透析处理后的禾谷镰刀菌胞外多糖,经HPGPC分析显示共有四个组分,结合红外光谱表明该物质是多糖成分,紫外扫描显示不含有多肽核酸类物质,经透析去除3 500 Da分子量以下的物质,因此该色谱图出峰均为多糖物质引起。如图3所示,HPGPC表明FGEPS含有四个组分。1号峰保留时间(retention time,tR)为8.207 min,峰面积占比75.99%;2号峰tR=9.637 min,峰面积占比17.86 %;3号峰tR=10.079 min,峰面积占比3.45 %、4号峰tR=10.212 min,峰面积占比2.70 %。从保留时间来看,1号峰保留时间最短,组分相对分子量最大。结合各组分含量占比分析,FGEPS发挥生物学活性的成分可能主要是1号峰所在的组分。
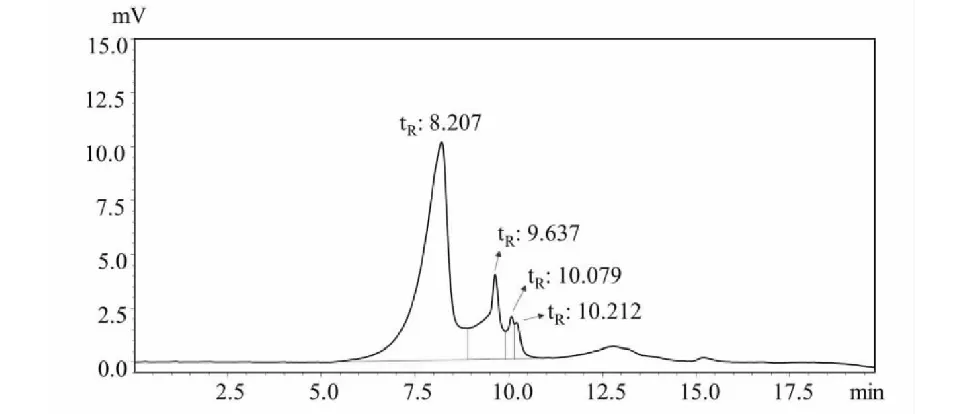
图3 FGEPS的高效凝胶渗透色谱Fig.3 High performance gel permeation chromatography of FGEPS
2.4 细胞增殖
如图4所示,使用不同浓度的FGEPS分别处理人胃癌SGC-7901、BGC-823和MGC-803细胞24 h后,相比对照组,FGEPS在浓度为0.8 mg/mL之后,能够显著抑制三种胃癌细胞的增殖(P< 0.05或P< 0.01),在2 mg/mL时对SGC-7901、BGC-823和MGC-803细胞的抑制率分别为(43.86 ± 8.57)%、(36.21 ± 2.52)%和(33.45 ± 2.18)%。由图4知FGEPS对三种人胃癌细胞的增殖均有抑制作用,而对SGC-7901细胞的抑制效果最显著,且具有浓度依赖性,后续实验选择SGC-7901细胞为研究对象。

图4 FGEPS对SGC-7901、BGC-823和MGC-803细胞增殖的影响Fig.4 Effect of FGEPS on proliferation of SGC-7901,BGC-823 注:与SGC-7901对照组比较,*P<0.05,**P<0.01;与BGC-823对照组比较,#P<0.05,##P<0.01;与MGC-803对照组比较,△P<0.05,△△P<0.01。Note:Compared with SGC-7901 control group,*P<0.05,**P<0.01;Compared with BGC-823 control group,#P<0.05,##P<0.01;Compared with MGC-803 control group,△P<0.05,△△P<0.01.
2.5 细胞形态
如图5可见,正常组细胞形态清晰,数量较多。给予FGEPS处理后,细胞均呈现皱缩、变形,细胞膜出现发泡现象,甚至出现死细胞。1.5 mg/mL的FGEPS处理组,细胞由于凋亡使得活细胞数量明显减少,细胞严重收缩变形。结果表明,FGEPS可导致SGC-7901细胞收缩变形、细胞膜发泡。
2.6 Hoechst 33258染色
细胞染色质经过Hoechst 33258染色后,在荧光显微镜下正常细胞的细胞核为蓝色,而凋亡细胞由于染色质固缩呈现致密浓染,颜色发白并较为明亮。如图6所示,随着给药剂量的增加,细胞凋亡现象加重,出现较多的凋亡小体。此外在1.5 mg/mL时,细胞数量减少,细胞核明显缩小。
2.7 Annexin V-FITC双染
细胞凋亡早期时磷脂酰丝氨酸外翻,能够被Annexin V-FITC结合。而坏死细胞或凋亡晚期丧失细胞膜完整性后的细胞核能够被碘化丙啶(propidium iodide,PI)结合。如图7所示,随着FGEPS剂量的增大,SGC-7901细胞凋亡率显著增加,对比对照组,1.0 mg/mL时凋亡率为(12.18 ± 2.16)%(P<0.01),1.5 mg/mL时,凋亡率为(15.69 ± 0.51)%(P<0.001)。结果表明,FGEPS能够诱导SGC-7901细胞发生凋亡,并伴有浓度依赖性。
2.8 JC-1染色
线粒体膜电位(ΔΨm)的下降是细胞凋亡的标志之一,JC-1是一种良好的荧光探针,当膜电位较高时,JC-1聚合于基质中产生红色荧光;而当膜电位较低时,JC-1以单体形式存在,发出绿色荧光。如图8所示,随着FGEPS剂量的增大,SGC-7901细胞线粒体膜电位水平显著降低,与对照组相比,1.0 mg/mL时的线粒体膜电位水平为(10.73±1.16)%(P<0.05),给药浓度为1.5 mg/mL时,膜电位水平为(12.1±1.83)%(P<0.01)。结果表明,FGEPS能够显著降低SGC-7901细胞线粒体膜电位水平,并伴有浓度依赖性。

图5 FGEPS对SGC-7901细胞形态的影响(×200)Fig.5 Effect of FGEPS on the morphology of SGC-7901 cells

图6 FGEPS对SGC-7901细胞染色质的影响(×400)Fig.6 Effect of FGEPS on chromatin of SGC-7901 cells
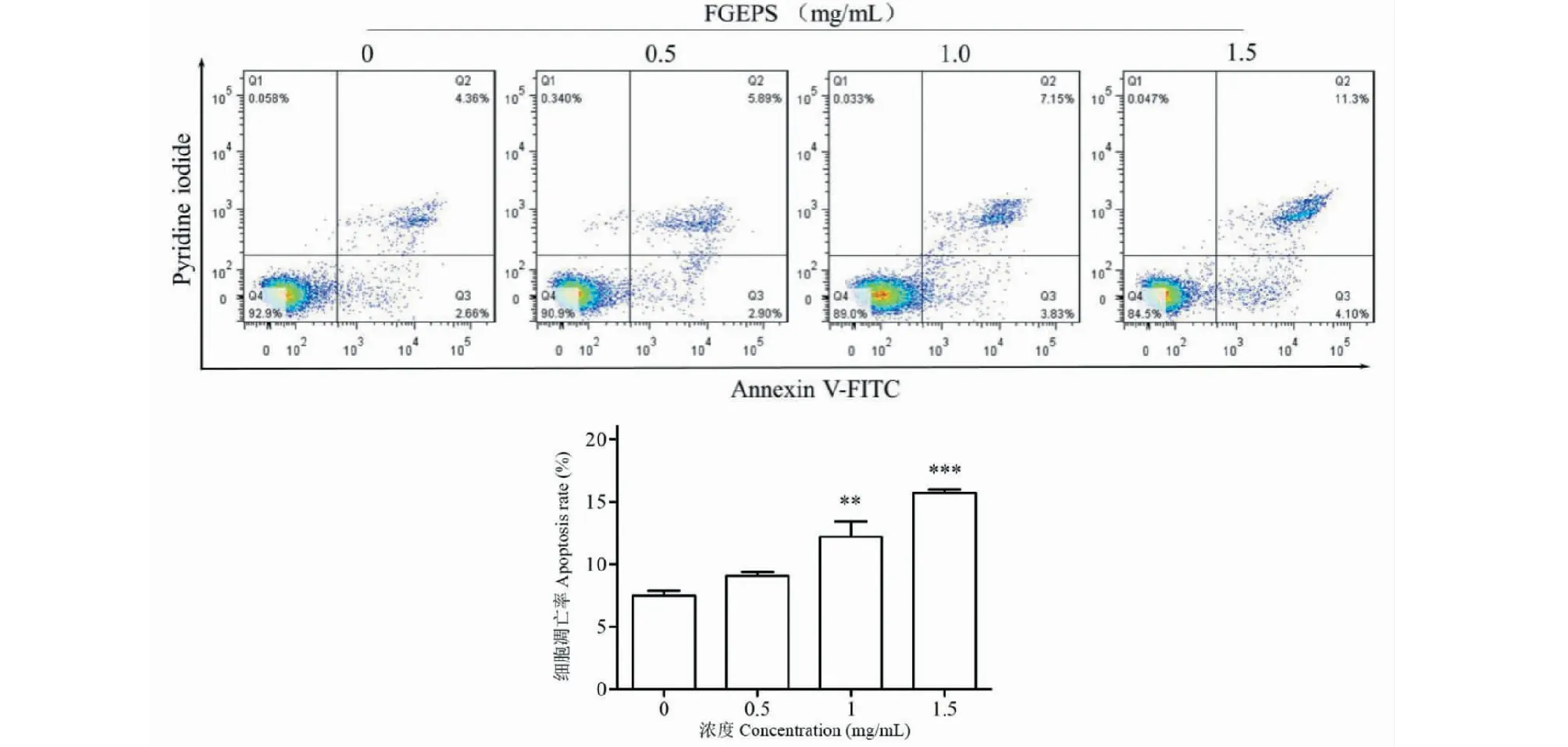
图7 FGEPS对SGC-7901细胞凋亡的影响Fig.7 Effect of FGEPS on apoptosis of SGC-7901 注:与对照组比较,**P<0.01,***P<0.001。Note:Compared with control group,**P<0.01,***P<0.001.
2.9 Western blot
如图9所示,对比空白组,FGEPS能够显著上调SGC-7901细胞中促凋亡蛋白Bax、Cleaved Caspase-3和Cleaved Caspase-9表达(P<0.01或P<0.001),并下调抑凋亡蛋白Bcl-2表达(P<0.001),表明线粒体介导的凋亡途径在FGEPS诱导胃癌SGC-7901细胞凋亡过程中发挥着重要作用。
3 讨论与结论
天然产物一直是医药开发的宝库,在疾病治疗中发挥着巨大作用,就抗肿瘤而言,如紫杉醇、喜树碱、鬼臼毒素、长春碱等,这些天然药物不仅具有应用效果,同时也为新化合物的合成提供了思路和参考[19-21]。真菌发酵过程中次级代谢产物是活性多糖的重要来源,从黑根霉发酵液中分离得到的胞外多糖EPS,通过激活小鼠结肠癌CT26细胞中的AMP活化蛋白激酶(AMPK)途径,以剂量和时间依赖性的方式抑制细胞生长并促进细胞凋亡[22];拟康氏木霉胞外多糖以剂量依赖性方式增加Caspase-9和Caspase-3的活性,增加Bax/Bcl-2的比例,促进细胞色素C(Cyt-C)向细胞质释放,通过固有线粒体凋亡途径诱导MCF-7细胞凋亡[23];苹果链格孢菌胞外多糖能够增加胃癌BGC-823细胞的活性氧水平,降低线粒体膜电位并形成凋亡小体[9]。本研究中能够有效抑制人胃癌细胞SGC-7901增殖的FGEPS正是从禾谷镰刀菌发酵液中分离得到,CCK-8实验表明FGEPS能够有效抑制人胃癌SGC-7901细胞的增殖,细胞形态学结果表明FGEPS能够引起SGC-7901细胞收缩变形、胞膜发泡,甚至形成凋亡小体,而这些现象正是细胞凋亡的表现。AnexinV-FITC/PI双染、Hoechst 33258染色及JC-1的染色结果表明FGEPS可诱导SGC-7901细胞发生凋亡,并可能与线粒体介导的途径有关。由于细胞凋亡是由基因控制的细胞自身程序性死亡,涉及一系列基因的调控[24],因此根据相关结果,我们研究了线粒体途径在FGEPS诱导SGC-7901细胞凋亡中的作用。

图8 FGEPS对SGC-7901细胞线粒体膜电位的影响Fig.8 Effect of FGEPS on mitochondrial membrane potential of SGC-7901 注:与对照组比较,*P<0.05,**P<0.01。Note:Compared with control group,*P<0.05,**P<0.01.

图9 FGEPS对SGC-7901细胞Bax、Bcl-2、Cleaved Caspase-3及Cleaved Caspase-9蛋白表达的影响Fig.9 Effect of FGEPS on the expression of Bax,Bcl-2,Cleaved Caspase-3 and Cleaved Caspase-9 proteins in SGC-7901 注:与对照组比较,**P<0.01,***P<0.001。Note:Compared with control group,**P<0.01,***P<0.001.
通过对引起凋亡作用机制的探讨,我们发现FGEPS能够显著上调促凋亡蛋白Bax、Cleaved Caspase-3、Cleaved Caspase-9表达,并下调抑凋亡蛋白Bcl-2蛋白表达,这显示线粒体途径介导的细胞凋亡与FGEPS发挥抗人胃癌SGC-7901作用关系密切。线粒体介导的细胞凋亡主要是指在凋亡信号的刺激下,抑凋亡蛋白Bcl-2和凋亡蛋白家族中Bax比率失衡,Bax的过表达引起线粒体膜通透性增加,释放出Cyt-C等因子,在与凋亡蛋白酶活化因子结合后,能够激活凋亡蛋白酶Caspase-9,促使半胱天冬氨酸与其结合,从而形成凋亡小体。Caspase是一组庞大的凋亡蛋白酶家族,能够通过线粒体途径被激活,而活化的Caspase还能够引起线粒体释放出更多的Cyt-C,该家族“瀑布式”的激活链将最终引起细胞走向凋亡。Caspase-9处于“瀑布式”激活链的顶端,被激活后的Caspase-9将引起下游Caspase-3等效应分子的活化,引发Caspase级联反应,导致细胞核染色质固缩、裂解以及和胞体分离形成凋亡小体等[25-27]。本研究发现FGEPS能够诱导SGC-7901细胞凋亡,且线粒体介导的细胞凋亡途径在FGEPS诱导胃癌SGC-7901细胞凋亡过程中具有重要作用。多糖作为天然高分子物质,不只是结构、能量物质的基本成分,更是参与机体调控、应答的关键分子[28-30]。随着糖生物学的发展,多糖因为具有良好的抗肿瘤活性而成为抗肿瘤药物的研究热点。
综上所述,本研究首次从禾谷镰刀菌中分离出胞外多糖FGEPS,其对SGC-7901、BGC-823和MGC-803均有增殖抑制效果,且对SGC-7901抑制效果最为显著,并能通过线粒体通路诱导SGC-7901细胞发生凋亡。实验为进一步探讨FGEPS抗胃癌作用的研究提供依据,为开发多糖类胃癌辅助治疗药物提供实验基础。

