超声引导下经皮微波消融治疗良性囊实性甲状腺结节疗效的影响因素分析
刘红艳, 许永强, 李小龙, 孙丽萍,
(1. 蚌埠市第一人民医院超声医学科,安徽 蚌埠 233000; 2. 同济大学附属第十人民医院超声医学科,上海 200072)
甲状腺结节是临床常见疾病,随着高频超声检查技术的广泛应用,甲状腺结节检出率逐年升高,达到19%~67%[1],约15%~25%的孤立性甲状腺结节为囊性或以囊性为主,且多数为良性。结节出血和先前存在的结节随后的变性被认为是大多数囊性病变的常见原因。根据美国甲状腺协会的指南[2],囊性结节被认为恶性肿瘤风险较低,其中,单纯囊肿的恶性风险<1%;部分囊性结节无钙化、无纵横比大于1等可疑恶性特征的恶性风险<3%;部分囊性结节伴偏心实性区的恶性风险为5%~10%。然而,良性囊实性甲状腺结节在某些情况下仍需要治疗,如结节快速生长、美观障碍或局部产生压迫症状(颈痛、吞咽困难和咳嗽),或患者心理负担过重[3-4]。目前手术是良性囊实性甲状腺结节的首选治疗方法。然而,手术有一定的缺点,如创伤大、瘢痕、诱发医源性甲状腺功能减退风险等[5]。近年来,内镜甲状腺手术、化学消融、热消融及其他治疗方法一直备受推崇[6]。其中,超声引导下的热消融在临床治疗良性甲状腺结节已被许多指南和共识推荐[7-8]。热消融是一种有效的手术治疗方法,具有很高的技术可行性,临床成功率高,并发症发生率低[9]。临床广泛应用的热消融技术主要包括激光消融治疗[10]、射频消融[11]、微波消融和高强度聚焦超声[12]。其中,微波消融具有较高的加热速度,可以更快速地灭活病灶组织,而原位灭活的坏死组织在消融治疗后被逐渐吸收,从而达到治疗的目的[1]。临床实践表明,病变吸收的程度及速度因个体而异,明确影响治疗效果的相关因素可以帮助医生及患者提前预测治疗效果,也可为优选微波消融治疗提供依据。本研究应用微波消融技术治疗一组良性囊实性甲状腺结节并对其疗效进行评估,旨在探讨影响微波消融治疗效果的相关因素。
1 资料与方法
1.1 一般资料
纳入2020年1月至2021年6月在同济大学附属第十人民医院与蚌埠市第一人民医院行超声引导下经皮微波消融治疗的良性囊实性甲状腺结节患者160例(160个结节),其中男35例,女125例,年龄25~75岁,平均年龄(49.13±13.06)岁。纳入标准:① 微波消融术前2次细针穿刺活检提示结节为良性的患者;② 患者自觉有压迫感、异物感或颈部不适;③ 因对疾病的焦虑或对结节的恶性改变的担心而主动要求微波消融治疗的患者;④ 拒绝传统外科手术或不能耐受传统外科手术的患者。排除标准:① 既往有甲状腺结节治疗史;② 同时行微波消融治疗和聚桂醇硬化治疗;③ 严重心、肺疾病及凝血功能障碍。
1.2 仪器设备
超声诊断仪:Logiq E9超声诊断仪(GE Medical Systems, 美国)和西门子Acuson S2000(Siemens Medical Solutions, 美国)。Logiq E9超声诊断仪配备高频线阵探头ML6-15,中心频率12 MHz,范围6~15 MHz;西门子Acuson S2000配备高频线阵探头9L4,中心频率7 MHz,范围2~8 MHz。对比剂:声诺维(意大利博莱科公司产品),配制时加入0.9%生理盐水5 mL制成混悬液,每次用量分别为2.4 mL(Logiq E9超声仪)和2 mL(西门子Acuson S2000)。
微波消融仪器:MTI医用微波治疗仪系统为中国百德医疗集团研制。微波消融额定频率为2 450 MHz(±10%),输出功率为0~120 W。甲状腺微波消融选用的针头端有一个绝缘体,绝缘体和针尖在超声图像下显示为一个强回声点,用于在消融治疗时准确判断进针位置和深度。采用的微波消融针型号为XR-A1410W(17 G)或XR-A1610W(16 G),针管直径为1.4 mm或1.6 mm,长度均为100 mm,针头为3 mm,输出功率25~35 W。辐射极消融范围为11.1 mm×6.0 mm×0.9 mm至13.7 mm×7.4 mm×1.0 mm,长短半径比例为5 ∶4。根据病灶的大小及位置选择合适的针型。消融针内置水循环冷却系统和测温装置,可防止消融组织碳化和配合主机报警保护装置,使消融针杆维持在37°以下;水循环冷却系统(常温生理盐水)一般为3个转子,流率为40 mL/min。
1.3 微波消融步骤
1.3.1 术前评估 ① 术前行血液常规检查、凝血功能检查及甲状腺功能检查排除手术禁忌;② 应用超声综合评价结节灰阶超声特征及彩色多普勒血流显像(CDFI);③ 测量结节大小,并计算结节体积(V),V=上下径(a)×左右径(b)×前后径(c)×π/6。
1.3.2 消融方法 患者取仰卧位,颈部过伸,予以心电监护,实时监测血压、心率、血氧饱和度。超声引导下,2%利多卡因局部浸润麻醉于皮下穿刺点至甲状腺包膜之间,在甲状腺包膜与颈总动脉、气管、食管之间注射0.9%生理盐水20~40 mL,形成“液体隔离带”,防止热损伤。微波消融仪器的输出功率设置为30 W,提前将囊液抽干,对实性部分及囊壁采用多点移动式消融。结节消融成功需要同时满足:① 目标结节完全被高回声覆盖;② CDFI提示结节内无血流信号;③ 超声造影提示结节呈无增强。如结节有残余的增强区,则需进一步补充消融。所有手术均由具有10年以上热消融经验的2位医生完成。术后穿刺点贴一次性敷贴,并局部加压冷敷。4 h后予以复查,观察有无声音嘶哑、局部血肿以及其他异常。
1.3.3 微波消融术后随访 记录术中并发症情况。于术后6个月行甲状腺超声检查及甲状腺功能检查,记录术后各随访时间点结节体积及不良反应。结节体积缩小率(volume reduction rate, VRR)=(术前体积-随访体积)/术前体积×100%。根据文献报道[13-14],VRR≥50%为显著有效。
1.4 统计学分析
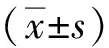
2 结果
2.1 基本资料
根据VRR分组,≥50%为显著有效组(122例),<50%为非显著有效组(38例),平均年龄分别为(49.55±12.76)岁和(47.76±14.77)岁,两组年龄无统计学差异(t=0.558,P=0.58)。两组结节术前平均体积分别为(6.02±7.15)mL和(3.61±2.89)mL,差异无统计学意义(t=-1.931,P=0.26)。显著有效组中,VRR≥90%为41例(25.63%),VRR=100%为6例(3.75%)。
2.2 两组患者一般资料及甲状腺结节常规超声特征比较
单因素分析结果显示,显著有效组和非显著有效组在性别、年龄、体重指数,结节最大径、形态、血流、边缘、纵横比方面差异均无统计学意义(P均>0.05),两组间结节靠近危险三角、结节囊性比例<50%及结节伴钙化的差异有统计学意义(P均<0.05),见表1。所有患者术中及术后均未发现颈动脉、喉返神经、气管、食管等损伤,甲状腺功能指标均在正常范围内波动。其中,10例(6.25%,10/160)患者术中及术后颈痛明显,并放射至面部、耳后、牙根、肩部,未予治疗,术后48 h内均自行缓解。
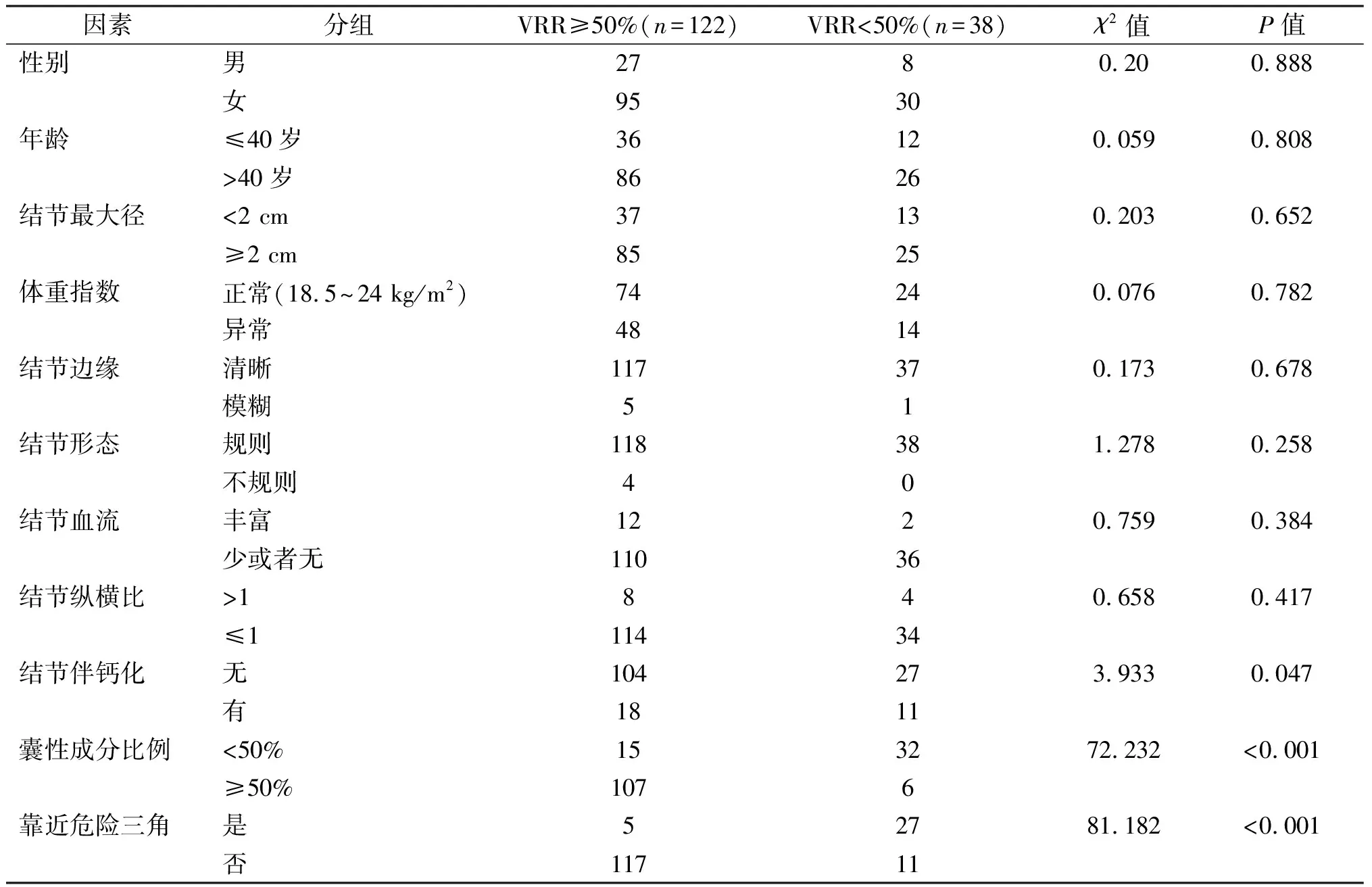
表1 两组患者一般资料及甲状腺结节常规超声特征比较 例
2.3 微波消融治疗效果的影响因素及预测模型建立
根据单因素分析结果,纳入结节靠近危险三角、结节伴钙化和囊性成分比例<50%进行Logistic回归分析。结果表明,结节靠近危险三角(OR=26.076,95%CI: 6.983~97.424,P<0.001)和结节囊性比例<50%(OR=18.690,95%CI: 5.412~64.605,P<0.001)是预测VRR<50%的独立影响因素(表2)。结节未靠近危险三角且结节囊性比例≥50%时,6个月随访时VRR≥50%的典型超声图像见图1;结节靠近危险三角且结节囊性比例<50%时,6个月随访时VRR<50%典型超声图像见图2。

表2 甲状腺良性囊实性结节微波消融治疗效果影响因素的Logistic回归分析
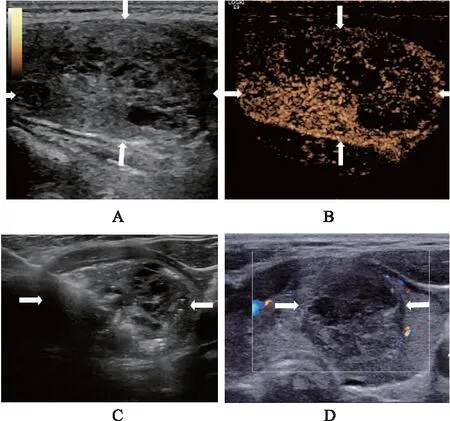
A:术前结节大小为2.6 cm×1.1 cm×1.8 cm,结节体积为2.69 mL;B:术前超声造影显示病灶区无增强部分大于50%;C:微波消融术中;D:消融术后6个月,结节大小为1.6 cm×1.1 cm×1.3 cm,结节体积为1.19 mL,VRR为56%

A:术前结节大小为2.9 cm×1.4 cm×1.7 cm,结节体积为3.59 mL;B:术前超声造影显示病灶区部分呈等增强,部分呈无增强;C:微波消融术中;D:消融术后6个月,结节大小为1.9 cm×1.3 cm×1.5 cm,结节体积为1.93 mL,VRR为46%
在上述统计的基础上,建立预测模型M=-3.855+(3.261×结节靠近危险三角)+(2.928×结节囊性比例<50%)。该预测模型的ROC曲线下面积为0.927,预测VRR<50%的最佳截断值为-2.931,约登指数为0.740,对应的敏感性为78.9%(30/38),特异性为95.1%(116/122),准确性为91.3%(146/160)。结节靠近危险三角和结节囊性比例<50%曲线下面积分别为0.860和0.835。见图3。

图3 各影响因素及模型的ROC曲线
3 讨论
传统手术可以切除有症状的甲状腺结节,缓解患者症状,减少恶变可能。然而,手术通常有一些风险,如喉返神经损伤、甲状旁腺功能减退、出血及影响美观等[15]。非手术治疗甲状腺结节如左甲状腺素治疗和经皮热消融治疗已应用于临床中[6-9],然而,左甲状腺素的疗效仍有争议,长期药物治疗可能会引起诸如骨密度降低或心房颤动等不良反应[16]。近年来,激光消融、射频消融和微波消融作为热消融治疗良性甲状腺结节的方法得到了广泛的应用[17]。其中,Petrov等[18]使用美国国家医学图书馆数据库研究显示,超声引导下的甲状腺结节激光热消融是最有效的微创治疗技术,在良性甲状腺结节的治疗中,该技术是一种替代手术干预的方法。 Larsen等[19]报道射频消融治疗结节小于2 cm、体积小于20 mL的甲状腺良性实性或囊实性结节时,效果确切、安全、患者满意度高。此外,它也是一种甲状腺高功能结节的替代疗法。Luo等[20]研究评估了良性甲状腺结节微波消融患者171例(180个结节),所有患者均接受超声引导微波消融治疗,随访6个月时甲状腺结节VRR>50%者为79.7%,表明超声引导下的微波消融治疗良性甲状腺结节是一种安全有效的方法。
本研究共纳入160例良性囊实性甲状腺结节患者,采用超声引导下经皮微波消融治疗,均未用聚桂醇硬化治疗,予术后6个月随访。根据《2020年欧洲甲状腺协会在良性甲状腺结节中使用图像引导消融的临床实践指南》报道[8],甲状腺结节微波消融6个月VRR≥50%为消融完全,否则为消融未完全。本研究中,VRR≥50%为76.25%,VRR<50%为23.75%,与Liu等[21]报道微波消融术后6个月的结果相符。单因素分析结果显示,性别、年龄、体重指数,结节最大径、形态、血流、边缘、纵横比等与消融效果无明显关系,而甲状腺囊实性结节靠近危险三角、囊性成分比例<50%和结节伴钙化是消融不完全的影响因素。通过多因素Logistic回归分析,确定结节靠近危险三角区和结节囊性成分比例<50%是影响结节再吸收的独立危险因素。既往研究显示,甲状腺结节内部成分对消融疗效的影响具有统计学意义[22]。分析原因为结节实性比例越大,相应的结节的血供就越丰富,需要消融的范围就越大,术后整体吞噬吸收过程就越长;同时结节实性成分越多,血液灌注介导的冷却效应则更为显著,导致结节不完全消融,从而影响结节术后的吸收效果。Liu等[23]研究显示甲状腺结节靠近颈部危险三角区行微波消融易出现喉返神经损伤,为避免消融时热损伤,靠近后包膜的结节发生不完全消融率较高。喉返神经直接走行在甲状腺包膜的后部危险三角区,为避免损伤喉返神经,微波消融时囊实性结节可能存在不能被完全消融破坏的情况,形成不完全消融[24]。
综上所述,微波消融治疗良性囊实性甲状腺结节安全有效,并发症少,创伤小,无瘢痕,值得临床推广使用。其中结节靠近危险三角及结节囊性成分比例<50%是不完全消融的独立危险因素。因此,临床要特别注意术前评估相关因素,以获取更好的治疗效果。

