仑伐替尼在2004—2020年美国食品药品监督管理局不良事件报告系统数据库中的药品不良反应数据分析
秦燕,徐浩然,陈杰
作者单位:南通大学第二附属医院,a肝胆外科,b药剂科,江苏 南通 226001
仑伐替尼(Lenvatinib)是一种口服的多受体酪氨酸激酶小分子抑制剂[1],最初被批准用于治疗侵袭性、局部晚期或转移性分化型甲状腺癌,后在美国[2]、欧盟[3]、日本[4]和中国[5]被批准用于不可切除肝细胞癌(hepatocellular carcinoma,HCC)病人的一线治疗药品,这也是目前最主要的适应症,此外仑伐替尼与其他药物联用的疗法也被用于治疗黑色素瘤、肾癌、非小细胞肺癌和子宫内膜癌等实体瘤[6-13]。仑伐替尼给病人带来临床获益的同时,也不可避免地引发了包括高血压、腹泻、血小板减少症在内的诸多不良事件[14]。作为治疗不可切除肝细胞癌的一线药品,仑伐替尼被越来越频繁地应用于临床,但对仑伐替尼药品不良反应系统性的研究却并不完善,目前已知的不良事件都源于上市前的临床试验,而仑伐替尼的药品说明书中也只涵盖了较为常见的不良事件。因此,全面系统地研究仑伐替尼可能带来的其他潜在不良事件是必要的,这对警示临床医师和药师注意使用仑伐替尼,了解其潜在不良事件做好预防和管理有着重要意义。Connie Cheng 等[15]曾利用美国食品药品监督管理局不良反应报告系统(FAERS)数据库2015 年2 月13 日至2017 年2 月15 日的报告,分析发现仑伐替尼可能影响伤口愈合。
本研究基于真实世界的数据库系统地探索上市后,仑伐替尼在实际临床应用中引发的不良事件及其基本特征,希望为临床用药安全和相关领域的研究提供些许参考。
1 资料与方法
1.1 数据来源 本研究采用FAERS 数据库2004 年1 月1 日至2020 年12 月31 日收集的报告。该数据库是一个典型的自发呈报系统(Spontaneous Reporting System,SRS),作为目前药物警戒领域最常用的药品上市后安全性监测数据库,是发现药品不良事件信号的主要来源[16]。FAERS 数据库收集由医疗卫生人员(如医生、药师、护士等)、病人和药品制造商等多方报告的包括不良事件报告,用药错误报告和导致不良事件的产品质量投诉,对药品和治疗性生物制品上市后的安全性进行监测,每个季度进行数据更新[17]。
1.2 研究方法
1.2.1 数据处理 对于与数据库中的重复报告,以病人唯一的编号为识别码进行去重操作。对于不良事件的名称,参照MedDRA(medical dictionary for regulatory activities)23.0 版本标准中的首选语(preferred term,PT)进行识别和汉化。重复报告的识别及数据规整由双人独立完成并比对。
1.2.2 统计学方法 使用描述性分析对所有使用仑伐替尼而发生不良事件的病人的基线人口学资料进行描述。对于信号挖掘,采用不相称分析(disproportionality analysis)方法中的报告比值比(reporting odds ratio,ROR)和贝叶斯置信传播神经网络信息成分(information components,IC)进行分析[18-20]。同时为了保证结果的稳定性而采用压缩估计的方法,压缩参数选取0.5[21-23]。本研究仅对数据库中报告数大于等于3 的不良事件进行分析,潜在阳性信号的判断标准为ROR 的95% 置信区间的下限(ROR025)大于1 或IC 的95%置信区间的下限(IC025)大于0[24-25]。所有的数据整理、分析采用SAS9.4 进行完成,标准化和汉化采用MedDRA 24.0 版本完成。
2 结果
2.1 发生不良事件病人的基线资料 本研究共提取到9 590 312条不良事件报告,根据变量匹配法删除重复报告100,673例。因使用仑伐替尼而发生不良事件的病人有7 205 例,其中有男性4,183 例(58.06%),女性2 619 例(36.35%),男性在使用仑伐替尼后发生不良事件中的占比远高于女性;此外,大多数病人(约40.32%)的年龄都在65 岁及以上,但年龄缺失的比重也较大;在所有不良事件导致的结局中,住院(n=3 331,46.23%)最为常见,其次是死亡(n=1 416,19.65%);仑伐替尼的适应症最常见于肝细胞癌,约为29.64%,紧接着是肾癌(13.89%)和甲状腺癌(11.63%);在所有报告的国家中,日本(40.19%)和美国(36.13%)占据了主导地位,我国的占比只有2.10%,这是由于FAERS 中只包含了国外药企从我国收集到的数据[26]。见表1。

表1 使用Lenvatinib产生不良事件病人的基本情况
2.2 不相称分析的信号挖掘结果 本研究共检测出331 个不良事件阳性信号,其中ROR 指标阳性的有331 个,从信号最强的肝性脑病(ROR025=55.028)到信号最弱的息肉(ROR025=1.008),IC 则检测到阳性信号308 个,包括最强的肝性脑病(IC025=5.760)到最弱的肠梗阻(IC025=0.027)。由此可见,两种方法挖掘信号能力的一致性较好。由于篇幅限制,表2只展示了信号强度前100 的不良事件。从表2 中可以看出,肝性脑病(IC025=5.760,ROR025=55.028)、蛋白尿(IC025=5.371,ROR025=49.978)和肿瘤出血(IC025=5.306,ROR025=40.821)等不良事件的信号强度非常强。

表2 与Lenvatinib相关的信号强度前100的不良事件
在与仑伐替尼相关的不良事件报告频率上(表3),腹泻(n=904,IC025=2.168,ROR025=4.523)、食欲减退(n=804,IC025=3.368,ROR025=10.401)、疲乏(n=772,IC025=1.610,ROR025=3.077)、高血压(n=759,IC025=3.296,ROR025=9.895)和恶性肿瘤进展(n=598,IC025=4.241,ROR025=19.084)的报告频率相对较高。
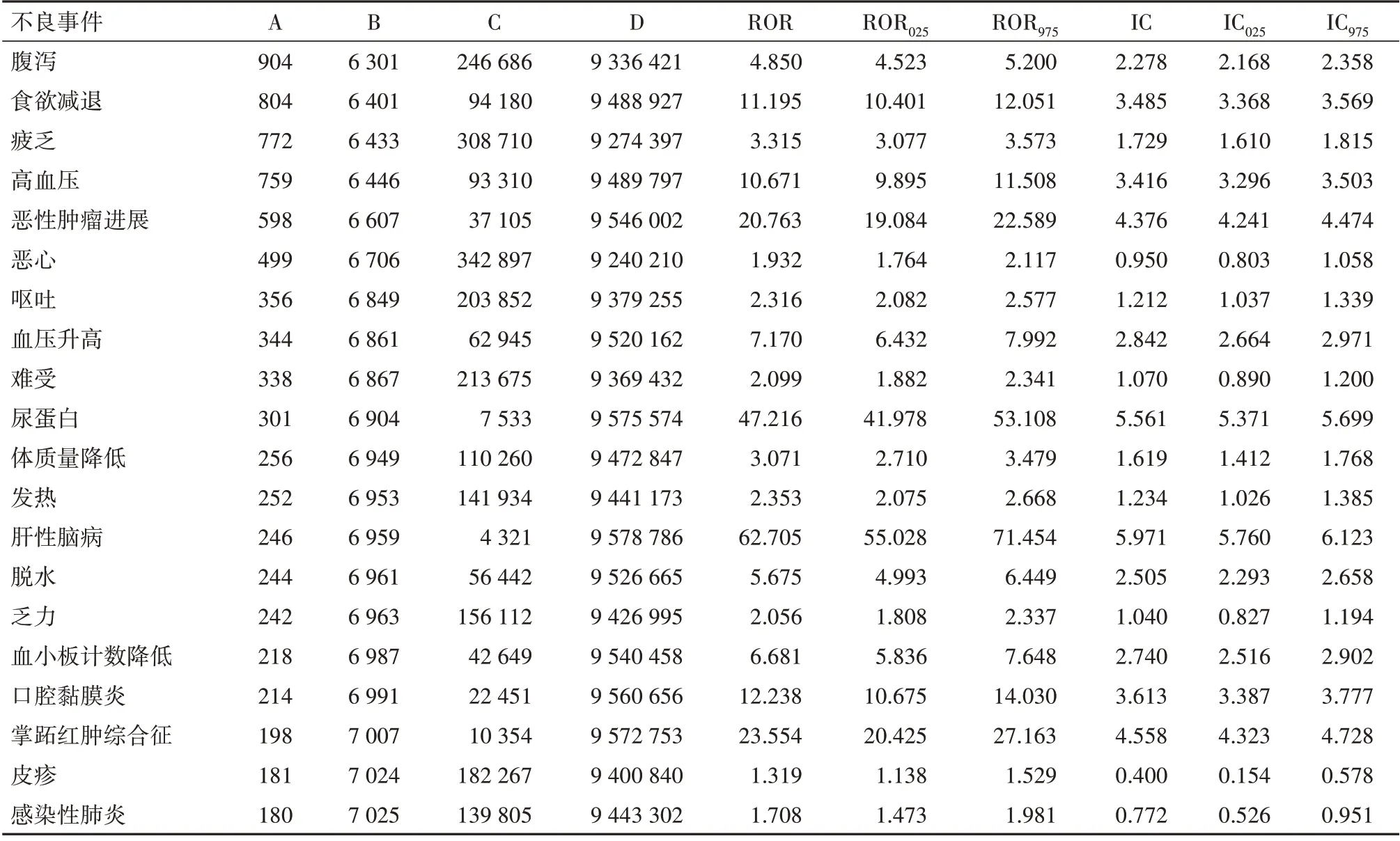
表3 与Lenvatinib相关的报告频数前20不良事件信号检测结果
3 讨论
肝细胞癌(hepatocellular carcinoma,HCC)是全世界范围内最常见的原发性肝癌,大约占所有肝癌病例的75%到85%,也是癌症相关死亡的主要原因[27]。目前,仑伐替尼作为一线的HCC 疗法被广泛应用于临床,随之而来的还有许多不良事件,虽然真实世界的证据在不断增加,但利用这些数据对仑伐替尼引发不良事件的系统性报告和研究却很少,全面地探究仑伐替尼的药品不良反应有着重要意义。
在我们的研究结果中,男性关于仑伐替尼药品不良反应的报告比例显著高于女性(58.06%比36.35%),这可能是由于男性肝癌的发病率高于女性所致。有研究发现,在世界大多数地区,肝癌在男性中的发病率和死亡率高出女性2~3 倍[28],这导致男性有更大可能暴露于仑伐替尼治疗,从而增加了男性有关仑伐替尼不良事件的报告率。
对于报告国家而言,日本和美国是报告的主要来源,合计共占所有报告的76.32%,这可能与丙型肝炎是导致美国与日本发生HCC 的原因有关[29-31]。乙型肝炎同样是引发HCC 的主要危险因素,虽然中国是乙肝的高发地区,但由于我国医疗卫生机构并无主动向FAERS 数据库提交报告的惯例,只由海外药企收集中国相关数据并提交,所以导致我国报告率仅有2.10%。
本研究使用了两种不相称分析方法进行信号挖掘,结果表明ROR 和IC 信号挖掘的能力基本相当,两种方法分析结果的一致性和稳定性较好。在所有挖掘到的331 个阳性信号中,肝性脑病(hepatic encephalopathy)、蛋白尿(proteinuria)和肿瘤出血(tumour haemorrhage)三者的IC025都大于5,且ROR025都大于40,显示出非常强的信号强度。其中肝性脑病和蛋白尿已在上市前的三期临床试验中被证实是仑伐替尼的不良反应[32-36],在FDA 的药品说明书中也有记录[34]。而目前尚未有相关研究报告肿瘤出血和仑伐替尼间的关联,鉴于其显示出高信号强度,在临床用药时应格外关注该不良事件,相关的研究也有待进一步探索和完善。
此外,阳性信号中不同部位的出血类事件(包括肿瘤出血、动脉出血、食管静脉曲张出血等24个)和不同部位的穿孔类事件(包括胃肠穿孔、食管穿孔、大肠穿孔等11个)较频繁地出现,FDA 的药品说明书中虽然提及出血事件,但未明确具体部位,而穿孔事件也只有胃肠道穿孔这一种不良反应[37]。有研究报告了仑伐替尼与胆囊穿孔[38]、小肠穿孔[39-40]、气管穿孔[41]和食管穿孔[42-43]等穿孔事件的关系,与本研究检测出阳性信号的结果相吻合。各类出血事件的研究和报告较少,仅见一个二期临床试验报告中出现一例脑外出血的病例[44],出血事件相关的研究有待进一步完善。结合本研究的结果和既往研究对于穿孔和出血事件的报告,相关不良事件也需要得到临床医生关注和重视。
对于不良事件的报告频率,腹泻、食欲减退、疲乏和高血压等事件较为常见,这些也是既往研究[7,14]和药品说明书中指示的最常见的不良反应,与本研究的研究结果一致,这些不良反应的等级和严重程度相对较低,临床医生和药师只需在用药时注意识别和管理即可。
本研究也存在一些不足之处,首先,FAERS 数据库这类自发呈报系统存在其自身缺陷,由于上报者来源较多导致数据来源多、数据格式不够规范、存在一定重复报告和缺失报告等客观缺点,可能使得分析结果出现偏倚[45];第二,年龄变量缺失比例较大,本研究未对仑伐替尼药品不良反应真实的年龄分布特征进行探讨和估计;第三,本研究利用的数据库来源于美国,库中鲜有仑伐替尼在中国发生不良事件的报告,对于仑伐替尼在我国表现出药品不良反应概况本研究未展开讨论。中国是肝癌的好发国家[46],仑伐替尼应用较多,药物相关不良事件或具有代表性,或可利用国内数据库对此课题进行相关研究,以弥补本研究的缺失和不足。
综上所述,仑伐替尼存在较广泛的药品不良反应,部分不良事件已被报告或已在药品说明书中明确,另一些不良事件是在本研究中初次报告,考虑到这些不良事件的信号强度和报告频率,在进行临床诊疗活动时,医疗卫生人员在应用仑伐替尼时应该对相关不良事件及时进行识别和预防,并采取相关治疗管理措施保证病人用药安全。

