siRNA沉默ECT2对人SW1990胰腺癌细胞中时钟基因PER表达的影响
彭宇环 洪明昭 王洪 刘峰
(中国科学院大学深圳医院 1药学部,广东 深圳;2内分泌科)
目前,糖尿病合并胰腺癌的患者增长显著,其中以轻、中度中老年2型糖尿病患者为主,且男性多于女性〔1〕,糖尿病患者的胰腺癌发病率相比于正常人高出1.5~7.0倍。研究证实一些糖尿病患者的胰腺功能处于长期紊乱、胰岛素抵抗状态,慢性高血糖对胰腺腺泡细胞造成慢性刺激,最终导致胰腺癌〔2,3〕。除此以外,某些胰腺癌患者发现前就以糖尿病面孔出现,这是因为胰腺癌直接破坏胰岛细胞,造成胰岛素分泌减少,同时患者体内也容易产生胰岛素抗体,最终引起血糖升高〔2,3〕。目前认为胰腺癌和糖尿病互为因果关系。但由于目前对其研究并不深入。因此,进一步探索其相关机制,探索其早期筛查标志物及相应的诊疗手段,有重要的理论价值和社会价值。有报道显示上皮细胞转化序列2癌基因(ECT2) mRNA及蛋白在胰腺癌组织中高表达,与患者生存相关〔4,5〕。本研究拟采用高糖培养基培养人SW1990胰腺癌细胞并采用siRNA-ECT2沉默ECT2表达,观察其增殖能力和凋亡水平的改变,并采用荧光定量PCR检测时钟基因PER1和PER2表达水平,初步探讨ECT2对人SW1990胰腺癌细胞中时钟基因PER1和PER2的作用机制。
1 材料与方法
1.1材料 人SW1990胰腺癌细胞购自中国科学院细胞库。主要试剂与仪器:化学合成siRNA-ECT2购自上海吉玛生物公司;人SW1990胰腺癌细胞培养基购自美国ScienCell公司;CCK-8细胞增殖检测试剂盒及AV-PI细胞凋亡检测试剂盒购自北京四正柏生物公司;荧光定量PCR试剂盒购自日本东洋纺公司。ST-360型酶标仪购自山东博科生物公司;FACSAria Ⅱ型流式细胞仪购自美国BD公司;9600型荧光定量PCR购自美国ABI公司。
1.2CCK-8法检测SW1990细胞增殖能力 人SW1990胰腺癌细胞培养后,用培养基将其制成细胞悬液,然后采用细胞计数仪计数细胞,在96孔细胞培养板中每孔加入200 μl细胞悬液,即每孔1 000个细胞,将细胞培养板放置37℃二氧化碳细胞培养箱中培养24 h,设置对照组,再分别加入siRNA-ECT2,每个浓度设3个平行孔。分别培养24、48、72、96 h后在96孔细胞培养板的每个孔加入CCK-8 10 μl,然后继续培养1 h后在酶标仪波长450 nm处读取各孔吸光度(OD)值,以OD值表示细胞相对活力,绘制生长曲线。
1.3流式细胞术检测SW1990细胞的凋亡水平 将SW1990细胞接种于6孔细胞培养板中,设置对照组,每组3个平行孔,参照说明书操作分别收集各组细胞,每管5×105个,1倍磷酸盐缓冲液(PBS)洗涤2次,用100 μl标记液重悬细胞,室温下避光孵育15 min,每管样本加入10 μl碘化丙啶(PI),再加入预冷的1倍结合缓冲液后上机检测。
1.4免疫印迹检测相关蛋白表达 分别收集对照组、实验组药物作用48 h后的细胞提取总RNA,总RNA提取参照Trizol使用说明书进行。逆转录反应及荧光定量PCR参照TaKaRa公司说明书进行。PER1上游引物:TGCGCCCGCACTGCGATTTA,下游引物:TGGGATTTATTACTGCAGGGGGACA,扩增产物长度75 bp;PER2上游引物:TGCGCCCGCACTGCGATTTA,下游引物:TGGGATTTATTACTGCAGGGGGACA,扩增产物长度106 bp;β-actin上游引物:CTCCATCCTGGCCTCGCTGT,下游引物:GCTGTCACCTTCACCGTTCC,扩增产物长度268 bp。采用2-ΔΔCt分析法计算目的基因相对表达量。
1.5统计学分析 采用SPSS18.0软件进行单因素方差分析及LSD法检验。
2 结 果
2.1siRNA-ECT2对SW1990胰腺癌细胞活力的影响 24、48、72、96 h检测OD值,各浓度作用组的细胞OD显著下降,与对照组相比较有显著差异(P<0.05)。CCK-8实验结果表明siRNA-ECT2可以抑制人SW1990胰腺癌细胞的增殖,呈现一定剂量性和时效性。见表1。
表1 siRNA-ECT2对SW1990胰腺癌细胞活力的影响
2.2siRNA-ECT2促进SW1990胰腺癌细胞发生凋亡 siRNA-ECT2干预高糖培养的胰腺癌细胞后,SW1990细胞的凋亡率上调,对照组(2.57%±0.21%)与siRNA-ECT2组相比(21.44%±0.78%)差异显著(P<0.05)。见图1。
2.3siRNA-ECT2上调SW1990细胞中PER1和PER2基因表达 siRNA-ECT2组PER1和PER2 mRNA相对表达量(3.899 8±0.139 0、4.340 2±0.294 1),明显高于对照组(1.031 5±0.030 2、1.212 1±0.107 8,均P<0.05)。
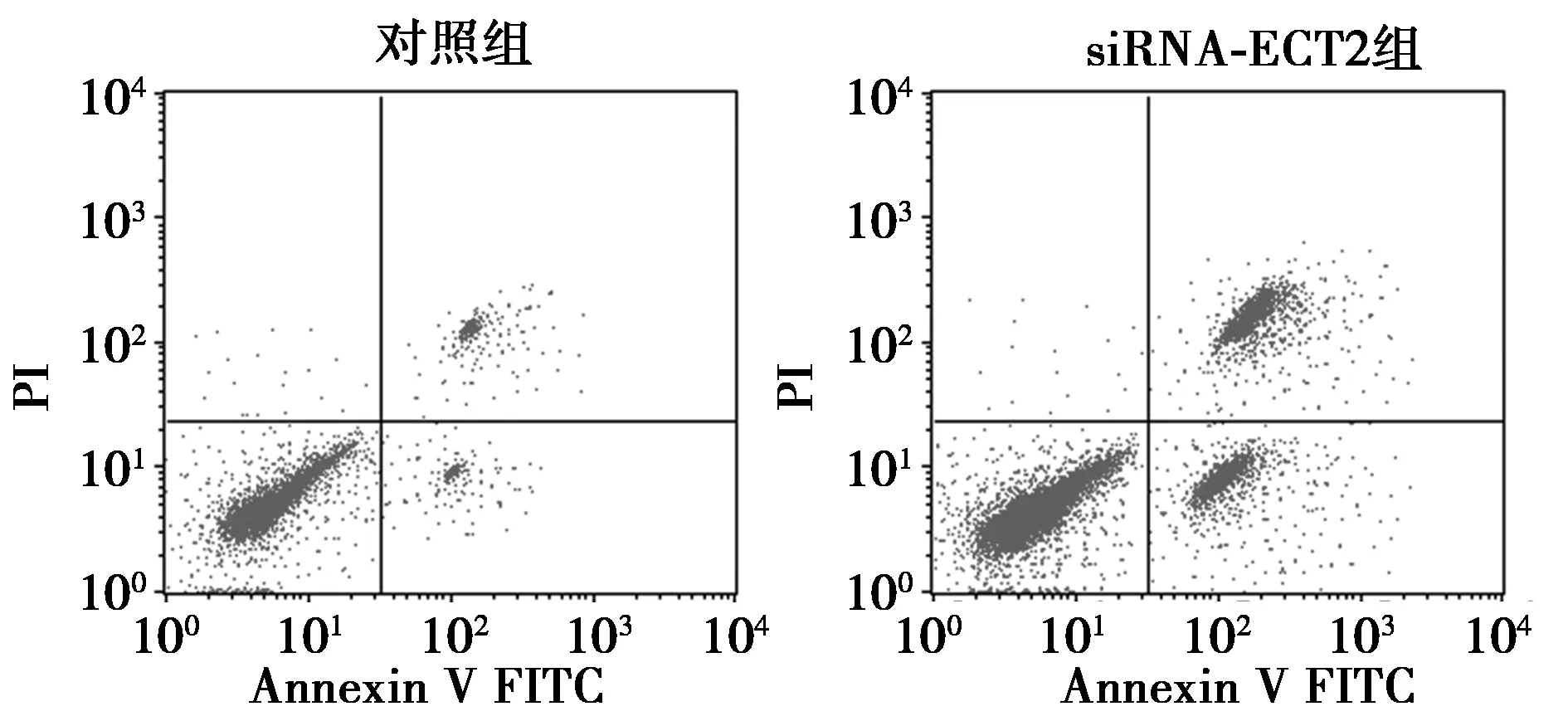
图1 siRNA-ECT2对SW1990胰腺癌细胞的促凋亡作用
3 讨 论
胰腺癌因为恶性程度高、预后差,被称为癌症之王〔6〕。胰腺癌常见的分为两种病理类型,包括胰腺导管腺癌(约占90%)和胰腺内分泌肿瘤(少于5%)〔7〕。目前针对胰腺癌的治疗方案主要包括手术治疗、传统放化疗、新辅助治疗及免疫疗法,但仍未能显著提高患者的生存率,且5年生存率极低,迫切需要有效的新治疗方式〔8~10〕。糖尿病患者由于糖代谢异常,高糖长期对于胰岛细胞的损伤,诱发胰腺癌的概率大大升高,糖尿病合并胰腺癌并不罕见,出现这种合并症状患者在治疗方案也与单纯胰腺癌患者方案有所调整〔2,3,11,12〕。代谢调控是生物信号输出的重要途径,如糖代谢紊乱容易诱发肥胖或糖尿病,而时钟基因在这其中发挥重要作用。外周生物钟在人体大部分组织中广泛存在,外周生物钟并不能自主产生生理节律,而是由位于大脑中的视交叉上核控制下的神经、体液等其他信号分子进行调控〔13~15〕。目前已明确有一些不良的生活习惯可以影响生物钟基因的震荡表达模式,从而进一步影响生物钟的变化,包括糖尿病在内的各种疾病〔16,17〕。有报道显示在糖尿病患者外周血白细胞中PER1及PER3的表达显著降低,提示糖尿病患者生理节律的紊乱〔18,19〕。我国是全球糖尿病患者最多的国家。糖尿病发病的关键环节是胰岛β细胞的功能受到损害及胰岛素抵抗。通过小鼠实验发现,当小鼠胰岛β细胞中的生物钟基因发生异常变化时,胰岛素的分泌会发生障碍,同时葡萄糖代谢发生紊乱,并进一步促进糖尿病的发生〔20,21〕。因此从生物钟的角度为切入点,寻找预防与治疗糖尿病的新靶点与新方法打开了新的思路。
ECT2位于人类肿瘤较易发生突变的染色体3Q26区域,在多种肿瘤组织中表达,属于Rho家族特异性交换因子,在DNA损伤应答和细胞周期调控中发挥重要作用,并可通过调节Rho调控胞质分裂过程。此外ECT2可引起RAS同源(RHO)家族小GTP酶的异常激活,与肿瘤及多种疾病密切相关。ECT2在非小细胞肺癌、恶性结肠癌、胰腺癌等组织中高表达,且可以促进肿瘤增殖、侵袭及转移〔22〕。
本研究结果显示采用siRNA沉默ECT2的表达能够抑制胰腺癌细胞生长,且能够促进胰腺癌细胞发生凋亡,另外,提示ECT2有可能参与调控相应基因从而改变PER1和PER2的表达,有可能对于生理节律相关基因有一定调控,对于糖尿病合并胰腺癌患者临床上调节生理节律,有助于其治疗和生存状态的改善。

