原代大鼠骨髓来源内皮祖细胞培养方法改进及其生物学特性研究
李中轩,石宇杰,李俊峡,陈韵岱
血管内皮是由单层鳞状上皮细胞组成,最初认为血管内皮只维持血管内外水和电解质平衡。随着研究的深入,发现血管内皮除了有机械屏障功能外,还参与凝血和抗凝,防止出血和血栓形成,在生理状态下,通过各种抗血小板聚集及抗凝机制维持促凝和抗凝平衡。拥有感受器和效应器功能,通过内皮细胞表面受体接受各类分子信号激动(蛋白质,细胞因子和激素等),接受并传递信号启动下一步病理生理活动[1]。血管内皮还是一个有内分泌功能的器官。通过释放血管收缩因子,包括血管紧张素,前列腺素,内皮素以及舒张因子,一氧化氮,环氧花生烯酸,调节血管紧张度[2,3]。然而,当血管内皮受损,功能障碍时,会导致各种类型的心血管疾病,如高血压,糖尿病,冠状动脉粥样硬化心脏病(冠心病),外周血管疾病及慢性肾脏疾病[4-8]。因此,恢复管壁完整性对于减少心血管疾病患病率和死亡率至关重要。
目前,内皮细胞作为终末细胞,增殖分化能力低,很难及时修复受损管壁,因此,EPCs作为内皮细胞的前体细胞可以直接参与到修复损伤血管内皮或分化为内皮细胞修复管壁[9],是恢复管壁完整性的最好选择之一。生理状态下,EPCs含量很低,在心血管疾病患者循环中含量更低[10]。因此未来移植EPCs促进血管内皮修复成为可能方法之一。如何提高内皮祖细胞纯度是目前重点关注的焦点。自1997年Asahara首次从外周血中分离出CD34+和VEGFR2+的EPCs以来[11],各种方法被用于分离,培养EPCs。尽管越来越多不同组织来源的EPCs被成功分离培养,但骨髓来源EPCs仍是最主要和最重要的来源[12],与此同时EPCs不同于其他种类细胞,目前仍无法仅凭借表面标志物确定所培养细胞为EPCs,需要结合功能检测,多方面确定所培养细胞就是EPCs。本研究通过分离大鼠骨髓来源EPCs,在培养中不断通过EPCs集落挑选纯化,改进EPCs培养方式与步骤,提高EPCs纯度,同时结合观察EPCs的形态学特征,吞噬和摄取功能检测,免疫荧光及流式细胞术鉴定EPCs表面标志物,迁移实验和成管实验多方面,多角度鉴定EPCs,提出一种新的大鼠骨髓来源EPCs的分离培养纯化鉴定方法,为今后移植EPCs治疗心血管疾病提供细胞保障。
1 材料和方法
1.1 实验动物SPF级Sprague-Dawley(SD)大鼠购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。
1.2 主要实验试剂及设备EGM-2培养基(Lonza,美国)。histopaque-1083(Sigma-Aldrich,美国)。Fibronectin(R&D,美国)。胎牛血清(FBS,Gibco,美国)。DilacLDL(Thermo Fisher Scientific,美国)。FITC-UEA-I(Sigma-Aldrich,美国)。von Willebrand Factor(vWF,Abcam,美国)。vascular endothelial cadherin(VE-cadherin,Santa Cruz,美国)。Alexa Fluor 647-VEGFR2(Cell Signaling Technology,美国)。PE-CD34(Thermo Fisher Scientific,美国)。0.22 μm Filter Unit(Millipore,美国)。结晶紫(Beyotime,中国)。基质胶(Corning,美国)。Cell counting kit-8(CCK-8,Dojindo Molecular Technologies,日本)。24-well Transwell chamber(Corning,美国)。酶标仪(BioTek,美国)。荧光倒置显微镜(Nikon,日本)。激光扫面共聚焦显微镜(Leica Microsystems,德国)。流式细胞检测仪(BD Biosciences,美国)。
1.3 大鼠骨髓来源EPCs的分离与培养将大鼠麻醉处死后,放入75%酒精中浸泡30 min,取大鼠股骨和胫骨,用注射器吸取EGM-2培养基反复冲洗,直至将骨髓全部吹出。将细胞悬液用0.22 μm Filter Unit过滤,把碎骨块及大细胞团滤掉,用EGM-2培养基重悬单个核细胞,按1:1比例将histopaque-1083与细胞悬液先后加入离心管中,此过程注意保持液面交界清晰。离心管放入离心机经1400 rpm离心30 min后,小心取出离心管,整个过程轻柔保持离心管无晃动。观察离心管,发现此时离心管内液体分为4层,小心并尽量收集云雾状单个核细胞层。将通过密度梯度离心法得到的骨髓单个核细胞再次用EGM-2培养基,1000 rpm离心10 min,清洗两遍。最后把细胞悬液接种到Fibronectin包被的培养皿上,放入含5%CO2,95%湿度,37℃温箱中孵育。12 h进行第一次换液,将培养基缓慢吸除,整个过程动作缓慢轻柔,尽量避免使贴壁不牢固EPCs脱壁,造成细胞数量损失。从第二次换液开始,每24 h换液一次,换液过程中用EGM-2培养基反复冲洗,使未贴壁细胞被完全去除,在倒置显微镜下将非EPCs集落细胞刮去除,提高EPCs细胞纯度。
1.4 EPCs吞噬功能检测将通过集落挑选纯化的原代EPCs用含5%FBS的EGM-2培养基调整密度至1×105个/ml。每孔1 ml接种于24孔板,制作爬片。每24 h进行一次换液,观察细胞密度达到80%~90%时进行实验。将Dil-acLDL用EGM-2培养基稀释至10 μg/ml,将FITC-UEA-I稀释至20 μg/ml。去除24孔板内原培养基,将Dil-acLDL与FITC-UEA-I加入孔板中,放入含5%CO2,95%湿度,37℃温箱中避光孵育4 h。用预冷PBS洗涤3次,加入4%多聚甲醛4℃固定1 h。再用PBS浸洗爬片共3遍,每次10 min。用封片剂进行封片。在激光扫面共聚焦显微镜下观察Dil-acLDL与FITC-UEA-I荧光双染细胞数量,任选3个视野,计算平均数。
1.5 免疫荧光鉴定由于EPCs表面会表达一些内皮细胞特性的标志物,本实验检测vWF及VE-cadherin的表达情况[13]。将通过集落挑选纯化的原代EPCs用EGM-2培养基调整密度至1×105个/ml,接种于24孔板中制作爬片,待细胞密度达到80%~90%时进行实验。用PBS浸洗3遍,每次10 min,用4%多聚甲醛4℃固定1 h。分别用加入一抗4℃孵育过夜,PBS浸洗3遍后,加入含二抗的抗体稀释液室温孵育1 h。PBS浸洗后用封片剂封片,在荧光倒置显微镜下观察荧光细胞,每张爬片计数3个视野,计算其平均数。
1.6 EPCs流式细胞鉴定将通过集落挑选纯化后,不同纯化阶段的原代EPCs,用0.25%胰蛋白酶消化收集,流式缓冲液调整细胞密度为5×106个/ml。将细胞悬液加入流式管中。再将PECD34、Alexa Fluor 647-VEGFR2加入流式管中,4℃避光孵育1 h。用预冷PBS洗涤3遍,用流式细胞仪检测CD34+和VEGFR2+细胞比例。
1.7 EPCs生长曲线、增殖及活力检测将通过集落挑选纯化的原代EPCs,用含5%FBS的EGM-2培养基调整密度至2×104、4×104、6×104、8×104、1×105个/ml,每12 h检测一次,连续检测72 h。将100 μl细胞悬液按相应分组加入96孔板中,每组设3复孔,在5%CO2,95%湿度,37℃温箱中避光孵育0~72 h。通过CCK-8增殖检测试剂盒进行生长曲线测定及增殖能力检测。EPCs培养至规定时间后,每孔加入10 μl CCK-8溶液,在温箱中继续培养2 h后,用酶标仪检测450 nm处OD值。MTT实验检测EPCs活力,与CCK-8检测相同,细胞培养至规定时间后,每孔加入10 μl MTT溶液,温箱中继续孵育4 h,去除上清后,加入150 μl DMSO,于570 nm处检测OD值。
1.8 纯化的EPCs迁移能力检测通过24-well Transwell chamber检测集落挑选纯化后的原代EPCs迁移能力。首先分别在上室和下室中加入100 μl和600 μl EGM-2培养基于温箱中平衡1 h,将EPCs用无FBS的EGM-2培养基调整密度至1×105个/ml。将平衡后的小室取出后去除培养基,在上室中加入100 μl细胞悬液,下室加入600 μl含10%FBS的EGM-2培养基。培养24 h后,将上室未迁移的细胞用棉签轻轻擦去,将迁移至下室的细胞用4%多聚甲醛4℃固定30 min。用预冷PBS浸洗3遍,每次10 min。结晶紫染色后于倒置显微镜下任选5个视野观察并计数迁移细胞数量。
1.9 纯化的EPCs体外成管能力检测体外成管实验评价集落挑选纯化后的原代EPCs血管新生能力。将基质胶于4℃避光过夜,保证基质胶完全融化。将100 μl基质胶加入96孔板中,于37 ℃温箱中固化30 min。将EPCs用含5%FBS的EGM-2培养基调整密度至1×105个/ml。100 μl细胞悬液加入96孔板中,在5%CO2,95%湿度,37℃温箱中进行孵育。观察EPCs的体外成管能力,并用Image-Pro Plus计算新生管壁的长度。
1.10 统计学分析所有实验均重复三次,所有数据均采用SPSS 17.0统计学软件分析。计量资料采用均数±标准差()表示,两组间比较采用t检验,多组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠骨髓来源原代EPCs形态学特征骨髓单个核细胞呈圆形紧密排列于纤维包被的培养上(图1A)。第一次换液后,大部分贴壁不紧密以及坏死细胞被去除(图1B),在后续集落挑选过程中非EPCs集落被刮除(图1C)。大鼠骨髓来源EPCs经过集落挑选纯化后,培养至第4 d,于倒置显微镜下观察EPCs形态,发现细胞呈现出纺锤形,细胞数量较少,分散在培养瓶底部,此为早期内皮祖细胞(图1D)。继续培养14 d左右,集落出现,EPCs呈现典型的铺路石样改变(图1E),细胞呈现出类圆形,三角形或多边形(图1F)。细胞数量逐渐增多,且经过在培养过程中不断清除非EPCs集落,此时培养瓶中几乎全部为典型的EPCs集落。
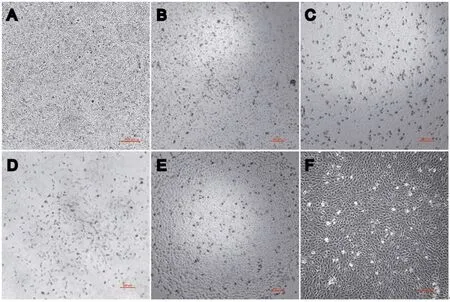
图1 原代骨髓来源大鼠内皮祖细胞形态学观察
2.2 EPCs吞噬功能鉴定对经过集落挑选纯化后的原代EPCs进行吞噬功能检测,结果显示EPCs具有吞噬Dil-acLDL的能力,使细胞在共聚焦显微镜下呈现红色(图2A)。同时,EPCs还具有结合FITC-UEA-I的功能使细胞呈现出绿色(图2B)。最终,约(95.7±3.8)%细胞同时具有吞噬Dil-acLDL和结合FITC-UEA-I能力(图2C),呈现黄色(图2D)。
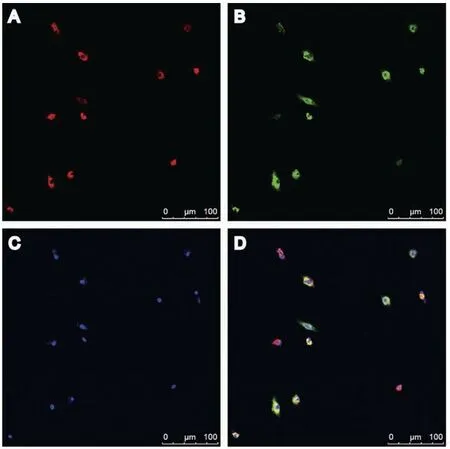
图2 内皮祖细胞吞噬检测
2.3 免疫荧光鉴定对EPCs表面表达的内皮细胞特性的标志物进行鉴定,结果显示细胞中vWF阳性表达率(96.8±2.8)%(图3A,C,E),VE-cadherin阳性表达率(97.1±1.4)%(图3B,D,F)。
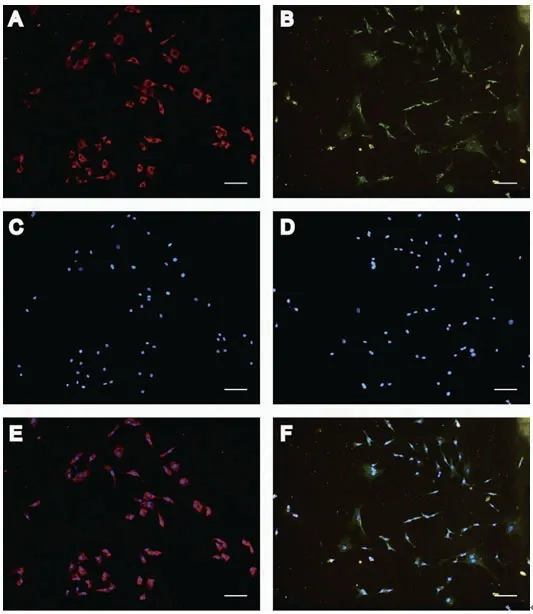
图3 内皮祖细胞免疫荧光检测
2.4 EPCs流式细胞术鉴定通过流式细胞术对经过集落挑选纯化后的原代EPCs表面标志物CD34和VEGFR2表达情况进行分析,大量研究证明,EPCs共表达CD34和VEGFR2。我们从结果得出,只经过密度梯度法离心后CD34+和VEGFR2+细胞比例为(13.7±1.9)%(图4A),经过首次差速贴壁与集落挑选纯化后细胞比例为(73.4±2.8)%(图4B),第二次纯化后细胞比例为(76.8±3.1)%(图4C),第三次纯化后细胞比例为(80.1±3.4)%(图4D)。且经过差速贴壁与集落挑选纯化后的双阳细胞比例高[(73.4±2.8)% vs.(13.7±1.9)%,P<0.01],[(76.8±3.1)% vs.(13.7±1.9)%,P<0.01],[(80.1±3.4)% vs.(13.7±1.9)%,P<0.01],(图4E)。

图4 流式细胞术鉴定内皮祖细胞表面标志物
2.5 EPCs增殖及活力检测为了寻找用于后续实验的最佳细胞浓度以及绘制EPCs生长曲线。我们通过CCK-8进行检测,分别培养2×104、4×104、6×104、8×104、1×105个/ml的EPCs,每24 h用酶标仪检测450 nm处OD值。结果显示,在相同时间点,OD值随细胞浓度的升高而增加,1×105个/ml组达到最佳生长浓度(P<0.01)。在不同时间点,OD值随着培养时间的延长而增加,在12 h后开始进入对数生长期,48 h进入平台期。故选择1×105个/ml为后续实验细胞浓度(图5A)。用MTT检测细胞活力,每12 h检测一次,连续检测72 h。与增殖检测实验相同,相同时间,细胞浓度增加,OD值增加。不同时间,时间延长,OD值增加(图5B)。

图5 CCK-8及MTT法绘制内皮祖细胞生长曲线
2.6 纯化的EPCs迁移能力检测连续观察经过集落挑选纯化后的原代EPCs增殖情况,结果显示EPCs状态良好,12 h少量细胞已由上室迁移至下室(图6A),24 h较多细胞迁移至下室(图6B),36 h大量细胞进行迁移,且迁移至下室细胞状态形态良好(图6C)。

图6 纯化后内皮祖细胞迁移能力
2.7 纯化的EPCs体外成管能力检测连续观察经过集落挑选纯化后的原代EPCs体外成管情况,结果显示4 h EPCs在基质胶中逐渐开始贴壁伸展,伸出伪足(图7A)。8 h细胞相互连接,部分管腔样结构形成(图7B)。12 h细胞已完全伸展开,重新排列并形成明显管腔样结构(图7C)。

图7 纯化后内皮祖细胞体外成管能力检测
3 讨论
自Asahara首次从外周血中分离出EPCs以来[11],对EPCs的研究便不断发展和深入。Schmidt-Lucke等[10]发现EPCs可以被当做一种非特异性炎症标志物,与内源性血管损伤修复能力密切相关。EPCs功能障碍会导致内皮修复受损。此外,EPCs还可以诊断和监测疾病,动脉粥样硬化。当CD34+/VEGFR2+细胞比例下降至外周血单个核细胞的0.0038%以下时,心血管疾病发生风险增加6倍以上。由于,EPCs与缺血性疾病关系密切。因此针对其做为内皮细胞的前体细胞,当血管壁受损时不仅可直接进行修复,还可分化为内皮细胞修复受损管壁,恢复管腔完整性的特性以及EPCs具有血管新生能力。越来越多的研究集中于移植EPCs修复损伤管腔以及治疗缺血性疾病。
目前,已有大量动物和临床研究证明可以通过移植EPCs治疗缺血相关性疾病。在动物实验中,Geng等[14]为糖尿病小鼠移植EPCs减轻了局灶性脑缺血导致的血脑屏障功能损伤。Fan等[15]将EPCs移植入缺血性脑损伤小鼠体内,发现促进神经血管修复,并改善长期神经行为预后。在临床实验中,Chade[16]自体移植EPCs增加肾脏外周皮质中血管生成。Liangden等[17]将EPCs注射入肾包膜下区域,增加肾脏微循环同时减少了细胞凋亡以及炎症因子释放。Lee和Quyyumi等[18,19]分别发现EPCs治疗组可改善左室射血分数,增加新生血管数量,并减轻心绞痛及心衰症状。以及改善心肌梗死面积,延长院外生存时间。因此,如何获得纯度较高的EPCs用于移植对修复损伤管腔及治疗缺血性疾病至关重要。高纯度意味着当EPCs用于移植时,单位体积细胞移植物中EPCs含量更高,有效性更高,移植物中其他种类细胞含量少,对患者的有害性及副作用就小。因此,探索一种用于获得较高纯度的EPCs方法十分必要。
EPCs来源较广泛,最早Asahara从外周血中分离出EPCs,此后发现其也存在于其它组织中,包括脂肪,肝脏,肾脏[9,20,21]等。与其它获取EPCs的来源相比,EPCs来源于血液血管母细胞,产生后一直存在骨髓中[12],当受到应激后才释放入血液循环,因此骨髓比外周血可获得较早期有更高增殖分化潜能的EPCs[22]。且骨髓中EPCs远较肝脏,肾脏,脂肪中含量多分布广,选择骨髓来源EPCs作为实验分离培养纯化鉴定的细胞来源。
目前较常用的EPCs分离方法为,密度梯度离心法及磁珠分选法。密度梯度离心法优点是离心后的细胞生长环境不会被破坏有利于细胞生长,缺点是所获得细胞中含有较多杂细胞,最终得到细胞纯度较低。磁珠分选法优点是可以获得纯度极高的带有特定表面标志物的细胞,缺点是细胞生长所需的微环境被完全破坏不利于细胞生长,且在分选过程中会导致细胞被破坏,增加污染几率,成本较高。本研究中选择密度梯度离心法,结合差速贴壁法及集落挑选方法,分离培养并纯化EPCs。在操作过程中要注意无菌操作,防止细胞污染,密度梯度离心过程中,操作要温柔,在将细胞悬液加入分离液过程中要保证分离液面清晰,离心时要保证低转速,长时间,在减速过程中要将离心机刹车设置为0,自然减速,减少分离后各层之间融合,确保所分离细胞纯度和数量。在应用差速贴壁法时,保证首次换液时操作缓慢,避免还未贴壁的EPCs被去除。以后每次换液时将贴壁不牢,衰老细胞充分用培养基冲掉。同时,换液时要在倒置显微镜下仔细观察,若发现非或不典型EPCs集落,果断将其用细胞铲刮除,提高所培养细胞纯度。同时配合EBM-2培养基体外诱导EPCs生长,增加EPCs数量和提升纯度。
迄今为止还没有一种准确的方法鉴定EPCs,多种方法鉴定EPCs是现在常用的策略。最主要的方法就是鉴定EPCs的CD34和VEGFR2表面标志物。CD34用于识别造血祖细胞。表达VEGFR2说明EPCs具有分化为内皮细胞的能力[13]。EPCs表面还表达一些具有内皮特征的标志物,包括vWF及VE-cadherin[13]。EPCs还具有吞噬Dil-acLDL和结合FITC-UEA-I的能力[11]。同时EPCs还具有迁移能力和血管新生能力。本研究通过改良方法分离培养纯化的EPCs共表达CD34和VEGFR2,并具有吞噬Dil-acLDL和结合FITC-UEA-I的能力。同时其具有迁移能力与体外成管能力。迁移能力与血管新生能力对于,管壁受损后EPCs迁移至损伤部位以及改善缺血部位血运,促进微循环极为重要。综合多项鉴定实验,最终确定本研究分离培养纯化的细胞为EPCs。
综上所述,本实验提供了一种改良的,有效的分离培养纯化及鉴定骨髓来源的EPCs方法。从细胞形态学,应用流式细胞术鉴定细胞表现标志物,结合增殖和活力检测,吞噬试验,评价迁移能力和体外成管能力多方面鉴定所培养细胞为EPCs,为修复受损管壁以及治疗缺血相关性疾病提供足够数量及纯度的细胞保障。

