不同pH条件下长石和方解石矿物选择性溶蚀过程
宋来弟, 李美蓉, 于海鹏, 孙秀婷, 李晨初
( 1. 中国石油大学(华东) 理学院,山东 青岛 266580; 2. 中国石油大学(华东) 化学工程学院,山东 青岛 266580 )
0 引言
pH是影响储层矿物溶蚀的重要因素之一[1-2]。pH对长石和碳酸盐矿物溶解速率及溶蚀过程的影响[3-7]是研究的热点,HELLMANN R认为碱性长石的溶解速率随pH的变化呈U型曲线,pH对溶解速率的影响可归结为3个独立的溶解机制——酸性—质子促进作用、中性—水促进作用、碱性—氢氧根离子促进作用[8],它们在不同的pH区间内占主导地位。ARVIDSON R S等认为长石的溶解速率受H3O+和OH-的影响,即长石溶解速率与pH呈V型关系[9]。大量的长石溶解实验是在极端pH条件下进行的,长石的溶解速率对pH具有很强的依赖性[6],根据表面络合模型,H+或OH-与其他溶解离子在离子交换的竞争中占主导地位[10];当pH处于中性条件下,有机酸阴离子和阳离子(K+、Na+等)在矿物溶蚀过程中占主导地位,从而影响长石的溶解速率及溶蚀过程。
佘敏等研究表明,不同水体pH环境影响碳酸盐矿物的溶蚀过程,碳酸盐的溶蚀量与pH呈正比关系[11]。人们大多集中于长石与碳酸盐单矿物溶解沉淀过程的分析,对长石与碳酸盐复合矿物溶蚀过程的研究较少[12-15]。研究在不同pH条件下长石与方解石矿物之间的选择性溶蚀关系是必要的。近年来,GWB (Geochemist's Workbench)被应用于成岩作用数值模拟[16],可以模拟反应路径、计算化学反应平衡和矿物饱和指数及构筑多组分体系相图等。
以静态实验为主,将长石与方解石的混合矿物与乙酸溶液溶蚀进行模拟,采用原子吸收、SEM、XRD、能谱分析等方法,分析溶蚀矿物表面的形貌特征、次生矿物的组成等;结合数值模拟结果,研究长石与方解石矿物的溶解沉淀过程,探讨长石与方解石矿物在不同pH条件下选择性溶蚀现象及溶蚀的强弱程度,实验和计算机模拟结果可为优质储层的勘探[17-19]开发提供指导。
1 实验
1.1 矿物预处理
实验用的长石和方解石矿物来自中国石化胜利油田分析测试中心。首先将长石和方解石矿物样品用铁臼粉碎,然后筛分至50~60目(250~300 μm)的颗粒。因为颗粒表面附着大量纳米级杂质,杂质溶解导致反应开始时反应速率突然增加[20]。首先用无水乙醇超声冲洗样品颗粒3次以去除杂质,每次冲洗20 min;然后用去离子水反复冲洗,在温度为105 ℃的烘干箱中干燥24 h,装袋放入干燥器备用。
预处理后,选取50~60目颗粒作为溶解对象。应用X线粉末衍射仪(X 'Pert Pro MPD)对长石和方解石矿物组分进行测定,利用参比强度法对XRD数据进行计算分析[16]。长石矿物组成:w(钾长石)为84.1%,w(钠长石)为8.3%,w(石英)为3.9%,w(黏土矿物)为3.7%。方解石矿物组成:w(CaCO3)为98.0%,w(SiO2) 为1.0%,w(FeCO3)为1.0%。
1.2 实验方法
实验在250 mL反应釜(聚四氟乙烯衬里水热反应器)中静态(溶液不流动,压力为3 MPa)进行。乙酸在地层有机酸中的含量最高,选用乙酸作为酸性溶液,配制浓度为30 mmol·L-1。将乙酸溶液用体积分数分别为5% HCl和5% NaOH调节溶液pH为3.0和7.0。将预处理的3.0 g混合样品(1.5 g长石、1.5 g方解石)和配制好的溶液以固液比(固体的质量∶液体的体积)为1∶40装入反应釜。密闭反应釜,将实验温度设置为200 ℃,在12、24、72、216、456、816 h时进行取样。
实验结束,将取出的溶蚀液倒入干燥的烧杯,采用电感耦合等离子体发射光谱法(Agilent 5100)测定6组溶蚀液中Na+、K+、Ca2+、Mg2+、Al3+、SiO2的浓度。在室温条件下,用pH计(PHS-3C)测定样品的pH。反应釜中的固体颗粒经过过滤、清洗和干燥后,应用扫描电镜(SEM)观察固体表面的微观结构及能量色散,采用 X线光谱(EDS)测定次生矿物的元素组成及含量。
2 结果分析
2.1 固相表征
不同pH条件下矿物的溶蚀量结果见表1。矿物溶蚀量的正负值可以表示矿物溶解—沉淀状态,由表1可知,矿物的溶蚀量占比一直为正,说明溶蚀量大于沉淀量,矿物处于不断溶解的状态。与酸性条件(pH=3.0)相比,中性条件(pH=7.0)下的溶蚀量占比小一个数量级,溶蚀量占比最高为0.92%,说明酸性(pH=3.0)条件下矿物的溶蚀程度大,有利于矿物溶蚀。

表1 不同pH条件下固相溶蚀量
为研究长石与方解石混合矿物的溶蚀过程,对乙酸溶蚀矿物前后进行微观形貌分析,不同反应时间的形貌变化见图1。由图1(a)可以看出,反应前长石和方解石矿物表面是光滑的。反应后矿物发生明显溶蚀,将溶蚀后的矿物局部放大,可以观察到矿物表面出现较多溶蚀孔(见图1(b)),EDS能谱分析(见图1(h))为钾长石。钾长石矿物溶蚀后表面附着片状的勃姆石(见图1(c))和大量颗粒状的圆形二次矿物(见图1(d))。应用EDS检测矿物组成,主要元素为K、Ca、Al、Si、O(见图1(i)),推测二次沉淀矿物为层状硅酸盐矿物。方解石的溶蚀沿解理缝[21]进行,形成阶梯状的溶蚀现象,溶蚀后的矿物表面呈蜂窝状的伊利石沉淀(见图1(e))。pH=7.0时的溶蚀程度远小于pH=3.0的,由图1(f)可以看出,溶蚀后的长石表面未发生明显变化,未发现形状特征突出的二次矿物沉淀,仅在矿物边缘形成溶蚀孔,未对矿物的结构造成破坏。方解石发生明显的溶蚀,出现溶蚀晶锥、溶蚀缝(见图1(g))。
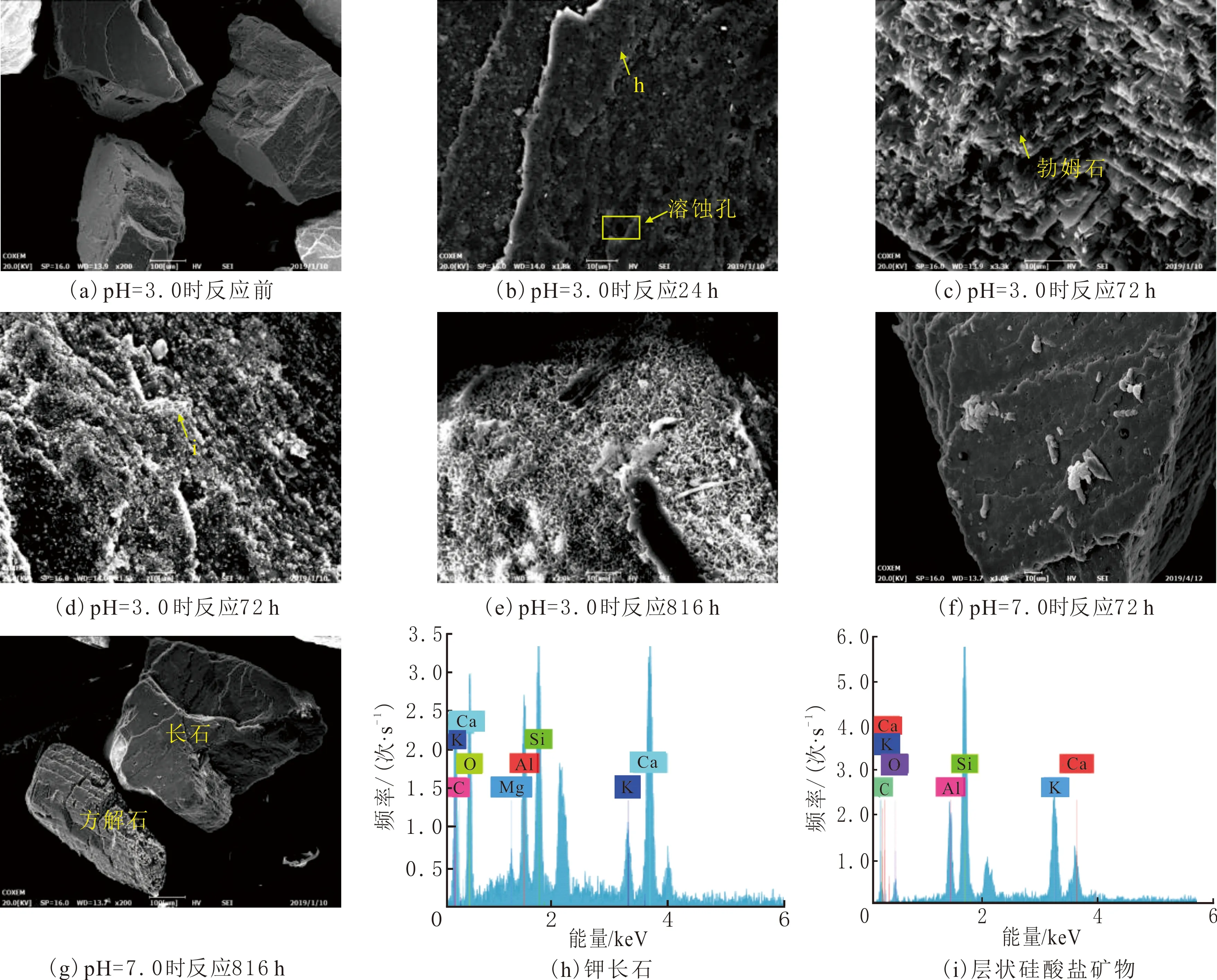
图1 乙酸溶蚀前后矿物SEM及次生矿物EDS能谱Fig.1 SEM images of mineral before and after acetic acid dissolution and the EDS map of secondary mineral
反应前后XRD谱见图2。由图2可以看出,反应前混合矿物组分主要为钾长石、钠长石和方解石,反应后矿物组分也以3种矿物为主,但衍射峰的相对强度有变化。反应前方解石衍射峰较弱,表明混合矿物中方解石溶蚀剧烈;反应后钠长石衍射峰较弱,表明混合矿物中钠长石溶蚀剧烈。
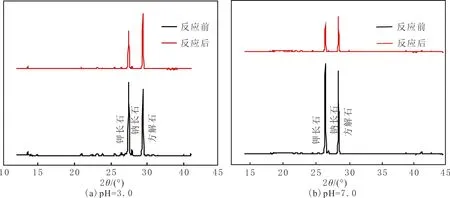
图2 不同pH条件下混合矿物表面XRD谱Fig.2 XRD patterns of mixed mineral surfaces at different pH values
2.2 液相分析
利用电感耦合等离子发射光谱分别测定溶液中Ca2+、K+、Na+、Al3+、SiO2的浓度,主要离子浓度随时间变化的曲线见图3。由图3可以看出,反应12 h内,方解石大量溶解,溶液中的Ca2+浓度升高,为14.58 mmol/L;此后Ca2+浓度下降;反应72 h,溶液中Ca2+浓度迅速增加至21.13 mmol/L;随后Ca2+浓度再次降低。K+与SiO2的释放规律具有较高的一致性,反应216 h内,浓度稳定增长,K+浓度为0.92 mmol/L,SiO2浓度为0.99 mmol/L;反应216 h后,SiO2浓度的增幅减缓,K+浓度也逐渐减小。Al3+浓度在反应24 h内小幅增加到0.03 mmol/L后逐渐降低。软件模拟溶液中离子浓度变化结果见图3(b)。由图3(b)可以看出,SiO2、K+、Al3+变化趋势与实验结果较为一致,实验条件不如模拟条件理想,所以模拟浓度大于实验浓度。
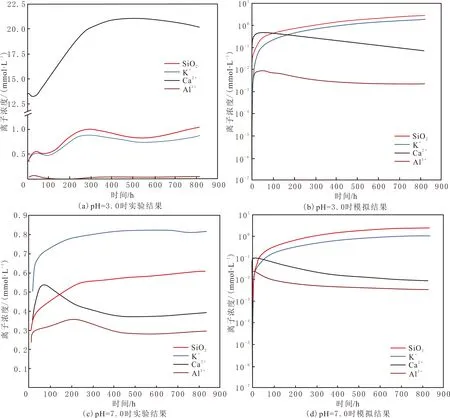
图3 不同pH条件下溶蚀液主要离子浓度随时间变化曲线Fig.3 The curves of the main ion concentration of the solution changing with time at different pH values
在pH=7.0条件下,主要离子浓度的变化与pH=3.0时的相比表现明显差异(见图3(c))。首先,Ca2+浓度比pH=3.0时的低一个数量级,而且在反应72~816 h内呈明显下降趋势(见图3(c))。K+与SiO2的释放规律具有较高的一致性,呈稳步增加的趋势。Al3+浓度在反应216 h内增加到0.35 mmol/L后,因产生二次矿物而逐渐降低,到反应456 h时降低至0.27 mmol/L。模拟结果(见图3(d))表明,Ca2+、SiO2、K+、Al3+浓度变化趋势与实验结果较为一致,方解石呈先溶解后沉淀的趋势。
pH的变化对衡量矿物在溶液中的溶解沉淀过程有重要作用,在室温下(25 ℃)检测不同时间溶液的pH,并结合软件模拟结果进行分析。在pH=3.0条件下,实验初始阶段(0~24 h),溶液的pH由3.0迅速增大到5.3,pH的主要变化由方解石溶解控制(见图4(a))。在剩余反应阶段(24~816 h),溶液的pH由5.3缓慢上升至6.1,pH变化主要由长石溶解作用控制,起主要的缓冲作用。在pH=7.0条件下,溶液的pH在7.0~8.0之间波动(见图4(c)),溶液呈弱碱性。无论是酸性还是中性条件,随反应的进行,H+不断被消耗,溶液中的pH先增大,而后增幅趋于平缓,实验结果与软件模拟结果的变化趋势较为一致。对比不同pH条件下的液相分析结果,pH是影响长石与方解石矿物选择性溶蚀的重要因素。
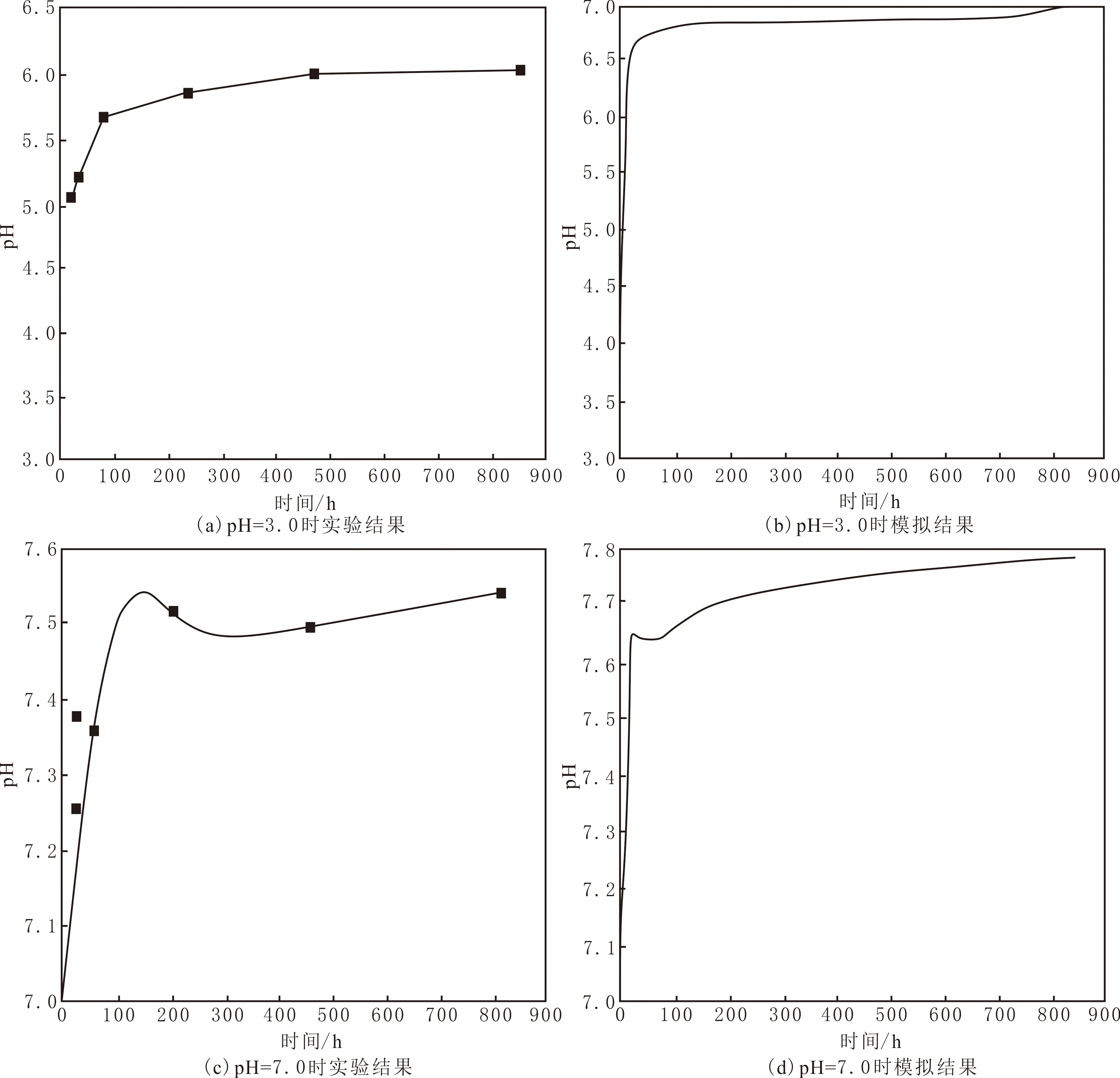
图4 溶蚀液pH随时间变化曲线Fig.4 pH curve of solution changing with time
3 讨论
3.1 混合矿物溶解速率
实验用长石矿物的主要成分为钾长石,长石溶解释放K+、Al3+与SiO2,方解石矿物溶解释放的主要离子为Ca2+,用SiO2的浓度变化代表长石矿物的溶解速率,而方解石矿物的溶解速率由Ca2+的浓度变化表示。
钾长石和方解石矿物溶解速率随时间的变化曲线见图5。由图5可以看出,在酸性条件(pH=3.0)溶解过程中,钾长石和方解石混合矿物反应初始阶段,钾长石的溶解速率较方解石的低两个数量级(见图5(a)),与文献[18]研究结果一致。反应后期,钾长石与方解石的溶解速率趋于接近,钾长石的溶解速率由12 h的3.21×10-9mol·m-2·s-1降低到816 h的1.73×10-10mol·m-2·s-1。方解石的溶解速率下降幅度较长石的更显著,反应12 h,溶解速率为1.49×10-7mol·m-2·s-1;反应816 h,溶解速率下降到3.05×10-9mol·m-2·s-1,降低两个数量级。

图5 不同pH条件下钾长石和方解石矿物溶解速率随时间变化曲线Fig.5 Curves of dissolution rates of potash feldspar and calcite minerals changing with time at different pH values
在中性条件(pH=7.0)溶解过程中,H+浓度更低,在竞争吸附过程中不占优势,矿物骨架化学键不易断裂(见图5(b))。方解石的溶解速率显著变慢,与钾长石的溶解速率保持在同一数量级上,由于H+不断被消耗,钾长石与方解石的溶解速率不断降低,长石的溶解速率由12 h的4.12×10-9mol·m-2·s-1降低到816 h的1.06×10-10mol·m-2·s-1。方解石的溶解速率下降幅度较钾长石的显著,反应12 h,溶解速率为3.50×10-9mol·m-2·s-1;反应816 h,溶解速率下降到5.80×10-11mol·m-2·s-1,降低两个数量级。中性条件的反应规律与酸性条件的相似,表现为初始阶段方解石的溶解速率大于钾长石的,反应后期趋于一致。
3.2 矿物溶蚀过程pH影响
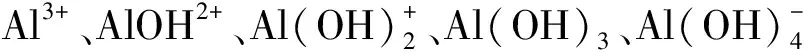
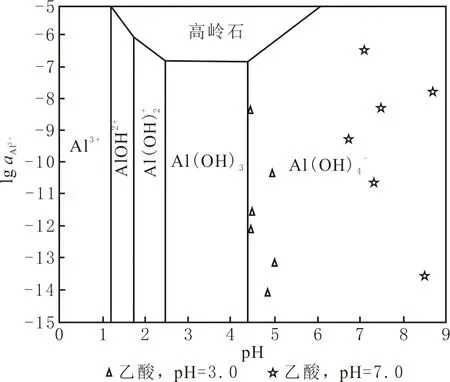
图6 200 ℃温度时Al离子形态分布随pH变化曲线Fig.6 The morphology distribution of Al ions changes with pH at 200 ℃
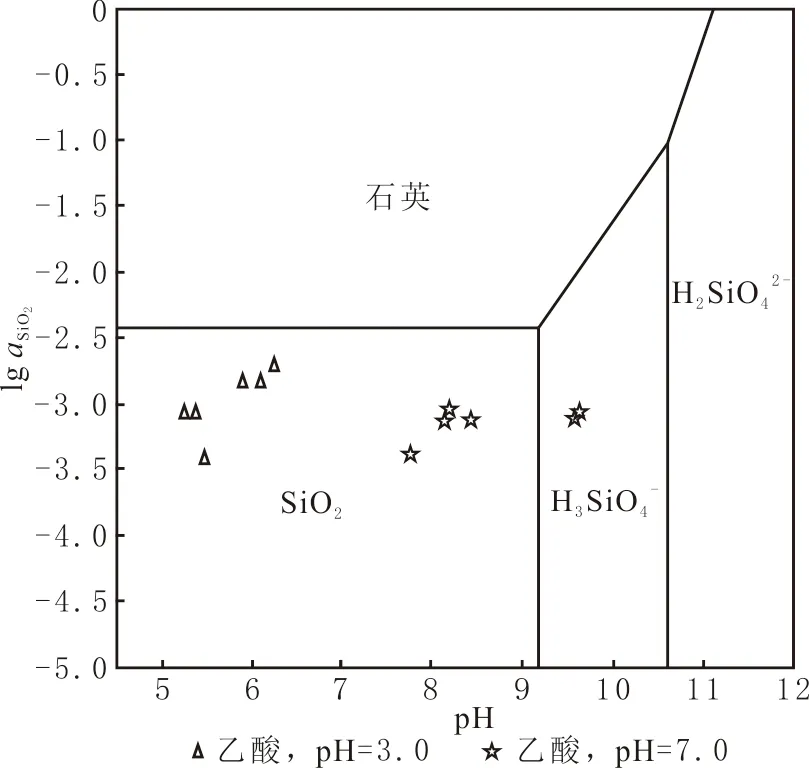
图7 200 ℃温度时Si离子形态分布随pH变化曲线Fig.7 The morphology distribution of Si ions changes with pH at 200 ℃
由于不同pH离子的存在形式不同,导致长石的溶解度及长石向高岭石转化趋势存在差异。在中性及弱碱性条件下,矿物的溶解度要小于酸性条件的, pH=7.0的K+、Ca2+、SiO2浓度低于pH=3.0的。Al3+浓度表现不同,pH=7.0的Al3+浓度远高于pH=3.0的,是因为pH影响长石向高岭石转化的趋势,钾长石、钠长石的转化系数与pH之间的关系为抛物线型,在弱酸性条件下,转化系数最高,生成高岭石的比例高,相应溶液中的Al3+浓度较低;在碱性条件下,转化系数降低,生成的高岭石较少,溶液中Al3+的浓度较高,表现为溶液pH不同时溶蚀及二次矿物沉淀差异。
3.3 矿物溶解沉淀过程
长石和方解石矿物的溶蚀是一个动态的耦合过程[26-28],既有长石的溶解,又有二次矿物的沉淀,溶蚀过程较为复杂,利用 GWB12.0软件模拟计算长石矿物在不同反应时间内的饱和指数SI,结果见图8。

图8 矿物溶蚀过程饱和指数随时间变化曲线Fig.8 The change curve of mineral saturation index with time during mineral dissolution
由图8可以看出,在溶蚀过程中,钾长石和钠长石的饱和指数为负值。反应前72 h内,勃姆石、高岭石处于过饱和状态;反应216 h时,饱和指数为负值;反应816 h时,又变为过饱和状态。反应216 h内,勃姆石、高岭石可能形成二次沉淀;反应456 h内,伊利石处于不饱和状态,未能产生沉淀;反应816 h时,过饱和产生沉淀。
综合溶液中主要离子浓度变化、XRD谱、扫描电镜结果及饱和指数计算结果,实验主要发生方解石、钾长石溶解,钾长石溶解产生石英和高岭石或石英和伊利石的二次矿物沉淀,以及一些层状硅酸盐矿物[28],溶解沉淀过程见图9。
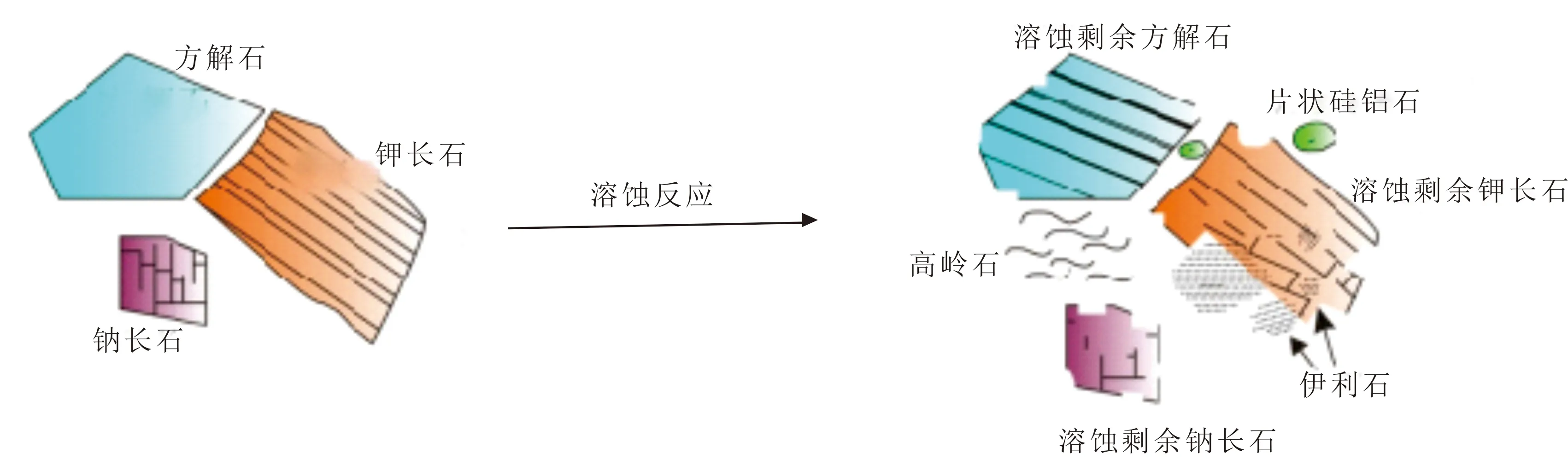
图9 长石与方解石混合矿物溶解沉淀过程Fig.9 Dissolution-precipitation process of mixed minerals of feldspar and calcite
钾长石的溶解主要通过消耗H+将SiO2和K+释放到溶液中,在反应釜中,SiO2和K+浓度增加,H+浓度降低。可以根据lgaK+/H+与lgaSiO2的比值随时间的变化,研究体系中硅铝酸盐矿物转化过程。利用GWB12.0软件模拟200 ℃温度条件下铝硅酸盐矿物相图(见图10),再结合实验的离子浓度变化数据,计算lgaK+/H+、lgaSiO2,并在相图中标记,表示乙酸溶蚀长石与方解石混合矿物溶蚀过程中二次矿物的转化过程。由图10可以看出,在实验反应时间内,二次矿物大多集中在勃姆石(AlO(OH))相区,极少部分在高岭石(Al2Si2O5(OH)4)相区,表明在长石溶解过程中,二次矿物由勃姆石向高岭石转化的趋势,与XRD谱(见图2)结果较为一致。
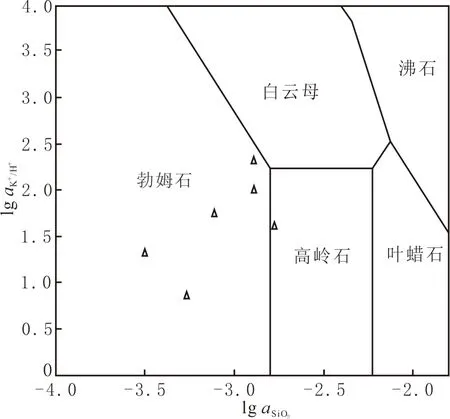
图10 硅铝酸盐矿物转化相图Fig.10 Diagram of silicoaluminate mineral transformation phase
综合实验及软件模拟结果,对矿物溶蚀过程进行阶段划分,长石与方解石混合矿物的溶解沉淀过程大致分为3个阶段,见表2。由表2可以看出,长石和方解石矿物与乙酸反应初始阶段(<12 h),由于方解石与长石相比更易溶解,主要表现为方解石快速溶解—长石缓慢溶解。随反应的进行(12~72 h),主要为富钙层状硅酸盐矿物沉淀过程。反应后期(72~816 h),长石大量溶解并伴随产生高岭石和伊利石次生矿物(长石快速溶解—方解石缓慢溶解阶段)。

表2 溶解实验各反应阶段及相应的主要反应
4 结论
(1)pH是影响长石和方解石选择性溶蚀的重要因素。pH=3.0与pH=7.0相比,方解石的溶蚀现象较长石的更为明显,出现阶梯状溶蚀现象。长石表面出现勃姆石、伊利石、层状硅酸盐矿物等二次矿物沉淀。pH=3.0,在216 h时溶蚀量占比最高,达到7.41%。中性条件下溶蚀量占比比酸性条件的小一个数量级,溶蚀量占比最高为0.92%, pH=3.0时的矿物溶蚀程度大,有利于矿物溶蚀。Si、Al在溶液中的存在形态随溶液pH的改变而发生改变,进而影响长石向高岭石等二次矿物的转化,从而影响矿物的溶蚀过程。
(2)长石和方解石矿物溶蚀过程可划分为方解石快速溶解—长石缓慢溶解阶段、层状硅酸盐矿物沉淀阶段、长石快速溶解—方解石缓慢溶解阶段。初始反应阶段方解石的溶蚀速率高于长石的两个数量级,随反应进行,方解石溶蚀速率大幅下降。方解石的溶蚀先强于长石,后长石的溶蚀处于优势地位。

