含噻吩结构的三嗪类紫外线吸收剂的合成及性能研究
崔新芳,杨 磊,高相南,蒋立坤,关 洋,马 林
(北京机电工程总体设计部,北京 100854)
三嗪类紫外线吸收剂具有光谱吸收广、高效、低色泽、稳定性好等特点,是紫外线吸收剂领域的研发热点[1-4]。当前,三嗪类紫外线吸收剂的研发方向主要有新结构化合物、多功能化和反应型等[1-7]。反应型紫外线吸收剂是近年研究热点之一。在三嗪结构上保留或引入反应基团,使其能接到高分子材料分子链上,达到零迁移的效果,从而大幅提升高分子材料的寿命[8]。
噻吩结构在有机光电材料中获得了大量的研究与应用[9-10]。噻吩基团的引入,既可以扩宽吸收范围,也可以增加摩尔吸光系数。鉴于上述特性,笔者将噻吩基团引入到三嗪类紫外线吸收剂的分子上,考察噻吩基团对三嗪类紫外线吸收剂的吸收光谱的影响。合成路线如图1所示。
1 实 验
1.1 含噻吩基团的紫外线吸收剂的合成
1.1.1 噻吩基溴化镁的合成
称取2.8 g(0.11 mol)金属镁加入到250 mL三口圆底烧瓶中,再加入10 mL无水四氢呋喃及一粒碘晶。在氮气保护下,将16.3 g(0.1 mol)2-溴噻吩溶于30 mL无水四氢呋喃中,于室温下缓慢滴加至三口瓶中。滴加完后升温至60 ℃,反应3 h。停止反应,得到的物质即为噻吩基溴化镁四氢呋喃溶液,备用。
1.1.2 2-氯-4,6-二噻吩基-1,3,5-三嗪(UV TC)的合成
在250 mL三口圆底烧瓶中装入9.2 g(0.05 mol)三聚氯氰及50 mL无水四氢呋喃溶液,再将上述噻吩基溴化镁四氢呋喃溶液加入到恒压滴液漏斗中,在室温下滴加入三口烧瓶中。滴加完后升温至60 ℃,反应5~6 h。停止反应。将反应液倒入氯化铵水溶液中,二氯甲烷萃取,有机相用无水硫酸钠干燥,过滤出旋蒸浓缩,柱色谱分离,得到白色固体UV TC 9.8 g,收率70.5%,备用。
1.1.3 4,6-二噻吩基-2-基-2-(2,4-二羟基)苯基-1,3,5-三嗪(UV T0)的合成
将9.0 g(32.17 mmol)UV TC、4.7 g(35.39 mol)无水三氯化铝、50 mL无水氯苯及3.7 g(33.78 mol)间苯二酚加入250 mL三口圆底烧瓶中,升温至85~90 ℃反应3 h,通过TLC监测至原料反应完全。反应结束后,将反应液倒入10%的稀盐酸中,充分水解后抽滤出黄色固体,柱层析分离,得到黄色固体9.8 g,收率86%,备用。
1.1.4 4,6-二噻吩基-2-基-2-(2-羟基-4-正辛基氧基)苯基-1,3,5-三嗪(UV T8)的合成
取3.0 g(8.49 mmol)UV T0、1.29 g(9.34 mmol)无水碳酸钾、1.8 g(9.34 mmol)溴代正辛烷及50 mLN,N-二甲基甲酰胺(DMF)加入100 mL三口圆底烧瓶中, 在100 ℃反应至原材料完全反应(TLC监测)后,停止反应。向反应液中加入蒸馏水,用二氯甲烷萃取,有机相再用水洗至pH=7~8,加入无水硫酸钠干燥。过滤掉硫酸钠,有机相用旋转蒸发仪浓缩,柱色谱分离,得到黄色固体粉末3.1 g,收率78.5%。

图1 含噻吩结构的三嗪类紫外线吸收剂化合物的合成路线
1.1.5 4,6-二噻吩基-2-基-2-(2-羟基-4-正己基氧基)苯基-1,3,5-三嗪(UV T6)的合成
取3.0 g(8.49 mmol)UV T0、1.29 g(9.34 mmol)无水碳酸钾、1.54 g(9.34 mmol)溴代正己烷及50 mLN,N-二甲基甲酰胺(DMF)加入100 mL三口圆底烧瓶中,于100 ℃反应至原料完全反应(TLC监测)。停止反应,后处理过程同1.1.4,得到黄色固体粉末3.2 g,收率86.5%。
1.1.6 4,6-二噻吩基-2-基-2-(2-羟基-4-正丁基氧基)苯基-1,3,5-三嗪(UV T4)的合成
取上述3.0 g(8.49 mmol)UV T0、1.29 g(9.34 mmol)无水碳酸钾、1.28 g(9.34 mmol)溴代正丁烷及50 mLN,N-二甲基甲酰胺(DMF)加入100 mL三口圆底烧瓶中,100 ℃反应至原料完成反应(TLC监测),停止反应。后处理过程同1.1.4,得到黄色固体粉末2.6 g,收率80.7%。
2 结果与讨论
2.1 结构表征
2.1.1 反应中间体的NMR
UV TC。1H NMR(400 MHz, CDCl3),δ: 8.28~8.29(d, 2H), 7.71~7.72(d, 2H), 7.23~7.25(m,2H);13C NMR(400 MHz, CDCl3),δ: 171.32, 169.06, 139.64, 134.06, 132.28, 128.81。
UV T8。1H NMR (400 MHz, CDCl3),δ: 13.08(s, 1H), 8.48~8.50(d, 1H), 8.25(d, 2H), 7.66~7.67(d, 2H), 7.23~7.25(m, 2H), 6.58~6.59(d, 1H), 6.51~6.52(s, 1H), 4.03~4.05(m, 2H), 1.83~1.85(m, 2H), 1.49~1.51(m, 2H), 1.33~1.39(m, 8H), 0.91~0.94(m,3H);13C NMR(400 MHz, CDCl3),δ: 170.85, 165.19, 164.29, 132.74, 131.87, 131.33, 128.63, 110.16, 108.32, 101.74, 68.31, 31.84, 29.38, 29.26, 29.12, 26.04, 22.68, 14.12。
UV T6。1H NMR(400 MHz, CDCl3),δ: 8.50~8.51(d, 1H), 8.26(d, 2H), 7.67~7.68(d, 2H), 7.24~7.25(m,2H), 6.59~6.60(d, 1H), 6.53(s, 1H), 4.04~4.06(m, 2H), 1.82~1.87(m, 2H), 1.48~1.53(m, 2H), 1.37~1.40(m, 4H), 0.94~0.96(m,3H);13C NMR(400 MHz, CDCl3),δ:170.86, 165.22, 164.30, 132.79, 131.91, 131.34, 128.65, 110.15, 108.35, 101.76, 68.32, 31.59, 29.08, 25.70, 22.62, 14.05。
2.1.2 目标化合物UV T4的NMR
UV T4。1H NMR(400 MHz, CDCl3),δ: 13.07(s, 1H), 8.47~8.49(d, 1H), 8.24(d, 2H), 7.66~7.67(d, 2H), 7.23~7.24(m, 2H), 6.57~6.59(d, 1H), 6.51(s, 1H), 4.04~4.06(m, 2H), 1.80~1.85(m, 2H), 1.53~1.58(m, 2H), 0.94~1.05(m, 3H);13C NMR(400 MHz, CDCl3),δ: 170.83, 165.18, 164.28, 132.73, 131.87, 131.32, 128.62, 110.16, 108.30, 101.73, 67.97, 31.16, 19.25, 13.87。
由氢谱可见,噻吩环上3位的H,化学位移都在7.67~7.68,为双峰;4位的H化学位移在7.24~7.25,为三重峰;5位的H化学位移在8.24左右,为双峰;苯环上,3位的H化学位移在6.3左右,为单峰;5位的H化学位移在6.59~6.60,为双重峰;6位的H化学位移在8.50~8.51,为双重峰;酚羟基的化学位移为13.03,单峰;与苯环相连的烷氧基上,与氧原子相连的亚甲基的H,化学位移在4.03~4.05,多重峰;其余碳链上的H,化学位移均在2.0以下。
对于碳谱,上述3个化合物在化学位移77以上,基本完全相同,均有10个峰,对应的是分子骨架上的10种碳原子。在化学位移77以下,主要区别是3个分子的烷基取代基长度不同导致的碳谱上碳的峰数不同,UV T8分子上含有长度为8个碳的烷基取代基,碳谱上在化学位移70以下,有明显的8个峰,而UV T6有明显的6个峰,UV T4有明显的4个峰,对应的分别是各自的烷基上的碳原子。
通过NMR分析,证明了目标化合物的结构是正确的。
2.1.3 红外光谱
采用红外光谱仪对结构进行了测试,见图2。
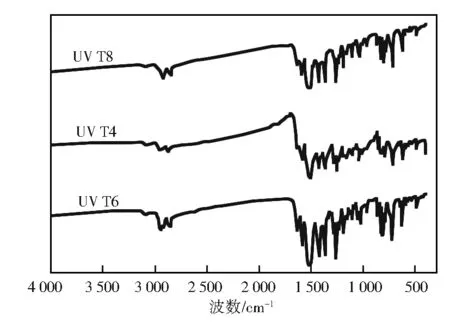
图2 UV T4~T8的红外光谱
图2中,波数3 068 cm-1处为间苯二酚结构苯环上C—H键的伸缩振动峰;2 920 cm-1处为烷基取代基上亚甲基的反对称伸缩振动峰,2 851 cm-1处为亚甲基的伸缩振动峰;1 200~1 300 cm-1处的峰为烷基与间苯二酚相连的C—O键伸缩振动峰。
2.1.4 紫外吸收光谱
紫外吸收光谱检测(图3)发现,UV T4~T8的光谱吸收范围几乎重叠均对280~360 nm的紫外光均有较强的吸收值,最大吸收波长达到319 nm,证明UV T4~T8具备紫外吸收的功能。

图3 UV T4~T8的紫外吸收光谱
将目标化合物的紫外吸收光谱与目前商业化的三嗪类紫外线吸收剂(UV 1577与UV 1164)进行了对比,结果见图4。
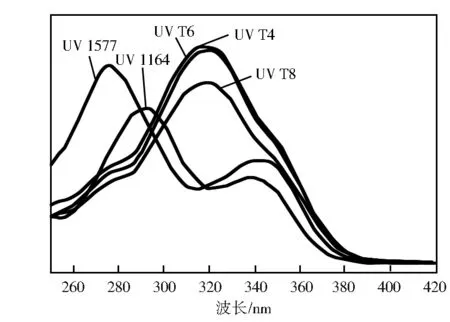
图4 UV T4~T8与UV 1577、UV 1164的紫外吸收光谱
与UV 1164和UV 1577相比,UV T4、UV T6和UV T8的最大吸收波长均具有较大的红移,UV 1577最大吸收波长275 nm,UV 1164最大吸收波长290 nm,UV T4-T8最大吸收波长达到了319 nm;另外,UV T4-T8在300~400 nm都具有比UV 1577、UV 1164更高的摩尔吸光系数,使其可能成为更高效的紫外线吸收剂。UV 1577、UV 1164的结构见图5。

图5 UV 1577和UV 1164的化学结构
2.1.4 热重分析
采用热重分析仪对3个目标化合物的热稳定性进行了研究,并将其与UV 1577、UV 1164的热稳定性进行了对比,热失重曲线见图6。
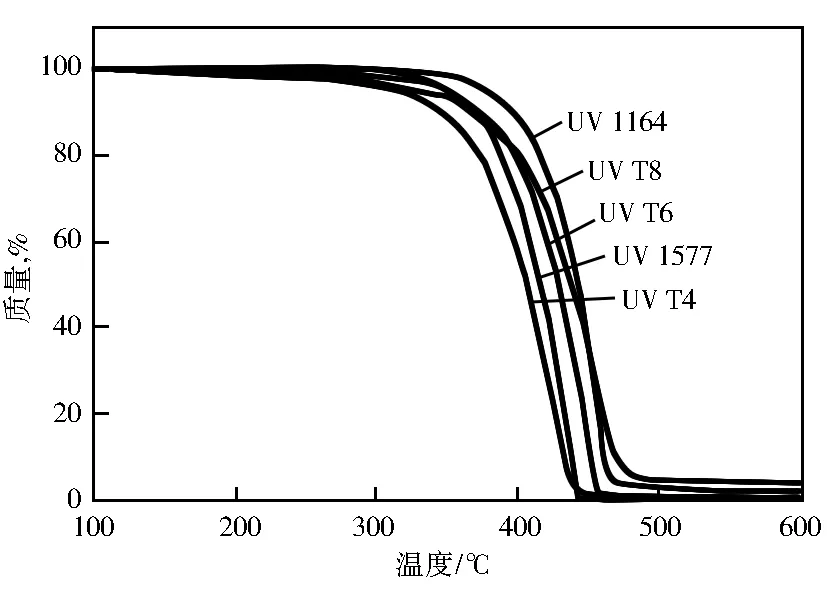
图6 UV T4-T8及UV 1164、UV 1577的热失重曲线
从图6可见,3个目标化合物UV T4、UV T6和UV T8,失重1%时的温度均大于300 ℃,350 ℃下的热失重为5%~10%。可见,从热稳定角度来看,3个目标化合物可以适用于大多数高分子材料中,在成型加工的过程均能保持良好的热稳定性。
2.2 应用性能
将100份的聚对苯二甲酸乙二醇(PET)颗粒分别与0.5份的UV T4、UV T6、UV T8、UV 1577及UV 1164进行充分混合,再经注塑机注塑成标准样(混合和注塑温度均为285 ℃)。标准样进行初始黄值检测后进行光老化测试(Q-UV),测试时间400 h,测试结束后检测样本的透光率(检测波长为400 nm),检测数据见表1和表2。

表1 标准样的初始黄值
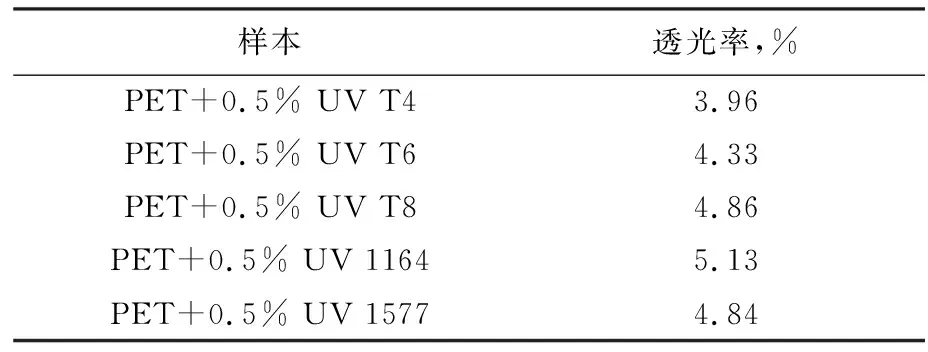
表2 标准样经400 h老化测试后的透光率
由表1和表2可知,UV T4、UV T6、UV T8 3个化合物加入到PET中后,样本的初始黄值与UV 1577、UV 1164加入到PET中的初始黄值都比较接近,其中加入UV T8的样本表现出了比UV 1577更佳的应用效果。经过400 h的光老化后,加入UV T4、UV T6的样本的透光率比其他3个样本稍低,而加入UV T8的样本表现出了与UV 1577、UV 1164相当的应用效果。数据表明,目标化合物UV T4、UV T6和UV T8都具有较好的应用前景。
3 结 论
a.通过三步反应将噻吩结构引入到三嗪类紫外线吸收剂分子结构中,合成了3个新的紫外线吸收剂UV T4、UV T6和UV T8,并通过核磁共振和红外光谱对3个化合物的结构进行了鉴定。
b.3个目标化合物的最大吸收波长相对于商品三嗪类紫外线吸收剂UV 1577、UV 1164具有30~40 nm的吸收红移,且摩尔吸光系数有明显提高。热重分析表明,3个目标化合物在300 ℃以下具有非常好的热稳定性,热失重率小于1%;350 ℃左右,热失重率达到5%~10%,热稳定性好,并且3个目标化合物具有较好的紫外线吸收剂功能,具有一定潜在应用价值。

