复杂肾结石患者行经皮肾镜、输尿管软镜单一及联合治疗效果、炎症指标及安全性对比研究
刘旭东,杜 勇,李志远,何正宇
(四川省雅安市人民医院,四川 雅安 625000)
肾结石为临床中常见上尿路结石,根据部位、成分不同,治疗方式也不同[1]。复杂性的肾结石直径超过2.0 cm,结石分布广、数目多,在临床治疗中无法通过单次手术完全清除,而多次手术治疗会增加对患者的身体创伤[2]。随着微创理念的技术不断完善发展,对于肾结石的治疗也逐渐倾向于内镜治疗。微创经皮肾镜在复杂性肾结石治疗中被广泛使用,其临床疗效明显优于传统切开取石手术,但在使用过程中也发现,肾镜的活动性差,在治疗过程中存在一定的难度,同样无法提高一次性肾结石的清除率[3]。输尿管软镜相比硬镜更柔软,可降低手术过程中对周围肾脏组织损伤,也可达到肾盏的更深部位,对于复杂性肾结石处理效果更佳[4]。本研究对比分析经皮肾镜、输尿管软镜单一及结合对复杂性肾结石患者的临床疗效,旨在为临床治疗提供新参考方向。
1 资料与方法
1.1 一般资料2016年1月至2020年12月我院收治的复杂肾结石患者158例。纳入标准:①在我院行超声、CT确诊;②知情且同意;③均为单侧结石;④首次接受治疗。排除标准:①肾功能异常;②处于月经期或妊娠期女性;③泌尿系统感染者;④凝血功能障碍者。根据医嘱及患者意愿选择治疗方式,经皮组(经皮肾镜)49例,其中男34例,女15例;年龄25~68岁[(40.36±5.78)岁];结石直径(3.22±0.85)cm;类型:鹿角型结石28例,肾盂结石17例,肾盏多发结石4例。软镜组(输尿管软镜钬激光碎石术)53例,其中男36例,女17例;年龄24~68岁[(41.25±5.66)岁];结石直径(3.24±0.65)cm;类型:鹿角型结石31例,肾盂结石19例,肾盏多发结石3例。联合组(经皮+软镜)56例,其中男38例,女18例;年龄25~69岁[(41.24±5.21)岁];结石直径(3.26±0.71)cm;类型:鹿角型结石35例,肾盂结石16例,肾盏多发结石5例。三组一般资料比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准通过。
1.2 方法三组患者在手术前均使用抗生素预防治疗,在全身麻醉满意后进行手术治疗。经皮组使用输尿管硬镜置入膀胱行手术侧输尿管导管置入,注入生理盐水造成人工肾积水,使用阴道B超,从患者11肋骨中刺入,以到达肾盏为主,并进行扩建,建立好取石通道,清除完毕后留置 F5 输尿管支架管、导尿管等。
软镜组术前7~14 d,经膀胱镜或输尿管镜在手术侧留置输尿管支架管。手术时患者取截石位, 使用输尿管硬镜置入膀胱并取出术侧输尿管支架管,再向术侧输尿管内置入两根超滑导丝,输尿管硬镜在超滑导丝引导下探查术侧输尿管至肾盂,退出输尿管硬镜,沿超滑导丝置入 F12/14 输尿管软镜引导鞘至输尿管上段,输尿管软镜经引导鞘置入肾盂,在目标肾盏寻找结石,使用200 μm光纤连接钬激光机,选择功率(0.8~1.5)J/(20~30)Hz,将结石粉碎至3 mm 以下,碎石结束后留置 F5 输尿管支架管、导尿管。联合组先按经皮组方法治疗,清除可视范围内的结石,术中超声检查发现可视范围外结石,置入输尿管软镜探查各肾盏内残留结石,采用钬激光粉碎可视范围外结石。三组术后视具体情况给予抗感染治疗3~7 d。
1.3 观察指标①记录手术指标及清石率。术中出血量、排气、手术以及住院时间。清石情况于术后1月采用CT、B超了解。②肾功能指标。肌酐(Scr)、尿素氮(BUN)、胱抑素C(CysC)。在手术前及术后1个月在收取患者静脉血液5 ml,使用全自动生化分析仪进行检查,仪器及试剂均为本院检验科提供。③炎症指标。包括降钙素原(PCT)、超敏C反应蛋白(hs-CRP)、白介素-13(IL-13)。在手术前及术后1个月在患者空腹状态下抽取静脉血液4 ml,使用3000 r/min离心机离心10 min后获取上清液,使用酶联免疫法进行检测。④术后并发症情况,包括出血、感染、尿瘘、输尿管损伤等。
1.4 统计学方法采用 SPSS 20.0统计学软件处理数据。计量资料采用均数±标准差描述,组间比较采用方差分析;计数资料以率或构成比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组手术指标、清石率比较联合组手术时间、术中出血量、排气时间、住院时间均少于经皮组,多于软镜组;清石率高于经皮组及软镜组(P<0.05)。见表1。

表1 三组手术指标及清石率比较
2.2 三组肾功能指标比较治疗后各组肾功能指标水平均降低,经皮组Scr、BUN、CysC最高,联合组Scr、BUN、CysC低于经皮组与软镜组(P<0.05),见表2。
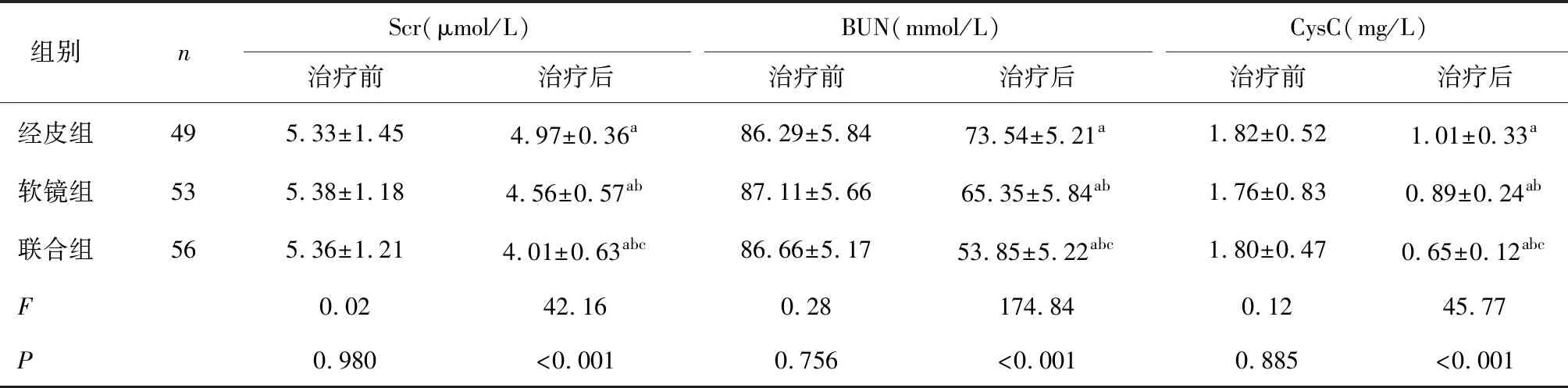
表2 三组肾功能指标比较
2.3 三组炎症指标比较治疗后各组PCT、IL-13、Hs-CRP水平升高,联合组治疗后PCT、IL-13、Hs-CRP水平高于软镜组,低于经皮组(P<0.05)。见表3。

表3 三组炎症指标比较
2.4 三组治疗后并发症情况比较联合组与经皮组并发症总发生率明显低于软镜组(χ2=4.25,χ2=4.60,P<0.05),联合组和经皮组间比较差异无统计学意义(P>0.05)。见表4。

表4 三组并发症发生情况比较[n(%)]
3 讨论
复杂性肾结石可分为完全或不完全性多发性肾结石、鹿角型肾结石等,此类结石的复杂程度与尿路感染、肾功能等、结石的形状、位置、大小等因素有关[5,6]。开放性手术治疗为肾结石的传统治疗方法,但由于此方法需要将患者的肾实质切开,造成患者机体损伤大,且结石的清除率低,并发症多,在临床中使用价值受限[7]。
经皮肾镜技术已被广泛使用于临床,在欧洲与美国的泌尿外科学会均将此法作为复杂性肾结石的首选治疗方式[8,9]。在临床实践中发现,在使用经皮肾镜治疗过程中由于人体肾脏结构复杂以及结石的分布情况均会对手术造成一定的影响[10]。有研究发现,单一通道的经皮肾镜碎石、取石无法发现所有结石并将其完全清除,可使用多通道进行治疗,但可使手术风险与肾脏损伤率增加[11]。输尿管软镜第一次在临床中的使用是在1964年用于肾结石的检查中,随后输尿管软镜碎石术被逐渐应用于肾结石的治疗中[12,13]。输尿管软镜在肾结石的治疗过程中由于软镜具有灵活性,且无需建立通道,可减少手术的创伤性,有利于患者恢复[14]。但对治疗复杂性肾结石治疗的时候,需要指导其分期,才可达到一定的治疗效果,但这样会增加患者经济负担,而在临床中认为对于肾结石>2 cm需经皮肾镜治疗,<2 cm结石则以输尿管软镜治疗为主。有研究发现经皮肾镜+输尿管软镜治疗可有效提高复杂性肾结石清除率[15]。本研究发现,联合组清石率高于经皮组及软镜组,在患者耐受的情况下,两者联合治疗可提高结石清除率,临床效果佳[16]。联合组手术指标恢复比经皮组更好,长于软镜组可能与联合治疗需进行两种手术所需时间以及所进行的手术操作较多有关。两种手术均为侵入性操作,为降低围手术期感染风险,本研究中患者均再同期使用联合治疗。
Scr可反映肾脏排泄功能,其表达上升可预示者肾功能受到损伤;BUN为蛋白质产物,在肾小球滤过能力降低超过50%时,BUN水平可明显升高;CysC则是肾脏早期损伤的有效指标,三者表达水平升高反映肾功能受损[17,18]。在本研究中三组治疗后三因子水平均降低,联合组Scr、BUN、CysC明显低于经皮组与软镜组,三组中以经皮组水平最高,提示利用双途径趋势效率高且可降低术中的肾脏损伤,对预后有积极影响。手术治疗可引发患者全是应激反应,在后续结石残渣排除的过程中可造成尿路感染,会加重患者炎症反应[19]。在炎症因子指标中对比发现,治疗后各组PCT、IL-13、hs-CRP水平升高,而联合组治疗后PCT、IL-13、hs-CRP表达水平高于软镜组,但显著低于经皮组,分析只要是手术治疗均可影响机体,而联合治疗影响要低于经皮组得利于软镜治疗时对患者软镜操作损伤较小,经皮治疗的操作途径与两组相比在腰部形成伤口对身体损伤较大[20,21]。三组并发症中比较以软镜组最高,同以往研究[22],分析与单用软镜治疗过程中为避免结石被冲回肾脏需要控制水流量,在术中的视野相比另外两组较为模糊,医生会增加水压力和液体量,但此操作极易应答肾盂内高压,不仅会出现将碎石冲散,增加清石难度,还可导致污染的液体逆流进入血液,从而增加术后感染风险。同期两种方法联合治疗不必一味追求利用输尿管软镜达到清石的目的,可有效避免术后肾功能损害、感染等并发症发生。
综上所述,复杂性肾结石,经皮肾镜联合软镜碎石效果优于两者单一治疗,可减少肾功能损伤,安全性高,具有一定的临床使用价值。
——可重复性或一次性输尿管软镜孰优孰劣?

