原儿茶酸通过促进线粒体活性氧堆积调控急性髓细胞性白血病细胞增殖与凋亡的作用机制研究
廖中廷,樊成伟,张发蓉,魏 静,殷世玉,胡琼英
(1.四川省资阳市人民医院血液内科,四川 资阳 641300;2.成都中医药大学附属医院检验科,四川 成都 610072)
急性髓细胞性白血病 (acute myelocytic leukemia, AML)是人骨髓髓系干细胞前体的恶性肿瘤,在成人急性白血病中最为常见[1]。随着蛋白组学、代谢组学和表观遗传学的发展,AML的靶向研究日益受到关注;最新证据表明,AML细胞对线粒体功能的依赖性是AML细胞异质性的能量来源,这一发现为AML的研究提供了新视角[2,3]。原儿茶酸 (protocatechuic acid, PCA)是原花青素、花青素等复合多酚类化合物的主要代谢产物,具有抗炎、抗氧化、抗癌等药理活性作用[4,5]。研究显示PCA可通过降低线粒体膜电位的消散、激活caspase-9和caspase-3及降低磷脂酰丝氨酸暴露,抑制过氧化应激诱导的血小板凋亡[6]。随着PCA抗肿瘤作用的研究进展,其在血液系统疾病中的应用日益引起人们的重视,但相关研究仍较少。本实验旨在探明PCA对AML细胞系HL60和KG-1α的细胞活性及线粒体功能的影响,以期为AML的发生提供新的证据,为AML靶向线粒体治疗提供新的候选药物。
1 材料与方法
1.1 材料本研究于2020年6~12月在成都中医药大学附属医院中心实验室完成,所需细胞和试剂分别为:人髓系白血病细胞系HL60和KG-1α(飞鸥尔生物,成都),细胞培养基MEM(Life Technologies,美国),澳洲胎牛血清(Gibco,美国),原儿茶酸(Sigma公司,美国)。
1.2 方法①细胞培养及CCK-8检测细胞活力。复苏HL60和KG-1α细胞后先加入含10%的胎牛血清培养基RPMI 1640,在37 ℃、5% CO2培养箱内培养3天后换液。对细胞悬浮、沉淀并计数,之后于96孔板上接种2×104个细胞/孔,加入不同浓度的PCA分别处理24 h后分析。为了检测细胞活性,96孔板上接种2×103个细胞/孔,与10 μmol/L PCA共同孵育,在1~5天内每天加入10 μl CCK-8试剂,4 h后检测OD450的吸光度并绘制生长曲线。②流式细胞术检测细胞周期。不同浓度的PCA分别处理HL60和KG-1α细胞24 h后,用溴化乙锭(PI)染色并进行流式细胞分析检测HL60和KG-1α细胞周期。③免疫印迹(Western blot)法分析细胞凋亡相关蛋白。用10 μmol/L PCA分别处理HL60和KG-1α细胞24 h后收集蛋白,应用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶分离20 μg总蛋白(细胞凋亡相关蛋白C-PARP、 C-Caspase-3和Caspase-3),先用PVDF膜转移免疫印迹,再使用5%的牛血清白蛋白PBS封闭;将1∶1000稀释后的抗体,加至PVDF膜,然后再室温孵育1 h。将PVDF膜用预冷的T-PBS清洗,再将1∶5 000稀释后的辣根过氧化物酶偶联抗兔二抗与PVDF膜室温孵育30 min,T-PBS清洗3次后,曝光。④细胞活性氧(Reactive oxygen species, ROS)检测。10 μmol/L PCA分别处理HL60和KG-1α细胞24 h,加入10 μmol/L MitoSOX荧光染料,在室温避光条件下孵育10 min,弃去上清液,再加入预冷的5 ml PBS清洗三次后用荧光显微镜观察。
1.3 统计学方法应用SPSS 18.0统计软件对数据进行分析。计量数据以均数±标准差表示,组间差异采用student-t检验和单向方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 PCA对AML细胞增殖活性的抑制情况细胞活力结果显示HL6和KG-1α细胞对PCA化疗敏感,PCA对HL60和KG-1α细胞作用的IC50分别是(21.73±0.2) μmol/L和(16.93±0.7) μmol/L;10 μmol/L PCA同时处理HL60和KG-1α 5天后,结果发现PCA可显著抑制细胞活力(P<0.05),见表1。

表1 PCA处理HL60和KG-1α细胞1~5天抑制细胞活力比较
2.2 PCA对AML细胞凋亡的促进情况流式细胞术检测细胞凋亡情况发现:与对照组相比,PCA处理组可显著促进AML细胞HL60和KG-1α凋亡,见图1;与之相似,在图2中,Western blot检测凋亡相关蛋白剪切形式的caspase-3(C-caspase-3)和PARP(C-PARP)在PCA处理组中明显增加。
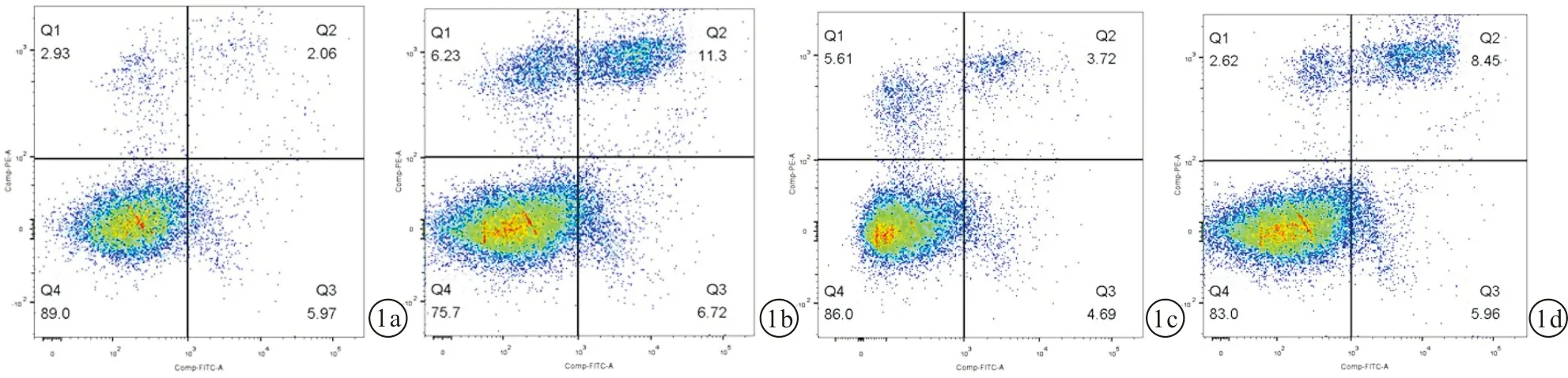
图1 PCA促进HL60和KG-1α细胞凋亡的流式细胞图 a:AML细胞系HL60对照组;b:20 μmol/L PCA处理AML细胞系HL60组;c:AML细胞系KG-1α对照组;d:15 μmol/L PCA处理AML细胞系KG-1α组
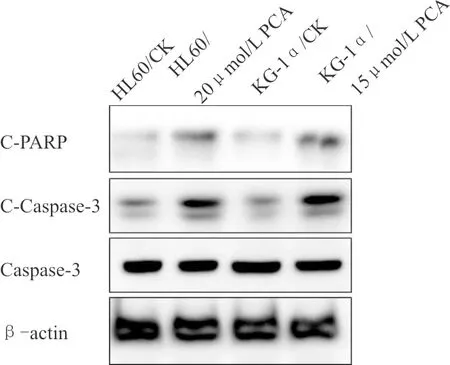
图2 PCA对AML细胞HL60和KG-1α促凋亡作用的蛋白免疫印迹图
2.3 PCA对AML细胞线粒体ROS堆积的促进情况对HL60和KG-1α细胞质ROS进行MitoSOX染色,结果表明:与对照组相比,PCA处理组细胞内的线粒体ROC堆积明显增多,加入ROS清除剂N-半胱氨酸(NAC)后,该现象被逆转,见图3;同时,流式细胞术检测细胞凋亡情况,发现NAC加入后,PCA引起的细胞凋亡下降。见图4。

图3 PCA促进AML细胞HL6和KG-1a线粒体ROS堆积的荧光显微图 a:AML细胞系HL60对照组;b:20 μmol/L PCA处理AML细胞系HL60组;c:20 μmol/L PCA处理AML细胞系HL60后+10 μmol/L NAC组;d:AML细胞系KG-1α对照组;e:15 μmol/L PCA处理AML细胞系KG-1α组;f:15 μmol/L PCA处理AML细胞系KG-1α后+10 μmol/L NAC组
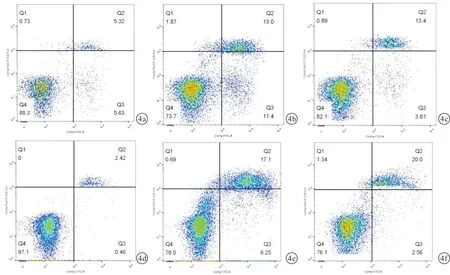
图4 PCA促进AML细胞HL6和KG-1a线粒体ROS堆积的流式细胞图 a:AML细胞系HL60对照组;b:20 μmol/L PCA处理AML细胞系HL60组;c:20 μmol/L PCA处理AML细胞系HL60后+10 μmol/L NAC组;d:AML细胞系KG-1α对照组;e:15 μmol/LPCA处理AML细胞系KG-1α组;f:15 μmol/L PCA处理AML细胞系KG-1α后+10 μmol/L NAC组
3 讨论
近年来AML的治疗取得了长足发展,但复发问题仍十分棘手。针对复发/难治性AML的治疗目前尚无标准,化疗是常见的治疗方案;含阿糖胞苷等新化疗方案虽可提高复发/难治性AML的缓解率,但OS获益仍小于1年;以FLAG方案为代表的化疗方案,治疗毒性较强,常伴有严重的血液学事件和感染[7,8]。目前学术界普遍认为HSCT是唯一具有治愈复发/难治性AML的潜在方法,但移植条件苛刻,移植后并发症难以控制[9]。新型靶向药物的出现为AML治疗提供了更多、更高效的选择,因此不断探索新的靶位点,成为AML治疗的研究热点[10]。
PCA是花青素的主要代谢产物之一,有较强的抗氧化活性[11]。Han等将PCA处理的内皮细胞与棕榈酸处理的细胞相比,发现PCA显著降低了内皮细胞氧化损伤的两个生物标志物3-硝基酪氨酸和8-羟基脱氧鸟苷,同时明显降低了细胞内ROS水平[12]。PCA也具有显著的肿瘤抑制作用,在一项结直肠癌的治疗研究中,研究者发现PCA通过氧化/抗氧化失衡,呈剂量依赖型显著降低结直肠癌的细胞活力;PCA在癌细胞中诱导了促氧化作用,通过调节氧化还原平衡和抑制HO-1系统导致p21激活介导结直肠癌细胞的凋亡[13]。已明确PCA的抗氧化功能和抗癌作用,但PCA在血液恶性疾病的作用研究报道较少,尤其是对线粒体的功能探索尚不明确,而后者对肿瘤的生存至关重要;目前靶向线粒体的抗肿瘤药物较多,但对于血液系统恶性疾病尤其是AML仍需探索筛选。
本研究通过探索PCA对AML细胞增殖、凋亡情况,揭示PCA对AML细胞活性的抑制作用。实验结果显示,与对照组相比PCA能显著抑制AML细胞HL6和KG-1a的增殖活性,同时促进HL6和KG-1a的凋亡,促进细胞凋亡相关蛋白的剪切。为了进一步阐释PCA抗肿瘤的机制,我们又检测了PCA作用AML细胞HL6和KG-1a后,细胞内线粒体的ROS变化情况,发现PCA的处理能引起细胞内ROS堆积,而这种现象可被ROS清除剂NAC逆转,且NAC的加入还能抑制PCA引起的HL6和KG-1a细胞凋亡。以上结果说明PCA引起的HL6和KG-1a细胞凋亡是通过增加细胞内线粒体ROS堆积造成。
综上,PCA抑制AML细胞活性是通过促进细胞内线粒体ROS生成所致,这与国内外已有的研究一致。通过明确PCA的抗AML作用,探讨其作用机制和靶点,可为AML的治疗提供新的思路。

