利用CRISPR/Cas9在人类黑色素瘤细胞中编辑MC1R与功能分析
张充,魏子璇,王敏,陈瑶生,何祖勇
利用CRISPR/Cas9在人类黑色素瘤细胞中编辑与功能分析
张充,魏子璇,王敏,陈瑶生,何祖勇
中山大学生命科学学院,有害生物控制与资源利用国家重点实验室,广州 510006
(melanocortin 1 receptor)基因编码黑皮质素1型受体,它在配体α-黑素细胞刺激素(α-melanocyte stimulating hormone, α-MSH)的刺激下,可促进细胞内cAMP (cyclic adenosine monophosaphate)的生成,从而激活PKA (protein kinase A system)信号通路,促进黑色素合成调控的关键转录因子–小眼畸形相关转录因子(microphthalmia-associated transcription factor, MITF),以及限速酶–酪氨酸酶(tyrosinase, TYR)的表达,进而调控真黑素和褐黑素的合成,影响动物的毛色表型。有研究表明,杜洛克猪() MC1R蛋白第6个跨膜结构域(transmembrane domain 6, TM6)发生了A243T突变,该突变可能影响MC1R蛋白生物学功能,被认为是导致杜洛克猪红毛表型的主要因素,然而却一直未被验证过。因此,本研究以单链寡核苷酸(single- stranded oligo-deoxyribonucleotides, ssODN)作为同源重组模板,利用CRISPR/Cas9技术在人类黑色素瘤细胞系SK-MEL-2中引入基因的c.727G>A (A243T)突变,以分析其对MC1R功能的影响。结果表明ssODN发生同源重组的效率可达10%。通过对共转染ssODN和CRISPR/Cas9表达载体的细胞进行筛选和培养,获得6个单克隆细胞株,进行测序鉴定,结果未能筛选到发生预期突变的单克隆细胞株,所有单克隆细胞株皆在目标位点周围出现突变。对转染后的细胞群进行功能分析,结果发现其cAMP信号强度、基因和基因表达量均显著低于未转染的细胞,表明编辑可影响细胞的黑色素合成功能。本研究为深入分析突变影响动物毛色提供了进一步的参考。
;基因定点突变;CRISPR/Cas9;A243T
毛色作为一种易于区分的性状,在家猪的遗传育种工作中起着重要的作用,可用于检验家猪群体纯度、鉴别遗传稳定性以及确定育种的杂交组合等。家猪群体的毛色表型丰富,主要包括野猪的野灰色、中国部分地方猪的纯黑色、杜洛克猪的全红色、大白和长白猪的纯白色、皮特兰猪的白底黑斑块和巴克夏猪的黑底白点型。目前研究表明,控制猪毛色遗传的基因座位主要有A、B、C、D、E、I、S、Be和He等[1~6],这些基因座中的基因表达情况会影响黑色素的种类以及黑色素在毛皮质和髓质中沉积的数量,进而影响动物毛色。
黑皮质素-1受体(melanocortin 1 receptor,)基因是位于E基因座上的等位基因,定位于家猪6号染色体的短臂末端,由单一的外显子组成。MC1R蛋白属于G蛋白偶联受体(G-protein coupled receptor, GPCR)家族成员[4,7],其天然配体是α-黑素细胞刺激素(α-melanocyte stimulating hormone, α-MSH)和促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)。当MC1R蛋白受体与配体结合时,G蛋白α亚基结合三磷酸鸟苷(guanosine triphosphate, GTP)而被活化,活化的α亚基与βγ亚基解离,进而激活细胞膜上的腺苷酸环化酶系统。在Mg2+存在的条件下,三磷酸腺苷(adenosine triphosphate, ATP)被转变为第二信使环腺苷酸(cAMP),cAMP与蛋白激酶A (protein kinase A system, PKA)调节亚基结合导致PKA催化亚基解离,PKA催化亚基进入细胞核,磷酸化基因调控蛋白使得基因表达上调[6],基因转录翻译小眼畸形相关转录因子,进而调控基因表达。基因转录翻译的酪氨酸酶能够催化酪氨酸形成真黑素和褐黑素,真黑素和褐黑素在细胞中的含量与分布使动物呈现不同的毛色。
有研究表明,红毛表型的杜洛克与黑灰色表型的野猪相比,其基因含有c.482C>T和c.727G> A两个突变位点,从而导致杜洛克基因翻译后第164位丙氨酸变成缬氨酸(A164V),第243位丙氨酸变成苏氨酸(A243T)[3,4](图1A)。A164V突变发生在保守位点,但在栗色马()和黑色马中都存在[8,9],因此人们推测该突变可能不影响基因的关键功能。而A243T突变发生在MC1R蛋白第6个跨膜结构域中的一个高度保守位置,被认为是影响基因功能发挥从而导致杜洛克红毛表型的关键突变位点[4],但目前未有相关功能验证的研究报道。人类()皮肤黑色素瘤细胞SK-MEL-2是从恶性黑色素肿瘤中分离出来的黑色素瘤细胞系,在配体α-MSH诱导下可以表达MC1R蛋白[10]。本研究在SK-MEL-2细胞中,使用一条靶向基因第243位密码子附近区域的sgRNA (short guide RNA),引导Cas9蛋白对DNA进行定点切割,造成DNA双链断裂(DNA double- stranded breaks, DSBs),同时提供含有c.727G>A突变的单链寡核苷酸做为同源重组的模板,最终在MC1R蛋白受体中引入A243T点突变,为后续验证杜洛克红毛表型的遗传机制提供参考。
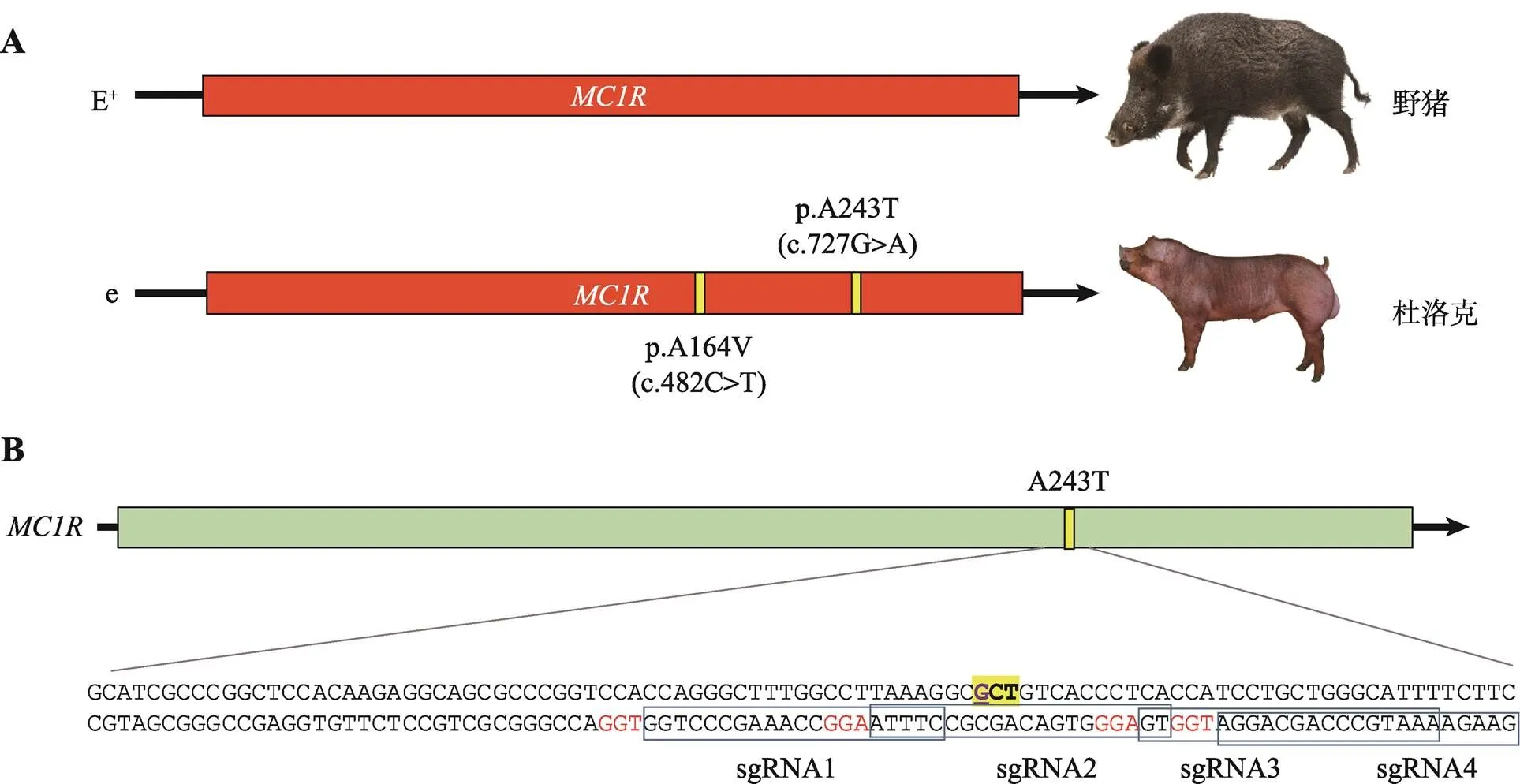
图1 杜洛克猪MC1R基因突变位点及靶向人类MC1R基因A243T位点的sgRNA示意图
A:野猪与杜洛克猪基因对比;B:靶向人类基因p.A243T(c.727G>A)位点的sgRNA。
1 材料与方法
1.1 材料
人类皮肤黑色素瘤细胞(SK-MEL-2, HTB-68)由广州博绍生物科技有限公司代理从ATCC (American Type Culture Collection)购入,pX458质粒(#72351)购自美国Addgene公司,pMD™18-T质粒(#6011)和DH5α大肠杆菌感受态(#CD201)分别购自日本TaKaRa公司和北京全式金生物技术有限公司,引物和ssODN由生工生物工程(上海)股份有限公司合成。
1.2 sgRNA设计和CRISPR/Cas9表达载体构建
将人类与家猪基因序列进行比对,在对应于杜洛克猪p.A243T (c.727G>A)突变位点(图1A) 的附近区域寻找PAM序列(5′-NGG-3′),并且在PAM序列上游选取20 bp序列作为sgRNA结合序列,共设计了4条sgRNA (图1B,表1)。用双蒸水将合成好的sgRNA单链粉末溶解为100 μmol/L的溶液。配置sgRNA磷酸化和退火的反应体系:正义链、反义链各1 μL,10×T4连接酶缓冲液1 μL,T4 PNK 1 μL,双蒸水补至10 μL。配置好的体系进行磷酸化和退火反应,反应程序:37℃ 30 min,95℃ 5 min孵育后,每分钟下降5℃退火,直至25℃。磷酸化退火后的双链片段采用酶切连接一体反应体系克隆至pX458质粒上,配置酶切连接反应体系:pX458 (200 ng/μL) 0.5 μL,退火产物与载体按照200∶1的比例稀释后加入2 μL,10×BbsⅠ Buffer 2 μL,Ⅰ酶1 μL,T4 Ligase 0.5 μL,双蒸水补至20 μL。反应程序:37℃ 5 min,21℃ 5 min,循环6次。将重组质粒转化到大肠杆菌DH5α,挑取克隆测序验证。

表1 sgRNA序列
1.3 ssODN设计
选择c.727G>A突变位点左右两侧各40 nt序列作为同源臂之外,还需将编码第243位丙氨酸的GCT转变为编码苏氨酸的ACT (图3A)。同时,为了避免发生同源重组后的序列被Cas9蛋白再次切割产生碱基插入或删除,通过同义突变引入188 I酶切位点,既破坏了PAM序列,又便于后续通过酶切方法检测同源重组结果。
1.4 细胞转染
胰酶消化细胞后1600 r/min离心3.5 min,用PBS悬浮计数,调整浓度为每100 μL体系有1×106个细胞,计数后再次离心去上清。加入NeonTM转染试剂盒(Thermo,美国)中的细胞重悬缓冲液R 100 μL,轻轻吹打均匀后加入10 μg质粒和10 μg ssODN,使用NeonTM转染仪,以1450 V、20 ms、2 pulse的参数进行电转染。电转染完毕,将细胞加到预热的含有10% FBS的RPMI培养基中,培养24 h后将细胞在荧光显微镜下观察并拍照记录。
1.5 流式分选EGFP强阳性细胞
电转染过的细胞培养48 h后,使用Beckman MoFlo Astrios EQs流式细胞仪分选EGFP阳性细胞。将相同培养条件下转染与未转染过的细胞分别用胰酶消化制成单细胞悬液,先用未转染的细胞作为阴性对照,建立分选参数。用流式细胞仪分选电转染后的细胞,将EGFP荧光强度最强1%的细胞群体分选出来,收集到加入适量培养基的24孔板中,37℃培养,供后续实验使用。
1.6 T7E1实验检测打靶效率
目的基因经PCR扩增后重新退火形成异源双链DNA,T7核酸内切酶1 (T7 endonuclease 1, T7E1)能够识别并切割不完全匹配的双链DNA,利用这个性质可以鉴定CRISPR/Cas9编辑形成的突变体,评估sgRNA打靶效率。PCR产物缓慢降温退火形成异源双链DNA,500 ng PCR产物加入0.5 μg T7E1酶,37℃孵育30 min。孵育完成后配置10%的PAGE胶,电压为120 V,电泳时长90 min,电泳完成后将PAGE胶在EB中染色15 min。T7E1酶切产物包含扩增出来的主要条带和经过酶切后断裂形成的另外两条较小的条带,经聚丙烯酰胺凝胶电泳,有3条大小不一致的条带,用ImageJ软件灰度扫描酶切条带,根据公式计算打靶效率。其中b、c为切割峰面积,a为主峰面积。
1.7 荧光定量PCR与Western blot检测
细胞RNA提取使用TRIzol试剂(Thermo,美国),用SYBR Green (Thermo,美国)进行荧光定量PCR,以、、基因的cDNA序列作为模板,以人的为内参,引物序列见表2。
细胞蛋白提取使用蛋白裂解液RIPA (每毫升RIPA含有10 μL 100×PMSF)吹打细胞,冰上孵育30 min后,14000×离心5 min取上清,用BCA试剂盒进行蛋白定量。定量好的蛋白加入5×SDS- PAGE蛋白上样缓冲液,100℃、10 min煮沸蛋白,进行SDS-PAGE电泳。采用半干转法将蛋白转移到PVDF膜上,用3% BSA溶液室温封闭1 h,4℃过夜孵育一抗(abcom 英国),TBST洗掉一抗孵育二抗(弗德生物杭州),二抗孵育完毕用TBST洗掉多余二抗,用ECL发光液在化学发光自显影仪检测蛋白条带并拍照。
1.8 cAMP值测定
采用GloSensor cAMP Assay试剂盒(Promega,美国)分析MC1R突变体在配体α-MSH刺激下对cAMP信号通路激活能力。其中cAMP含量的测定主要是依据人工突变的Photinus pyralis荧光素酶,该荧光素酶在与cAMP结合后,构象发生变化,促进光输出[11],从而可通过酶标仪进行测定。
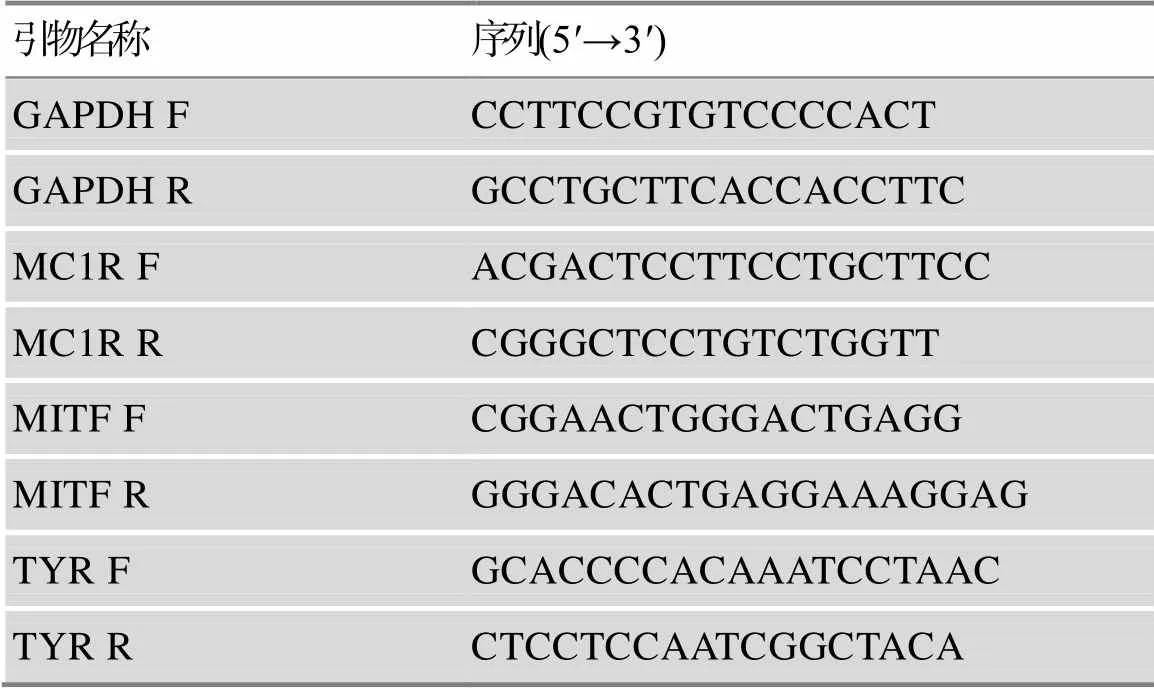
表2 荧光定量引物序列信息
采用脂质体转染法将pGloSensor-22F cAMP 质粒转入CRISPR/Cas9编辑过的细胞。当6孔板细胞密度达到80%~90%时,进行Lipo3000脂质体转染操作。实验组125 μL opti-MEM、7.5 μL Lipo3000以及2.5 μg pGloSensor-22F cAMP质粒混匀加入单个孔中,对照组125 μL opti-MEM和7.5 μL Lipo3000同样混匀加入单个孔中。待细胞长至70%~90%时,将细胞消化,离心弃上清,加培养基重悬细胞使得细胞浓度为1.5×105cells/mL,将细胞加入用于多标记检测的96孔板中,每个孔加入1.5×104个细胞,在培养箱中过夜培养。最后对细胞进行平衡与检测:移除96孔中的培养基,每孔中加入90 μL平衡培养基(88% CO2independent DMEM、10%血清和2% cAMP reagent),室温孵育2 h;酶标仪测得每个孔的稳态值之后,加入α-MSH (0.01 μmol/L)测定1 h之内每个孔的值,而Forskolin (10 μmol/L)作为阳性对照检测体系稳定。
1.9 统计分析
定量实验包括至少3个独立重复。数据以均数±标准差(SD)表示。采用检验或单因素方差分析,再进行Duncan检验。
2 结果与分析
2.1 sgRNA活性筛选
将靶向基因c.727G>A位点附近区域的4条sgRNA分别克隆到pX458载体中,转染人类黑色素瘤细胞系SK-MEL-2中,培养24 h后将细胞置于荧光显微镜下观察,可检测到一定比例的细胞表达绿色荧光蛋白(图2A)。继续培养24 h,流式细胞仪分选出绿色荧光强度最强的1%的细胞群体,提取基因组,PCR扩增,通过T7E1酶切实验检测sgRNA相应位点的打靶活性。ImageJ软件灰度扫描酶切条带,利用公式计算得出,sgRNA1、sgRNA2、 sgRNA3、sgRNA4 的活性分别为40.6%、9.1%、50.9%、50.5% (图2B),选择效率最高的sgRNA3进行后续实验。
2.2 A243T点突变效率鉴定
根据sgRNA3切割位点,设计携带c.727G>A突变的ssODN (图3A)。将sgRNA3/Cas9表达载体和ssODN共转染到人类黑色素瘤细胞SK-MEL-2中,培养24 h后,可以观察到一定比例的细胞表达绿色荧光蛋白(图3B)。培养48 h后,胰酶消化制成单细胞悬液,进行流式分析与分选。流式分析结果显示阳性细胞比例为43.1%,流式分选出荧光最强的1%的细胞进行后续实验(图3B)。分选出的细胞一部分以单个细胞接种至96孔板中进行单克隆细胞株筛选,另一部分接种至24孔板中用于分子鉴定与功能分析。24孔板中的细胞扩繁后,取部分细胞提取基因组,PCR扩增靶序列,克隆至T载体,转化后挑选细菌克隆进行测序分析。测定的30个克隆中,发生第243位编码位点的碱基插入或删除突变的有18个,效率为60%;基因发生c.727G>A突变的有3个,效率为10% (图3C)。96孔板培养的单克隆细胞扩大培养到12孔板时,最终获得6个单克隆细胞株,提取单克隆细胞株的基因组,PCR扩增后连接T载体测序,没有筛选出目标位点出现双峰的细胞株,6个单克隆细胞株的基因仅在目标位点周围出现套峰(图3D)。由于分选在24孔板的细胞编辑总效率为70%,后续实验利用该混合细胞群进行。
2.3 基因编辑对MC1R分子表达水平的影响
扩大培养总编辑效率为70%的混合细胞群,添加配体α-MSH,检测混合细胞群和未编辑细胞的MC1R蛋白表达情况。混合细胞群基因的mRNA和蛋白水平均显著下降(图4,B和C),表明在基因第243位密码子附近发生核苷酸替换、插入或删除可能破坏基因的正常表达。
2.4 编辑MC1R对cAMP-PKA信号通路的影响
为测定编辑后的基因对cAMP-PKA信号通路激活的影响,在混合细胞群和未编辑的细胞中添加配体α-MSH,检测细胞内cAMP含量、转录因子和催化酶的表达。采用GloSensor cAMP Assay试剂盒测定细胞中cAMP含量的动态变化。结果发现在配体α-MSH刺激下,未编辑细胞中cAMP含量从本底水平呈指数级上升,随着作用时间的延长,逐渐达到平台期,并缓慢下降。而发生基因编辑的细胞群中,cAMP含量基本维持在本底水平,远低于对照(<0.001) (图4A)。定量PCR和Western blot检测发现,cAMP-PKA通路下游的和表达量均发生显著性下降(图4,B和C),表明编辑基因可显著削弱黑色素细胞的cAMP-PKA信号通路激活功能,从而下调黑色素合成调控的小眼畸形相关转录因子,以及催化黑色素合成的酪氨酸酶的表达,进而影响动物的毛色表型。
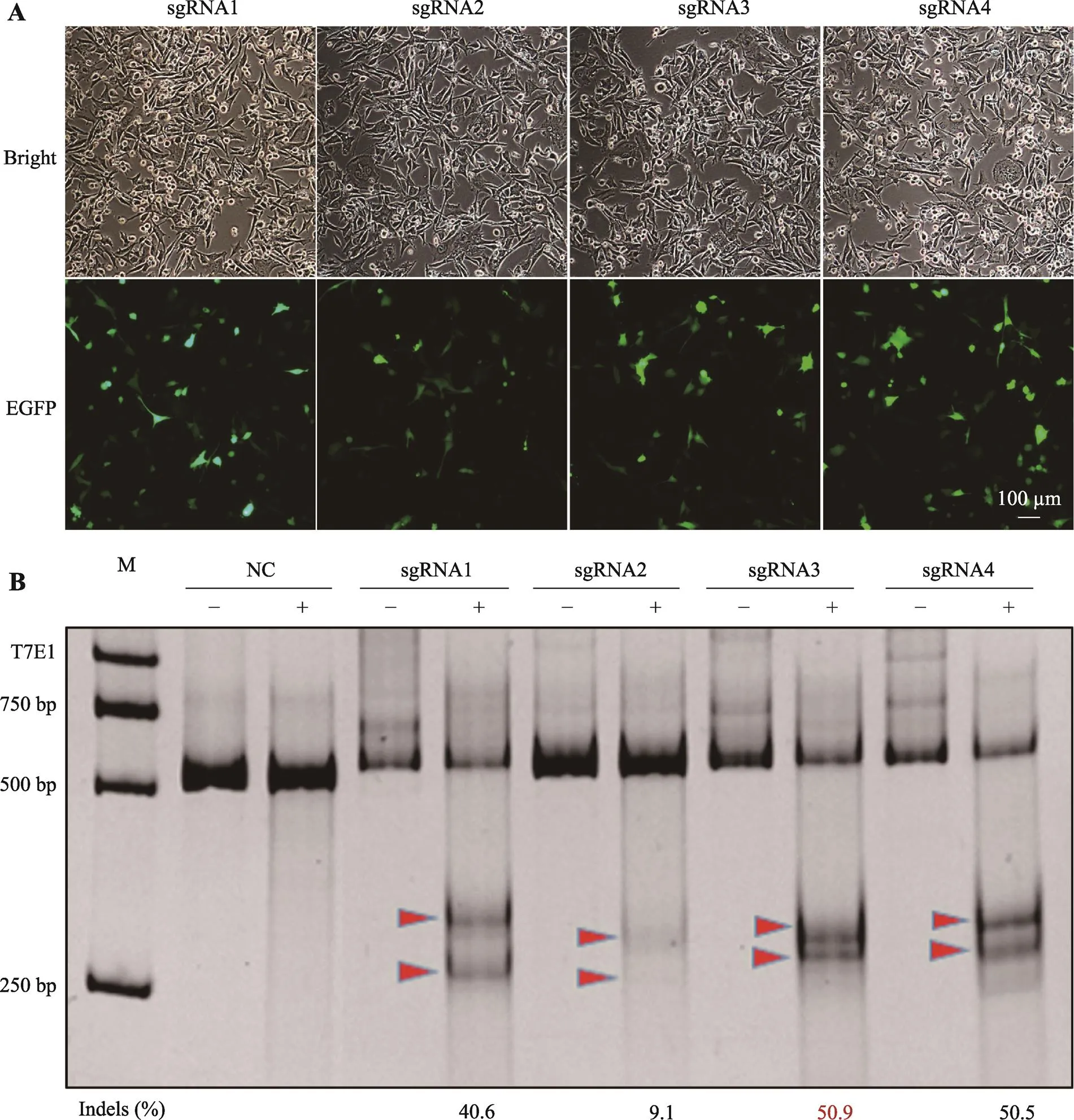
图2 细胞转染后荧光图与sgRNA活性筛选
A:细胞转染24 h后拍照;B:T7E1验证sgRNA效率(红色箭头表示酶切条带)。
3 讨论
本研究中靶向基因的sgRNA3效率为50.9%,基因发生c.727G>A突变的效率为10%,其同源重组效率与本研究团队前期在其他细胞系中获得的效率相当[12],然而此次培养获得的6个单克隆细胞株中却未鉴定到发生c.727G>A突变的细胞株,表明仍需通过优化参数来提高同源重组效率,从而筛选得到预期突变的单克隆细胞株。研究发现,在哺乳动物基因打靶系统中,ssODN的长度与重组效率有极高的依赖关系[13,14],而本研究中使用的ssODN长度仅80 nt,可能不是最优长度,今后可通过合成不同长度的ssODN,筛选重组效率最高的ssODN用于后续实验。据统计,ssODN与配对片段相比每增加0.6%的错配碱基,重组效率会降低20倍[14],本研究使用的ssODN含有3个错配碱基造成同源重组效率较低,因此设计ssODN时应减少错配碱基个数。此外,双链断裂后真核细胞中KU70和KU80形成的异二聚体与切割的DNA末端结合可促进非同源末端连接,抑制KU70和DNA连接酶IV的活性可使同源重组的效率提高4~5倍[15],同时添加小分子RS1可刺激双链交换[16],提高重组效率。应用流式细胞分选技术筛选单细胞过程中,应把前向散射光(forward scatter, FSC)和侧向散射光(side scatter, SSC)参数发生变化的细胞排除,减少状态不佳的细胞。在单细胞培养过程中,补充谷氨酰胺促进细胞生长[17]。通过以上方法可以最大限度提高同源重组的效率和筛选到目标单克隆细胞株的效率。
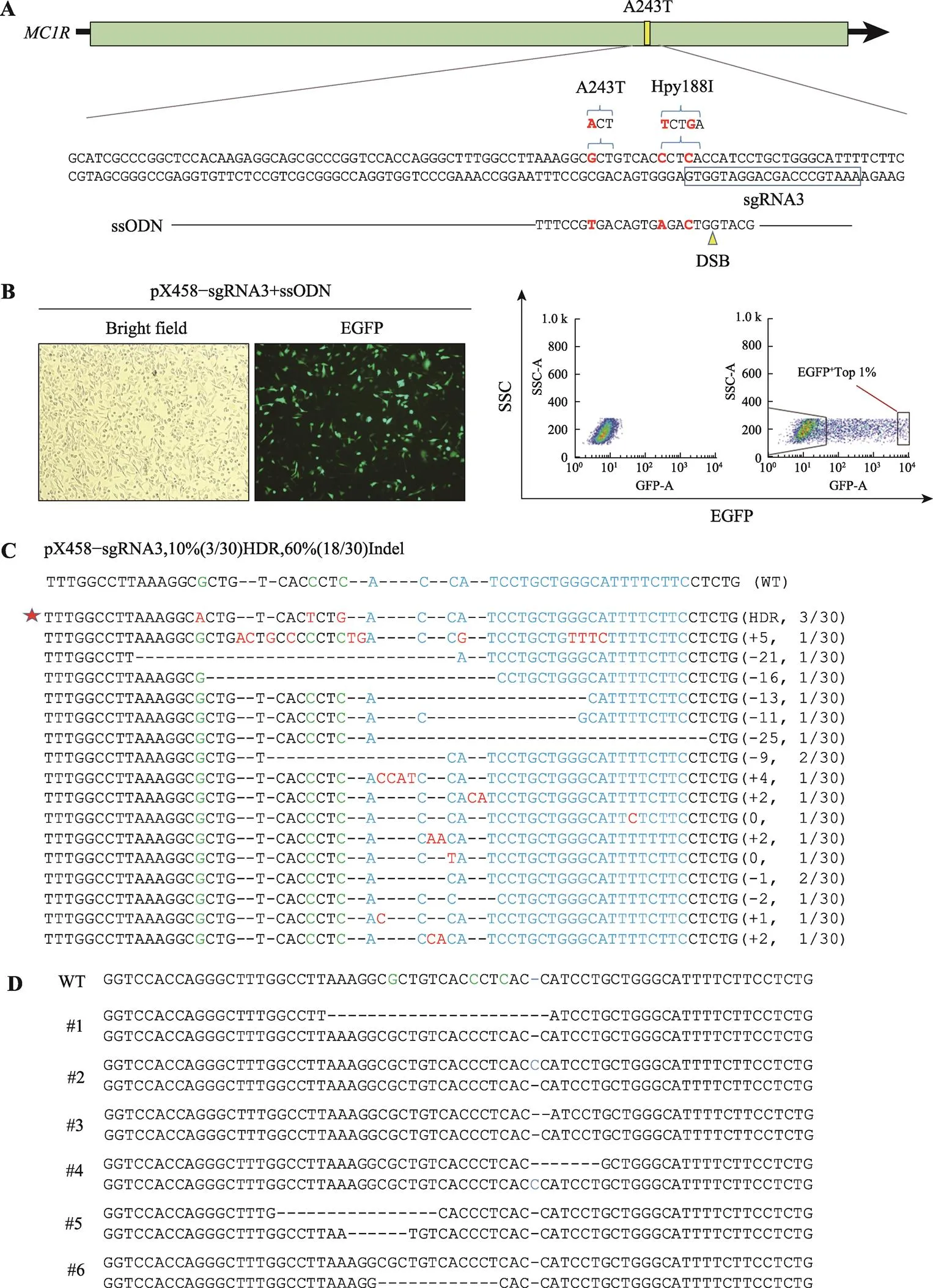
图3 ssODN结构示意图、流式分选GFP阳性细胞、编辑效率检测以及单克隆细胞株测序
A:ssODN和sgRNA示意图,设计ssODN需利用同义突变引入188 I酶切位点;B:细胞转染与流式分析;C:T-A克隆测定编辑效率;D:单克隆细胞株基因测序结果。
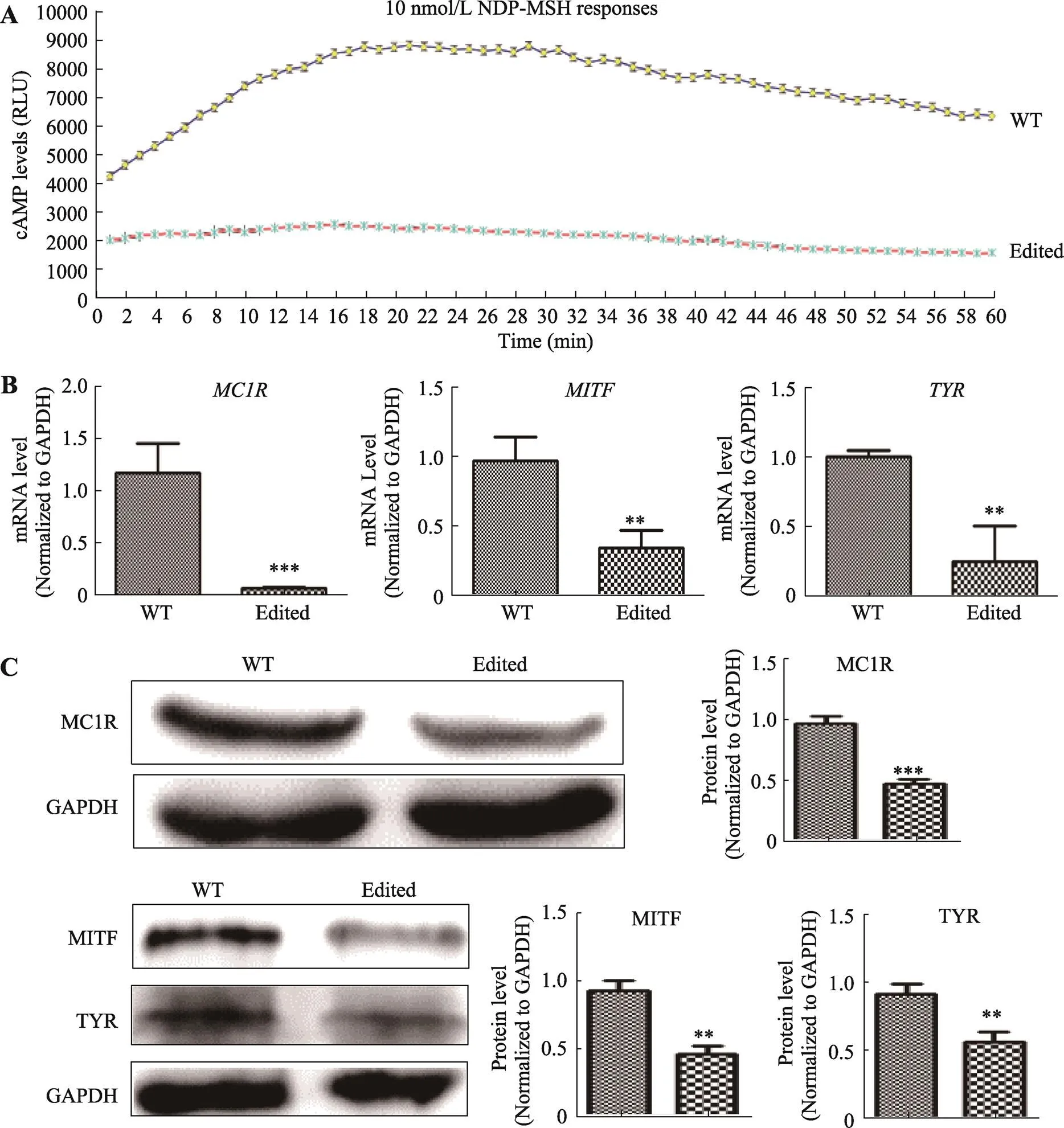
图4 MC1R基因表达和cAMP-PKA信号通路强度检测
A:细胞中cAMP值测定;B:mRNA表达水平检测;C:蛋白质表达水平检测;**:<0.01, ***:<0.001。
肿瘤细胞染色体拷贝数通常比较复杂,个别染色体有可能发生从亚二倍体到超四倍体的变异[18]。与猪不同,人类的基因定位在16号染色体上,测序结果显示6个单克隆细胞株的基因并没有2种以上的编辑结果(图3D),推测本研究使用的人类黑色素瘤细胞SK-MEL-2的基因是正常的二拷贝,与野猪和杜洛克猪的基因拷贝数相同。基因突变是隐性突变[19],等位基因的隐性突变导致MC1R蛋白数量与功能上丧失,没有足够数量的cAMP激活下游信号通路,酪氨酸酶数量减少,导致褐黑素无法完成真黑素的转化,这种突变已在栗色马、黄色的B6小鼠()、人类的红发与白皙皮肤中得到相关的证明[20]。
本研究分选获得基因编辑细胞群中c.727G>A突变的占10%,在第243位氨基酸编码区发生Indel突变占60%,总编辑效率为70%,该基因编辑混合细胞群适用于分析MC1R蛋白功能缺失对下游分子的影响。MC1R蛋白是A类G蛋白偶联受体超家族的成员[4],第243位疏水性的丙氨酸位于第3个胞内环结束与第6个α螺旋开始的交界处。当其被亲水性的苏氨酸替代时,α螺旋结构遭到破坏,影响第5和第6个跨膜螺旋间的胞内环结构,该胞内环上含有G蛋白结合位点,这可能影响MC1R与G蛋白的结合。基因第243位编码区核苷酸的删除,导致MC1R蛋白翻译提前终止,形成截短型的突变体。这两种突变形式都影响了MC1R蛋白受体胞内与G蛋白结合,配体α-MSH刺激下,突变的MC1R蛋白受体不能使G蛋白活化,从而影响细胞内cAMP生成和下游信号通路的激活[4,21,22](图5)。酪氨酸酶浓度较低时,不能催化多巴醌生成真黑素,而是在谷氨酰转肽酶的作用下生成褐黑素[23],褐黑素为溶于碱的圆形红色颗粒,能使皮肤或毛发表现为红色或黄色。
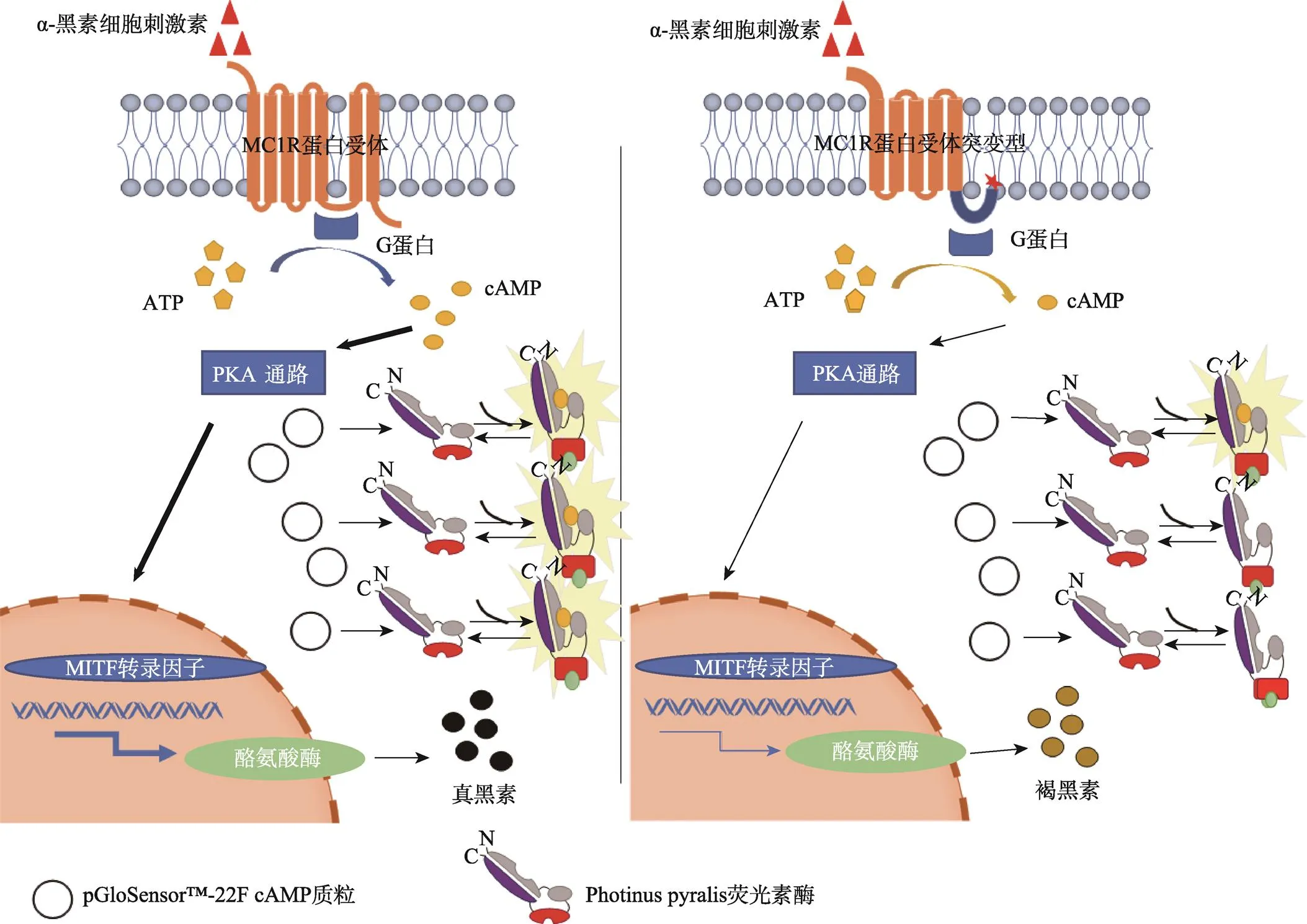
图5 MC1R突变体对cAMP-PKA通路影响
左:未编辑的细胞;右:基因编辑的细胞。
[1] Spillman WJ. Inheritance of color coat in swine., 1906, 24(614): 441–443.
[2] Marklund S, Kijas J, Rodriguez-Martinez H, Rönnstrand L, Funa K, Moller M, Lange D, Edfors-Lilja I, Andersson L. Molecular basis for the dominant white phenotype in the domestic pig., 1998, 8(8): 826–833.
[3] Kijas JM, Wales R, Törnsten A, Chardon P, Moller M, Andersson L. Melanocortin receptor 1 (MC1R) mutations and coat color in pigs., 1998, 3(150): 1177–1185.
[4] Wolf Horrell EM, Boulanger MC, D Orazio JA. Melanocortin 1 receptor: structure, function, and regulation., 2016, 7: 95.
[5] HETZER HO. Inheritance of coat color in swine; results of yorkshire by duroc-jersey crosses., 1947, 38(4): 121–124.
[6] Goding CR. Commentary. a picture of MITF in melanoma immortality., 2011, 30(20): 2304–2306.
[7] Neves SR, Ram PT, Lyengar R. G protein pathways.,2002, 296(5573): 1636–1639.
[8] Jacobs LN, Staiger EA, Albright JD, Brooks SA. The MC1R and ASIP coat color loci may impact behavior in the horse., 2016, 107(3): 214–219.
[9] Marklund L, Moller MJ, Sandberg K, Andersson L. A missense mutation in the gene for melanocyte-stimulating hormone receptor (MC1R) is associated with the chestnut coat color in horses., 1996, 12(7): 895– 899.
[10] Moro O, Ideta R, Ifuku O. Characterization of the promoter region of the human melanocortin-1 receptor (MC1R) Gene., 1999, 262(2): 452– 460.
[11] Fan F, Binkowski BF, Butler BL, Stecha PF, Lewis MK, Wood KV. Novel genetically encoded biosensors using firefly luciferase., 2008, 3(6): 346–351.
[12] Zhang K, Liu W, Liu XF, Chen YS, Liu XH, He ZY. Generation of cell strains containing point mutations in HPRT1 by CRISPR/Cas9., 2019, 41(10): 939–949.
张楷, 刘蔚, 刘小凤, 陈瑶生, 刘小红, 何祖勇. 利用CRISPR/Cas9系统构建人HPRT1基因定点突变细胞株. 遗传, 2019, 41(10): 939–949.
[13] Takita Y, Takahara M, Nogami S, Anraku Y, Ohya Y. Applications of the long and accurate polymerase chain reaction method in yeast molecular biology: direct sequencing of the amplified DNA and its introduction into yeast.,1997, 13(8): 763–768.
[14] Fujitani Y, Yamamoto K, Kobayashi I. Dependence of frequency of homologous recombination on the homology length., 1995, 140(2): 797–809.
[15] Chu VT, Weber T, Wefers B, Wurst W, Sander S, Rajewsky K, Kühn R. Increasing the efficiency of homology- directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells., 2015, 33(5): 543–548.
[16] Jayathilaka K, Sheridan SD, Bold TD, Bochenska K, Logan HL, Weichselbaum RR, Bishop DK, Connell PP. A chemical compound that stimulates the human homologous recombination protein RAD51., 2008, 105(41): 15848–15853.
[17] Newsholme P, Procopio J, Lima M M, Pithon-Curi, Curi TC, Curi R. Glutamine and glutamate--their central role in cell metabolism and function., 2003, 21(1): 1–9.
[18] Maja K, Sara B, Zuzana S. Modelling chromosome structural and copy number changes to understand cancer genomes., 2019, 54: 25–32.
[19] Robbins LS, Nadeau JH, Johnson KR, Kelly MA, Roselli-Rehfuss L, Baack E, Mountjoy KG, Cone RD. Pigmentation phenotypes of variant extension locus alleles result from point mutations that alter MSH receptor function., 1993, 72(6): 827–834.
[20] Healy E, Jordan SA, Budd PS, Suffolk R, Rees JL, Jackson IJ. Functional variation of MC1R alleles from red-haired individuals., 2001, 10(21): 2397–2402.
[21] Frändberg P, Doufexis M, Kapas S, Chhajlani V. Cysteine residues are involved in structure and function of melanocortin 1 receptor: substitution of a cysteine residue in transmembrane segment two converts an agonist to antagonist., 2001, 281(4): 851–857.
[22] Rosenbaum DM, Rasmussen SGF, Kobilka BK. The structure and function of G-protein-coupled receptors., 2009, 459(7245): 356–363.
[23] Ito S, Wakamatsu K, Ozeki H. Chemical analysis of melanins and its application to the study of the regulation of melanogenesis., 2000, Suppl 8: 103–109.
Editingin human melanoma cells by CRISPR/Cas9 and functional analysis
Chong Zhang, Zixuan Wei, Min Wang, Yaosheng Chen, Zuyong He
(melanocortin 1 receptor) encodes the melanocortin-1 receptor, which can activate intracellular cAMP synthesis under the stimulation of the α-melanocyte stimulating hormone (α-MSH) ligand. Increased cAMP then activates the protein kinase A (PKA) pathway, resulting in the up-regulation of the expression of the microphthalmia-associated transcription factor (MITF) which is a critical regulatory factor of melanin synthesis, and tyrosinase (TYR), the rate-limiting enzyme of melanin synthesis tyrosinase (TYR), and ultimately affects production of eumelanin and pheomelanin, and the coat color phenotype of mammalian species. Previous reports have indicated that the mutation A243T in the transmembrane domain 6 (TM6) of MC1R protein might disrupt the function of MC1R, contributing to the red phenotype in Duroc pig. However, functional analysis of the A243T mutation in MC1R has not yet been carried out. In this study, we attempted to used single-stranded oligo-deoxyribonucleotides (ssODN) as donor templates to introduce the c.727G>A (A243T) mutation intoin human melanoma cell line SK-MEL-2 by CRISPR/Cas9 to analyze its effects on MC1R functions. We found the occurrence of ssODN recombination reached to 10%. Unfortunately, Sanger sequencingin six single-cell clones revealed that none carried the c.727G>A mutation, but all carried undesired mutations surrounding the target site. Cells transfected with CRISPR/Cas9 plasmids and ssODN presented significantly attenuated cAMP activation, and down-regulatedandexpression, indicating that the editingcould affect the melanin synthesis function in cells. This study provides a basis for further investigation the mechanism ofmutation on animal coat color.
;site-directed mutagenesis; CRISPR/Cas9; A243T
2022-03-07;
2022-05-11;
2022-06-07
广东省重点领域研发计划项目(编号:2018B020203003),广东省自然科学基金项目(编号:2019A1515011134)资助[Supported by the Key R&D Program of Guangdong Province (No. 2018B020203003), and the Natural Science Foundation of Guangdong Province (No. 2019A1515011134)]
张充,在读硕士研究生,专业方向:生物化学与分子生物学。E-mail: zhangch359@mail2.sysu.edu.cn
何祖勇,博士,副教授,研究方向:动物遗传与育种。E-mail: zuyonghe@foxmail.com
10.16288/j.yczz.22-037
(责任编委: 谷峰)