泛素连接酶Brl2在DNA双链断裂修复中的作用分析
刘晓琴,常斐然,刘思杰,伍斐,孔道春
泛素连接酶Brl2在DNA双链断裂修复中的作用分析
刘晓琴1,常斐然2,刘思杰2,伍斐2,孔道春2
1. 山西大同大学脑科学研究所,大同 037009 2. 北京大学生命科学学院,北京 100871
组蛋白H2B单泛素化在基因转录、DNA复制及损伤修复中发挥着重要的调控作用。在裂殖酵母()中,Brl2作为一个泛素化连接酶,调节H2B的119位赖氨酸的单泛素化。目前,有关Brl2在DNA损伤修复中的作用研究较少,本研究利用药物喜树碱(camptothecin, CPT)处理裂殖酵母产生高毒性的DNA双链断裂(DNA double-strand breaks, DSBs),探索Brl2在DSB修复过程中的作用。研究发现,基因缺失的菌株对CPT高度敏感,并导致细胞内DNA自发重组频率下降。荧光分析表明Brl2和重组修复蛋白Rad52共定位到DSB处,且Brl2促进Rad52在DSB处的募集。在CPT产生的DSB条件下,Brl2会发生磷酸化。以上研究发现揭示了Brl2在DSB修复过程中起重要作用,为具体阐明Brl2在DNA同源重组及双链断裂修复的分子机制奠定了进一步研究的基础。
组蛋白H2B;Brl2;DNA双链断裂修复;喜树碱;裂殖酵母
DNA作为生物体生命的遗传物质,其完整性维持对细胞极其重要。外界环境与细胞内环境存在很多对DNA分子损伤和改变的因素,如紫外线、电离辐射、化学治疗药物、细胞代谢过程中产生的氧自由基、烷基化因子、以及复制压力等。如果DNA损伤没有得到及时有效地修复,就可能造成DNA分子可遗传的永久性序列改变,包括碱基损伤、DNA链间和链内的交联、DNA-蛋白质的交联、DNA单链断裂及双链断裂(DNA double-strand breaks, DSBs)等[1]。在这些损伤中,DSBs是对细胞毒性最大的一种DNA损伤[2]。据统计,人类的一个细胞每天可发生10~50次DSBs,而一个DSB如果没有得到修复,就可以破坏细胞基因组完整性,甚至导致细胞死亡[3]。保守的DSBs修复途径包括同源重组(homologous recombination, HR)修复和非同源末端连接(nonhomologous end joining, NHEJ)修复。HR修复需要一条姐妹染色单体作为模板,是准确的修复方式;而NHEJ是直接将断裂的两端连接起来,是一种易错修复模式。选择哪种方式对DSBs进行修复,受细胞周期、表观遗传和末端切除的方式等多种因素影响[4]。例如,HR修复主要发生在细胞周期的S末期和G2期,而NHEJ修复可发生在细胞周期的任一时期,但在G1期和S早期发生频率更高[3]。由核酸酶或电离辐射等产生的DSBs既可以由HR修复,也可以由NHEJ修复。DNA复制叉垮塌导致的DSBs主要由HR进行修复,因为复制叉的垮塌产生的是单末端的DSB;只有机体不能进行HR修复时,S期产生的DSBs才会选择使用单链退火的方式或者NHEJ方式进行不精确地修复[5,6]。喜树碱(camptothecin, CPT)是一种天然的抗肿瘤药物,它可以通过抑制拓扑异构酶Ⅰ的再连接反应稳定其与DNA形成的复合物,导致DNA单链的断裂。当正在合成的复制叉遇到这些DNA单链断裂时,便会导致DNA复制叉停滞和单末端DSB产生。CPT诱导的这种单末端的DSB代表了机体内常见的一种DSB产生方式,而且这种损伤多经HR进行修复[7]。
当细胞体内产生DSBs后,磷脂酰肌醇3-激酶信号通路被激活,主要激酶包括ATM激酶(ataxia telangiectasia mutated)、ATR激酶(ataxia telangiectasia and Rad3-related protein)和DNA-PKcs,从而停顿细胞周期、促进DNA修复或诱导细胞凋亡。其中,ATM和ATR主要介导HR修复,DNA-PKcs介导NHEJ修复。在裂殖酵母()中,ATM的同源蛋白Tel1主要识别DNA断裂末端,并与DNA核酸酶MRN (Mre11-Rad50-Nbs1)复合物相互作用,促进MRN-CtIP复合物对DNA末端的切割。MRN-CtIP复合物在DNA双链断裂处进行5′→3′的碱基切除,产生3′-单链DNA。在末端碱基切除去掉5′-链几千到几万个碱基的过程中,RNA聚合酶III被MRN募集到DNA断裂处,以3′-链为模板进行RNA合成,并形成RNA-DNA杂交链以保护3′-链不被降解[8]。复制蛋白A(replication protein A, RPA)结合到翘起的单链DNA结构上,并作为信号募集并激活ATR的同源蛋白Rad3,激活的Rad3通过磷酸化下游的Cds1激酶(人细胞中的同源蛋白Chk2)停顿细胞周期及稳定停顿的复制叉[9,10]。之后,RPA会被Rad52介导的Rad51所取代,形成Rad51核蛋白丝,促进下游的同源序列的寻找及替换[1]。
在裂殖酵母中,Brl2是一个E3连接酶,与Brl1,Shf1和Rhp6组成复合物HULC (H2B ubiquitin ligase complex),单泛素化组蛋白H2B的119位的赖氨酸。HULC位于异染色质区域,对染色质的结构具有重要的调控作用[11]。Brl1和Brl2在芽殖酵母中的同源物是Bre1,人细胞中的同源物分别为RNF20和RNF40。目前对这些E3连接酶的研究主要集中在它们对H2B的单泛素化(H2Bub1)方面。H2Bub1在真核生物中非常保守,在基因转录调控中的作用研究最为清楚:它能够调节核小体的组装,促进转录的延伸。近年来,H2Bub1在DNA复制和DNA损伤修复中的作用被逐渐挖掘[12]。在哺乳动物细胞中,电离辐射(ionizing radiation, IR)导致H2Bub1的含量增加。RNF20和RNF40可能作用在DNA损伤的早期来调控下游的HR及NHEJ通路。在IR诱导的DNA损伤修复中,RNF20/RNF40对H2Bub1的作用受激酶ATM和ATR共同调控[13]。但是,具体的H2Bub1在DNA损伤修复和复制中的作用依然有待被阐明。而且,有研究发现,缺失或敲降RNF20/40的表型与突变H2B 120位的赖氨酸表型并不完全相同,预示着除了泛素化H2B外,RNF20/40也存在其他的底物。例如,RNF20/40可单泛素化热休克转录因子eEF1BδL的381位的赖氨酸,从而调控一些热休克相关基因的表达[14]。
为了更进一步认识H2B的泛素化连接酶在DNA损伤修复中的作用,本研究利用裂殖酵母为研究对象,通过检测相关菌株对DNA损伤药物的敏感性、重组频率、Brl2与Rad52的共定位、Rad52聚集点数目及Brl2的磷酸化,发现Brl2在DSBs修复过程中发挥着重要的调控作用。当DSBs发生后,Brl2被募集到损伤位点,促进下游的重组修复蛋白Rad52在DSB处的富集,有利于DNA重组介导的DSBs修复。在该过程中,Brl2会发生磷酸化。在DNA重组调控的过程中,Brl2与Rad3在同一事件方面发挥作用。但是,在Rad3-Cds1体系缺失的菌株中,Brl2发挥负调控作用,缺失Brl2更有利于Rad3-Cds1缺失菌株在DNA损伤压力下的存活。
1 材料与方法
1.1 酵母菌株、培养基和酵母转化
本实验用到的裂殖酵母菌株及其基因型见表1。菌株的构建采用经典的同源重组方法[15]。酵母转化利用乙酸锂和PEG3350[16]。细胞生长的培养基主要有YES培养基:5 g/L酵母提取物,30 g/L葡萄糖,250 mg/L腺嘌呤,250 mg/L尿嘧啶,250 mg/L组氨酸和250 mg/L亮氨酸;EHLU培养基:在Edinburgh Minimal Medium (EMM)的基础上补充250 mg/L组氨酸,250 mg/L亮氨酸和250 mg/L尿嘧啶[17];EHALU培养基:在EMM的基础上补充250 mg/L腺嘌呤,250 mg/L组氨酸,250 mg/L亮氨酸和250 mg/L尿嘧啶;EHAL培养基在EMM的基础上补充250 mg/L组氨酸,250 mg/L亮氨酸和250 mg/L腺嘌呤。对应的固体培养基的制备为每升液体培养基中加入15~20 g琼脂粉(上述酵母提取物、葡萄糖和琼脂粉试剂购自太原瑞研科生物科技有限公司,其他试剂购自美国Sigma公司)。
1.2 梯度稀释打点实验
将待测试的酵母细胞培养至对数期,取样并调节各个菌体的数目一致,此为梯度稀释打点的第1个样品,之后,对其进行5倍梯度稀释,共稀释5次,依次取等体积菌液接种到含有不同药物的培养板上。紫外线处理时,菌株如上所述接种到不含药物的培养板上,使用UV仪器对菌株进行一定剂量的直接照射。最后,放入30℃培养箱中培养,3~4天后采集图像。

表1 本研究使用的菌株基因型
1.3 自发重组频率的检测
重组频率的检测使用YKM619菌种,该菌种含有两个ade非串联重复的异位基因(和),两个ade基因中间含有一个的标志基因。利用变异反应实验(fluctuation tests)进行自发重组频率(spontaneous recombinant frequencies)的测定[18]。使用野生型(WT) (YKM619)、()、(9)和()菌株,每个菌种挑取5个单克隆,划线于YES平板。30℃培养4 d,从板上挑取单克隆至灭菌水中,按每板约105~106个细胞的数量将细胞涂布至EHLU板,记为实验板。对应的细胞100倍稀释后,取等量体积菌液涂EHALU板,记为对照板。30℃培养4 d,统计实验板上的白色菌落数目和对照板上的单克隆菌落数目,计算自发重组频率。
1.4 Rad52与Brl2的共定位分析
构建C端带有YFP荧光的Brl2高表达质粒REP41-Brl2-YFP,并将其转入DY1012菌种中,涂布于含有5 μg/mL维生素B1 (thiamine, T)的EMM固体板上,30℃生长4 d,将菌落转移到5 μg/mL thiamine的EMM液体培养基中,培养到对数期,离心收菌,用灭菌水洗菌体3次后,将细胞转移到新鲜的不含有thiamine的EMM中,开始诱导表达。30℃培养14 h后收集样品,3000 r/min离心1 min,蒸馏水洗菌体1次,用预冷的70%乙醇固定细胞,之后通过Delta Vision Personal DV观察Rad52-CFP和Brl2-YFP是否发生共定位。
1.5 Rad52聚集点的采集与分析
在FY18445菌种的基础上,构建的缺失株。挑取新鲜的WT (FY18445)与(-FY18445)单菌落于YES液体培养基中,长至对数期,分别收取5 OD细胞,3000 r/min离心1 min,弃上清后蒸馏水洗菌体1次,最后用预冷的70%乙醇固定细胞,放4℃。同时向对数期的细胞中加入终浓度为10 μmol/L的药物CPT,30℃继续培养,并收取加药后0.5 h、1 h、1.5 h和2 h的样品,样品处理同上。CPT处理2 h后,收菌,每次用20 mL灭菌水洗菌体,共3次,再将细胞转移到新鲜的不含药物的YES培养基中,并收取从CPT药物中释放出来的1 h、2 h和3 h的样品,样品处理同上。
显微镜使用Delta Vision Personal DV系统,配备CoolSNAP HQ2制冷的CCD及YFP/CFP的滤片组合,放大倍数为100倍。图像用Volocity Demo软件进行分析。
1.6 Brl2的磷酸化分析
菌株培养至对数期,分为2等份,1份为对照组,1份为加药组。加药组加入终浓度为10 μmol/L的CPT,30℃继续培养3 h后,收集约20 OD的菌体。用灭菌水洗菌体1次,使用500 μL 20%三氯乙酸(trichloroacetic acid, TCA)悬浮菌体,并向其中加入等体积的玻璃珠,之后在振荡器上混匀6~8 min,离心收集上清。玻璃珠用5%的TCA清洗2次,清洗液与上清合并,3000 r/min室温离心10 min,弃上清。沉淀用200 μL十二烷基硫酸钠–聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)的蛋白上样缓冲液(1×)悬浮,并立即加入100 μL 1 mol/L Tris中和TCA的酸性,95℃煮样5 min后,3000 r/min室温离心10 min,收取上清,即为全细胞提取物。样品通过SDS-PAGE电泳,HA抗体(1∶1000;美国Invitrogen公司)进行定量,之后进行Phos-tag胶电泳(日本和光纯药WAKO)[19],检测是否有磷酸化条带的存在。
1.7 统计学分析
所有实验数据均重复至少3次,数据通过GraphPad Prism 5软件进行处理,两两数据间的比较采用检验分析,<0.05为差异具有统计学意义。
2 结果与分析
2.1 brl2Δ对CPT、MMS和UV敏感
为了探索泛素化连接酶Brl2在细胞损伤修复过程中的作用,本研究利用野生型裂殖酵母LD330菌种为背景菌种,通过同源重组的方法,构建了基因敲除菌株()。如图1A所示,细胞较WT细胞拉长,分枝,且不容易分离,该结果与之前的文章报道一致[11]。甲基甲磺酸酯(methyl methane sulfonate, MMS)能够甲基化DNA上的嘌呤碱基,生成N7-甲基鸟嘌呤和N3-甲基腺嘌呤,导致DNA复制过程中复制叉停顿和DNA双链断裂。紫外线UV对DNA照射后,可以使DNA形成环丁烷嘧啶二聚体等DNA损伤,阻止复制过程中DNA聚合酶的前行,使复制叉发生停顿。为了评估Brl2在DNA损伤修复中的作用,通过梯度稀释打点分析比较了WT菌株和菌株对CPT、MMS和UV的敏感性。结果显示缺失后对DNA损伤药物CPT、MMS及UV射线非常敏感(图1B),说明Brl2蛋白在基因组的稳定性维持上发挥着重要的作用。之后,选用CPT药物诱导DNA双链断裂来探索Brl2在DSBs中的修复作用。为了验证缺失对DNA损伤因素的敏感性是否依赖于H2B的119位赖氨酸单泛素化的缺失,进一步检测了和K119R突变体(为H2B的基因名)对药物CPT的敏感性,与相比,和K11R菌株的生长速度降低,且对CPT的敏感性也更低(图1C),暗示Brl2除了泛素化H2B的K119位点外,应该调控了其他底物、其他组蛋白、或者H2B的其他位点的泛素化来促进DSBs的修复。

图1 Brl2参与DNA损伤修复途径
A:野生型(WT)和菌株细胞的比较,显示缺失基因导致细胞拉长、分枝。B:对不同的DNA损伤因素的敏感性分析。C:对CPT的敏感性不完全依赖于对H2B的119位赖氨酸的单泛素化。B和C所示菌株生长到对数期时,收取等量的细胞数,进行5倍梯度稀释,取8 μL点到含有不同浓度的药物平板上。对于UV处理的样品,当样品点到YES平板后,待菌体全部渗入培养基,使用UV仪进行对应强度的照射。平板放30℃培养,3~4 d后拍照。
2.2 brl2缺失有利于rad3Δ和cds1Δ菌株在CPT压力下的存活
当遇到复制压力时,机体会激活Rad3-Cds1调控的信号通路来维持正在复制的复制叉稳定,从而有利于后续的DNA损伤修复。为了探索CPT诱导下的Brl2与该信号通路的关系,本研究构建了两个和双缺失株,并检测了它们对CPT的敏感性。结果显示,对低浓度的CPT非常敏感,但是双缺失株对CPT的敏感性降低,细胞的存活率增加(图2A)。进一步利用酵母的高表达质粒pSLF1073,在中高表达Brl2蛋白,可以逆转降低的CPT敏感性(图2B),因而证实了敲除Brl2蛋白有利于菌株在CPT压力下的存活。而且,如图2C所示,敲除Brl2蛋白有利于菌株在CPT压力下的存活。上述结果表明,当机体缺失Rad3-Cds1检验系统时,Brl2的缺失更有利于细胞在CPT压力下的存活,这也暗示Brl2可能是细胞周期检验点Rad3-Cds1通路的靶蛋白,以维持停顿DNA复制叉的稳定。
2.3 Brl2是DNA同源重组的必需因子
如前面结果显示,在WT背景下,Brl2有助于细胞在CPT压力下的存活,但是在Rad3-Cds1检验系统缺失时,Brl2反而不利于细胞在CPT压力下的存活。为了探索Brl2在CPT诱导的DSBs修复中的正面作用,本研究进一步检测了不同菌株的DNA重组能力。结果显示,敲除或后,菌株的重组能力均下调且较有显著下调,但是双缺失菌株的重组能力与相当(图3)。此结果表明,Brl2在DSBs的重组修复过程中发挥着重要的调控作用,这也暗示Rad3可能是调控Brl2的DNA同源重组功能的调控因子之一。

图2 brl2缺失有利于rad3Δ和cds1Δ菌株抵抗CPT产生的DNA损伤
A:缺失有利于菌株抵抗CPT产生的DNA损伤。B:在菌株中,分别转化空质粒pSLF1073和高表达Brl2蛋白的质粒pSLF1073-,同时在菌株中,转化pSLF1073作为对照,对应细胞在含有终浓度5 μg/mL的thiamine的EHAL液体培养基中复苏,之后将其接种到EHAL培养基中表达,16.5 h后调节菌落数目一致,进行梯度稀释打点实验。C:缺失有利于菌株抵抗CPT产生的DNA损伤。图中所示菌株均为生长到对数期时,收取等量的细胞数,进行5倍梯度稀释后,取8 μL点到含有不同浓度的药物平板上。平板放30℃培养,3~4 d后拍照。
2.4 Brl2有助于Rad52在DSBs处的募集
为了进一步确定Brl2参与DSBs修复,本研究构建了带有YFP标签的Brl2的表达质粒,将其转入DY1012菌株中,观察Brl2是否可以与重要的重组修复蛋白Rad52共定位。结果表明,Brl2可以与Rad52共定位(图4A),说明Brl2会被募集到DSBs位点上。无论是在WT菌株还是在缺失菌株中,每次实验取5个单克隆的数据,实验重复3次。*:<0.05;***:<0.001。
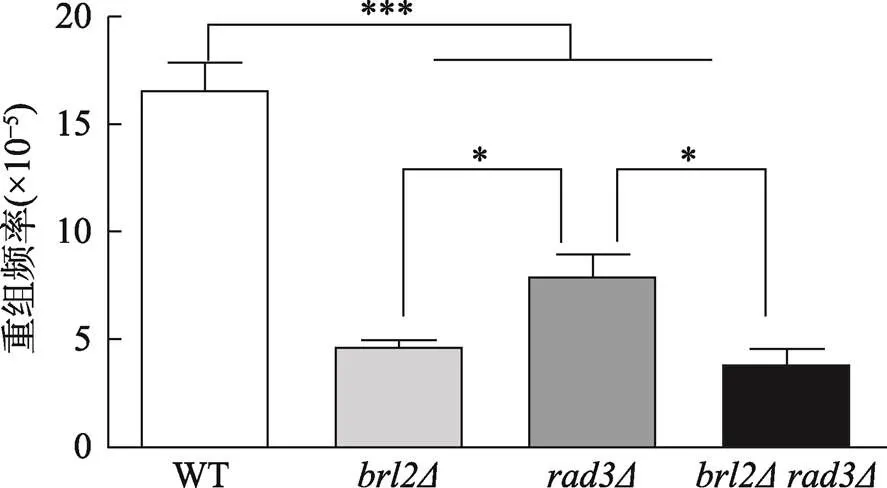
图3 野生型菌株和突变株的自发重组频率检测
随着CPT作用时间的增加,Rad52聚集点数量均会逐渐增加。但是,与WT菌株相比,缺失菌株中的Rad52聚集点增加的数量明显下调。当去除CPT药物后,WT菌株中Rad52聚集点逐渐减少,而缺失株中的Rad52聚集点的下调速率明显降低(图4B)。这些结果指出Brl2蛋白会募集到DSBs位点处,并有利于同源重组因子Rad52在DSBs的募集,从而促进细胞对DSBs的重组修复效率。

图4 Brl2定位到DSBs处并促进Rad52的募集
A:Brl2与Rad52在DSB处的共定位。C端融合表达YFP蛋白的Brl2在含有Rad52-CFP的菌株中表达16 h以上,收集菌株,通过Delta Vision Personal DV对其进行拍摄。B:WT和菌株生长到对数期时,加入终浓度为10 μmol/L CPT,作用2 h后,去除CPT药物,再培养3 h,收取所示时间点的细胞,使用70%的乙醇固定细胞,之后通过Delta Vision Personal DV对细胞进行观察。ns:无统计学差异,*:<0.05;**:<0.01;***:<0.001。
2.5 Brl2在DNA损伤修复时会被磷酸化
为了进一步研究Brl2在DNA损伤修复时是如何被调控的,本研究在WT菌株的背景下,构建了的菌株,通过提取CPT未处理及处理的菌株的全细胞提取物,利用HA抗体和Phos-tag凝胶对Brl2的磷酸化水平进行了检测。结果显示,在没有DNA损伤时,Phos-tag胶不能检测到明显的Brl2磷酸化,但是,药物CPT处理后,Brl2可检测到迁移慢的条带(图5),暗示在CPT诱导的DSBs修复过程中,Brl2存在磷酸化状态,其功能可能受蛋白激酶的磷酸化所调控。
3 讨论
H2B的120位赖氨酸单泛素化是一个非常保守的组蛋白翻译后修饰,在DNA的复制、转录和损伤修复中均发挥着重要的调控作用。目前,很多对其泛素化连接酶的研究主要针对这些泛素化连接酶的底物H2B进行。本研究发现,在CPT诱导的DSBs损伤修复过程中,较菌株K119R对CPT更加敏感,暗示了裂殖酵母中的Brl2泛素化连接酶所发挥的作用并不完全依赖于其底物H2B的K119位的泛素化。因此,以Brl2为研究对象,有利于全面揭示Brl2在DSBs损伤修复中的作用机制。

图5 Brl2的磷酸化检测
菌株生长到对数期后,分为2等份,1份未处理,另1份加入终浓度为10 μmol/L CPT,继续培养2 h后,收集菌体,提取全细胞提取物。使用HA抗体对普通蛋白胶分离的Brl2-3HA蛋白进行定量后,再进行6% Phos-tag胶电泳并检测CPT未处理和处理的菌株中Brl2-3HA蛋白含量。
越来越多的研究发现H2Bub1在DNA损伤修复中发挥着一定的调控作用,但是其具体的作用机制仍待进一步阐明。在高等哺乳细胞中,IR或者辐射模拟药物新制癌菌素(neocarzinostatin, NCS)可导致RNF20/RNF40定位到DSBs处及H2Bub1整体水平的增加。在这个过程中,ATM磷酸化RNF20/RNF40,促进H2B的单泛素化[20,21]。也有研究表明,单独抑制ATR和ATM,并不影响IR引起的H2Bub1水平,只有同时抑制ATR和ATM,H2Bub1才会受到调控[13]。上调的H2Bub1作为DSB修复的上游信号,调节下游的HR和NHEJ修复[13,20]。上述结果表明,ATM在RNF20/40的上游发挥作用,而ATR可能与ATM存在冗余作用。为进一步探讨ATR激酶和H2B泛素化连接酶在DSBs修复过程中的关系,本研究利用裂殖酵母为研究模型,以CPT药物诱导的生理常见DSBs为主要研究对象,比较了和等缺失菌株对DSBs损伤因素的敏感性和自发重组频率,并对Brl2的磷酸化情况进行了分析。结果显示Brl2缺失对各种DSBs损伤因素均高度敏感,但是在没有Rad3-Cds1体系时,缺失更有利于菌株抵抗CPT诱导的损伤;双敲除菌株的自发重组频率与相似,较的重组频率低,未出现和重组频率的加和效应,且CPT可诱导Brl2发生磷酸化。以上结果说明,在野生型细胞内,当CPT诱导体内产生DSBs时,Rad3和Brl2在HR修复过程中发挥重要的调控作用,并且二者可能对同一事件起作用。但是在检验点蛋白Rad3和Cds1缺失的菌株中,Brl2的功能需要下调以维持基因组的稳定性,暗示Brl2可能也在维持停顿DNA复制叉中起着重要调控作用。
在DSBs修复过程中,很多研究认为,染色质需要先松散再进一步募集功能蛋白来行使相应的功能[20,22]。结合H2Bub1能够调控染色质结构的功能[23],研究者们进一步发现,DSBs处的H2Bub1有利于下游的修复相关蛋白RPA、Rad51、BRCA1及Ku70/ Ku80的募集[22,24]。但这些结果主要是在IR的作用下进行的。CPT产生的DSBs往往发生于DNA复制过程中,DSBs附近的DNA已经被解聚,可能并不需要H2Bub1对染色质结构的调控功能,这也许是K119R对CPT不太敏感的一个原因。本研究发现,在CPT诱导的DSBs修复过程中,缺失导致Rad52不能有效募集,因此,产生的DSBs不能及时被修复。去除CPT后,野生型菌株中的Rad52聚集点逐渐减少,表明DNA损伤逐渐被修复,但是在中,Rad52聚集点下调非常缓慢,DNA损伤得不到及时修复,从而导致基因组不稳定。
综上所述,本研究以裂殖酵母为模式生物,探索了Brl2在CPT诱导的DSBs修复过程中的作用。在CPT诱导的DSBs发生时,Brl2被募集到损伤部位,发生磷酸化修饰,进一步募集下游的损伤修复蛋白Rad52,促进HR修复完成。在这个过程中,Brl2与激酶Rad3可能对同一事件发挥着重要的调控作用。但是,当Rad3-Cds1体系缺失时,Brl2功能下调更有利于基因组稳定性的维持。该研究拓展了H2B泛素化连接酶Brl2在DNA损伤修复中的作用,同时为进一步阐明其分子作用机制提供了研究思路。
[1] Mehta A, Haber JE. Sources of DNA double-strand breaks and models of recombinational DNA repair.,2014, 6(9): a016428.
[2] Huang M, Yang YR, Sun XY, Zhang T, Guo CX. RAD51 regulates REV1 recruitment to DNA double-strand break sites., 2018, 40(11): 1007–1014.
黄敏, 杨业然, 孙晓艳, 张婷, 郭彩霞. RAD51调控REV1参与DNA双链断裂修复. 遗传, 2018, 40(11): 1007–1014.
[3] Thadathil N, Hori R, Xiao JF, Khan MM. DNA double- strand breaks: a potential therapeutic target for neurodegenerative diseases.,2019, 27(4): 345–364.
[4] Dai YX, Zhang F, Wang LG, Shan S, Gong ZH, Zhou Z. Structural basis for shieldin complex subunit 3-mediated recruitment of the checkpoint protein REV7 during DNA double-strand break repair.,2020, 295(1): 250–262.
[5] Shrivastav M, De Haro LP, Nickoloff JA. Regulation of DNA double-strand break repair pathway choice.,2008, 18(1): 134–147.
[6] Gong Y, Handa N, Kowalczykowski SC, de Lange T. PHF11 promotes DSB resection, ATR signaling, and HR.,2017, 31(1): 46–58.
[7] Whelan DR, Lee WTC, Marks F, Kong YT, Yin YD, Rothenberg E. Super-resolution visualization of distinct stalled and broken replication fork structures.,2020, 16(12): e1009256.
[8] Liu SJ, Hua Y, Wang JN, Li LY, Yuan JJ, Zhang B, Wang ZY, Ji JG, Kong DC. RNA polymerase III is required for the repair of DNA double-strand breaks by homologous recombination.,2021, 184(5): 1314–1329.e1310.
[9] Limbo O, Porter-Goff ME, Rhind N, Russell P. Mre11 nuclease activity and Ctp1 regulate Chk1 activation by Rad3ATRand Tel1ATMcheckpoint kinases at double-strand breaks.,2011, 31(3): 573–583.
[10] Sato H, Niimi A, Yasuhara T, Permata TBM, Hagiwara Y, Isono M, Nuryadi E, Sekine R, Oike T, Kakoti S, Yoshimoto Y, Held KD, Suzuki Y, Kono K, Miyagawa K, Nakano T, Shibata A. DNA double-strand break repair pathway regulates PD-L1 expression in cancer cells.,2017, 8(1): 1751.
[11] Zofall M, Grewal SI. HULC, a histone H2B ubiquitinating complex, modulates heterochromatin independent of histone methylation in fission yeast.,2007, 282(19): 14065–14072.
[12] Deng ZH, Ai HS, Lu CP, Li JB. The Bre1/Rad6 machinery: writing the central histone ubiquitin mark on H2B and beyond.,2020, 28(3–4): 247–258.
[13] So CC, Ramachandran S, Martin A. E3 ubiquitin ligases RNF20 and RNF40 are required for double-stranded break (DSB) repair: evidence for monoubiquitination of histone H2B lysine 120 as a novel axis of DSB signaling and repair.,2019, 39(8): e00488–e00518.
[14] In S, Kim YI, Lee JE, Kim J. RNF20/40-mediated eEF1BδL monoubiquitylation stimulates transcription of heat shock-responsive genes.,2019, 47(6): 2840–2855.
[15] Scherer S, Davis RW. Replacement of chromosome segments with altered DNA sequences constructed.,1979, 76(10): 4951–4955.
[16] Rai SK, Atwood-Moore A, Levin HL. High-frequency lithium acetate transformation of.,2018, 1721: 167–177.
[17] Forsburg SL, Rhind N. Basic methods for fission yeast.,2006, 23(3): 173–183.
[18] Osman F, Fortunato EA, Subramani S. Double-strand break-induced mitotic intrachromosomal recombination in the fission yeast.,1996, 142(2): 341–357.
[19] Nagy Z, Comer S, Smolenski A. Analysis of protein phosphorylation using Phos-tag gels.,2018, 93(1): e64.
[20] Moyal L, Lerenthal Y, Gana-Weisz M, Mass G, So S, Wang SY, Eppink B, Chung YM, Shalev G, Shema E, Shkedy D, Smorodinsky NI, van Vliet N, Kuster B, Mann M, Ciechanover A, Dahm-Daphi J, Kanaar R, Hu MC, Chen DJ, Oren M, Shiloh Y. Requirement of ATM-dependent monoubiquitylation of histone H2B for timely repair of DNA double-strand breaks.,2011, 41(5): 529–542.
[21] Nakamura K, Kato A, Kobayashi J, Yanagihara H, Sakamoto S, Oliveira DVNP, Shimada M, Tauchi H, Suzuki H, Tashiro S, Zou L, Komatsu K. Regulation of homologous recombination by RNF20-dependent H2B ubiquitination.,2011, 41(5): 515–528.
[22] Zheng SH, Li D, Lu Z, Liu GX, Wang M, Xing PY, Wang M, Dong Y, Wang XJ, Li JY,Zhang SM, Peng HY, Ira G, Li GH, Chen XF. Bre1-dependent H2B ubiquitination promotes homologous recombination by stimulating histone eviction at DNA breaks.,2018, 46(21): 11326–11339.
[23] Zukowski A, Johnson AM. The interplay of histone H2B ubiquitination with budding and fission yeast heterochromatin.,2018, 64(4): 799–806.
[24] Marsh DJ, Ma Y, Dickson KA. Histone monoubiquitination in chromatin remodelling: focus on the histone H2B interactome and cancer.,2020, 12(11): 3462.
The functional analysis of the ubiquitin ligase Brl2 in the repair of DNA double-strand breaks
Xiaoqin Liu1, Feiran Chang2, Sijie Liu2, Fei Wu2, Daochun Kong2
Mono-ubiquitination of histone H2B plays a critical role in the regulation of gene transcription, DNA replication, and DNA damage repair. In, Brl2 is an E3 ubiquitin ligase and required for the ubiquitination of H2B at lysine residue 119. Currently, there are few studies related to the function of Brl2 in DNA damage repair. Using camptothecin (CPT) to induce DNA double-strand breaks (DSBs) in, we investigated the effect of Brl2 on DSB repair, and found that-null mutants showed greater sensitivity to CPT when compared with wild-type (WT) cells, as well as having a drastically reduced spontaneous recombinant frequency.The fluorescent analysis demonstrated that Brl2 was co-localized with the recombination factor Rad52 at DSBs. Moreover, Brl2 promoted the recruitment of Rad52 to DSBs. Under CPT-induced DSBs, Brl2 was phosphorylated. These findings indicate that Brl2 plays a critical role in DNA homologous recombination and its mediated repair of DSBs.
histone H2B; Brl2; DSB repair; CPT;
2022-02-14;
2022-04-25;
2022-05-19
山西省高等学校科技创新项目(编号:2020L0497),山西大同大学博士科研启动经费(编号:2019-B-20)资助[Supported by the Scientific and Technological Innovation Program of Higher Education Institutions in Shanxi (No. 2020L0497), and Doctoral Research Start-up Funds of Shanxi Datong University (No. 2019-B-20)]
刘晓琴,博士,讲师,研究方向:基因组稳定性调控和神经退行性疾病机制研究。E-mail: xiaoqinliu@sxdtdx.edu.cn
10.16288/j.yczz.22-031
(责任编委: 刘钢)