诺氟沙星胶囊近红外在线质量控制初探*
王小亮,张秉华,邓玉龙,牛龙青,绳金房
(1.陕西省食品药品检验研究院,陕西 西安 710065; 2.陕西省药品技术审评中心,陕西 西安 710065)
现行药品质量控制方法大多是按照已制定的质量标准对最终产品进行的符合性抽样检验,但存在检验项目有限而无法保证药品整体质量,检验方法多具有破坏性而无法覆盖全部样品,检验存在滞后性等问题。因此,研究和发展过程分析技术进行药品质量实时监测和控制,是当前我国制药企业需优先解决的问题之一[1−5]。近红外光谱(NIR)由于具有穿透力强、不破坏样品、环保,以及适用于定性定量分析、可通过光纤远距离在线检测等特点,在国外已逐渐发展为普遍应用的过程控制技术[6−9]。但受政策导向、资金实力、技术支持等因素限制,国内尚无药厂真正将近红外技术用于药品生产过程的质量监控。为此,本研究中借助某企业生产基地优势,以诺氟沙星胶囊为突破点,针对其原料、辅料、中间体及终产品建立NIR 库、一致性检验定性模型和定量模型,以控制全生产过程中诺氟沙星胶囊质量,并应用于该企业实际生产过程中各个环节样品的检测,为初步实现原料、辅料的在线验收,混匀过程的实时监控,以及终端产品的质量控制提供参考。现报道如下。
1 仪器与试药
1.1 仪器
Matrix −F 型近红外光谱仪,配有1.5 m 长固体光纤探头测样附件,铟镓砷(InGaAs)检测器,OPUS 5.5光谱分析软件(德国Bruker公司);2030C 型高效液相色谱仪,配有DAD 检测器(日本Shimadzu 公司);BP211D 型电子分析天平(德国Sartorius公司)。
1.2 试药
诺氟沙星胶囊50批,诺氟沙星原料、3种辅料(十二烷基硫酸钠、羧甲淀粉钠、玉米淀粉)、中间体各20 批,明胶空心胶囊200粒,均由金花企业(集团)股份有限公司西安金花制药厂提供。用于模型验证的其他企业的诺氟沙星胶囊样品均购自市场。
2 方法与结果
2.1 光谱采集
采用漫反射测量法,用固体光纤(取原料、辅料、中间体均插入取样袋,片剂抵住片芯)直接检测样品NIR。光谱扫描范围为12 000 ~4 000 cm−1,分辨率为8 cm−1,扫描64次,每批样品测定6次。定性模型使用原始光谱建模,定量模型使用平均光谱建模。
2.2 模型建立与质量控制
2.2.1 原料、辅料及中间体质量控制
模型建立:采用最大适形指数(CI)法建立一致性检验模型[10]。通过计算参考光谱在每个波长点i处吸光度的平均值(Ar,i)和标准偏差σ(σr,i),将每个波长点的平均值±CI限度倍数的σ作为可信区间,计算待测光谱在该波长点处的吸光度(As,i),按公式CIi=(As,i−Ar,i)/σr,i计算待测光谱的CI值(CIi)并与之前设定的CI限度比较,判断待测光谱与参考光谱是否具有一致性。分别以西安金花制药厂提供的诺氟沙星原料、十二烷基硫酸钠、羧甲淀粉钠、玉米淀粉及中间体各10批的原始NIR 建立一致性检验定性模型[11]。原料、辅料及中间体的NIR见图1,建模参数见表1。

表1 一致性检验定性建模参数Tab.1 The parameters of consistency test qualitative model
模型验证:分别以不同生产企业的诺氟沙星原料、辅料分别对建立的诺氟沙星原料、十二烷基硫酸钠、羧甲淀粉钠及玉米淀粉一致性检验定性模型进行验证;采用不同取样时间的中间体对所建立的中间体模型进行验证。结果见图2。结果显示,所建立的模型均可有效区分不同生产企业的诺氟沙星原料、辅料及混合过程中不同时间段的中间体,可用于该企业原料、辅料的验收及中间体的质量控制,实现原料、辅料的在线验收;混匀过程的实时监控,节省时间、人力和物力成本。
2.2.2 诺氟沙星胶囊质量控制
一致性检验定性模型:模型建立同2.2.1 项。诺氟沙星胶囊NIR见图3,一致性检验模型验证结果见图4。
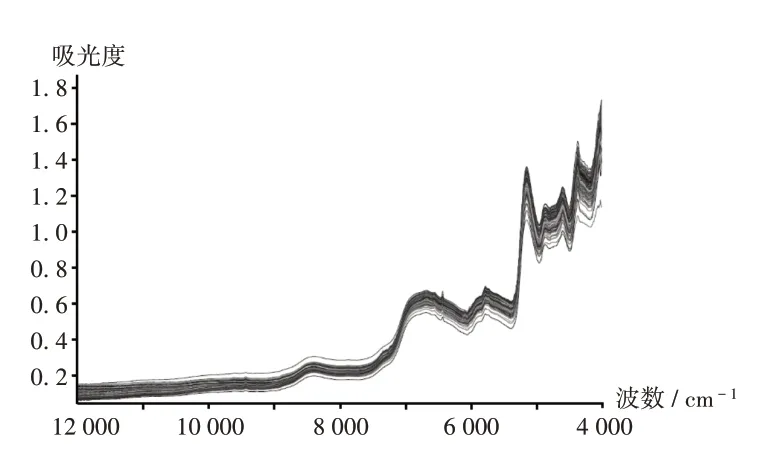
图3 诺氟沙星胶囊近红外光谱图Fig.3 The NIR spectrogram of Norfloxacin Capsules
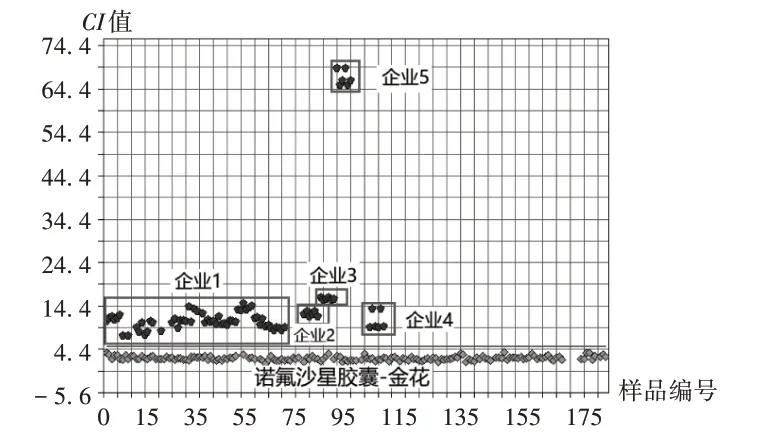
图4 诺氟沙星胶囊一致性检验定性模型验证Fig.4 Validation test for consistency test qualitative model ofNorfloxacin Capsules
2.2.3 定量模型
选用OPUS 5.0光谱分析软件及附带的QUANT2软件包,基于偏最小二乘法(PLS)定量原理建立定量模型[12−13],采用交叉验证均方根误差(RMSECV)评价模型准确性。其公式如下。
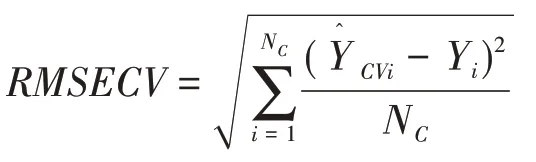
式中,Nc、YCVi和Yi分别表示校正集样品数量及交叉验证中样品i 的预测值和真实测定值。依据2020 年版《中国药典(二部)》高效液相色谱法、外标定量法测定。西安金花制药厂提供的50批样品,每批样品测定6次,求其平均光谱作为建模光谱。样品的平均光谱见图5,最优模型参数见表2,内部交叉验证结果见图6。

表2 多次优化确定最优模型参数Tab.2 Parameters of the optimal model by the multiple optimization
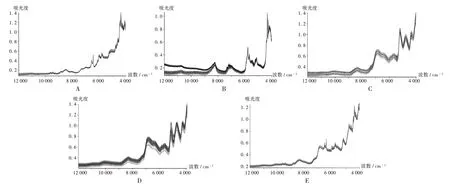
A.诺氟沙星原料 B.十二烷基硫酸钠 C.羧甲淀粉钠 D.玉米淀粉 E.中间体图1 样品的原始近红外光谱图A.API of norfloxacin B.Sodium dodecyl sulfate C.Sodium carboxymethyl starch D.Corn starch E.IntermediatesFig.1 The origin NIR spectrogram of samples
2.2.4 定量模型准确性验证
选取未参与建模的西安金花制药厂20批诺氟沙星胶囊验证模型准确性。通过比较NIR预测值与真实值的偏差及将预测值与真实值在95%的置信区间内进行配对t检验,评价模型准确性。结果见表3。可见,NIR 预测值与真实值相比相对偏差较小(0.03%~0.64%,平均0.27%)。近红外快检方法的偏差上限要求通常为5%,可见,本试验中,所建立的诺氟沙星胶囊定量模型对该企业的样品预测准确性良好,可用于日常质量控制。进一步将验证集预测值与真实值进行配对t检验,在95%的置信区间内,P=0.636 >0.05,表明本次建模的预测结果与《中国药典(二部)》中的方法无显著差异。验证得知,试验所建立的NIR定量模型可对该企业的诺氟沙星胶囊实现终端的定性、定量检测,仅需测定未知样品的NIR,数分钟便可得知含量。与采样送去实验室检测的传统方法比较,省去了大量的人力、物力及时间成本,实现了诺氟沙星胶囊质量的实时控制。

表3 模型对未知样品的预测结果Tab.3 Prediction results of the model for unknown samples
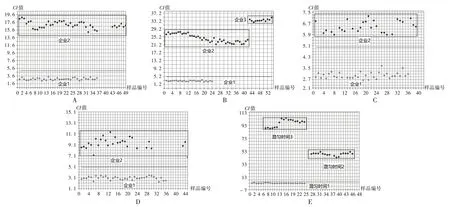
A.诺氟沙星原料 B.十二烷基硫酸钠 C.羧甲淀粉钠 D.玉米淀粉 E.不同混匀时间中间体图2 原料、辅料及中间体一致性检验定性模型B.API of norfloxacin B.Sodium dodecyl sulfate C.Sodium carboxymethyl starch D.Corn starch E.Intermediates with different mixing timeFig.2 Consistency test qualitative model of API,excipients and intermediates
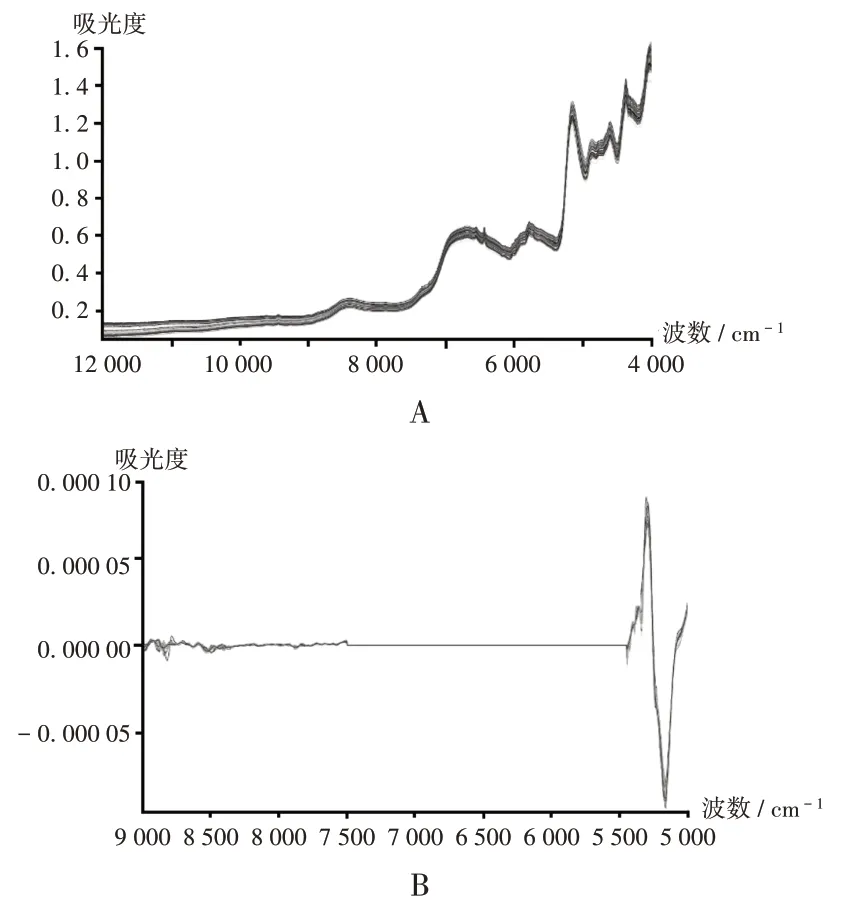
A.建模原始光谱 B.二阶导数化处理后的光谱图5 诺氟沙星胶囊近红外定量建模光谱A.Origin NIR spectrogram of model B.Spectrogram pretreated by second derivativeFig.5 NIR spectrogram of quantitative model of Norfloxacin Capsules
2.3 生产工艺优化
通过建立近红外在线分析方法,最终可实现生产工艺的优化。本研究中采用便携式光纤采样的近红外光谱仪,操作方便,将光纤探头直接接入物料桶,便可实时采集样品的NIR光谱,远程建模和测定样品的性质数据,大大减少了人员、仪器、试剂、时间成本。优化的生产工艺见图7。
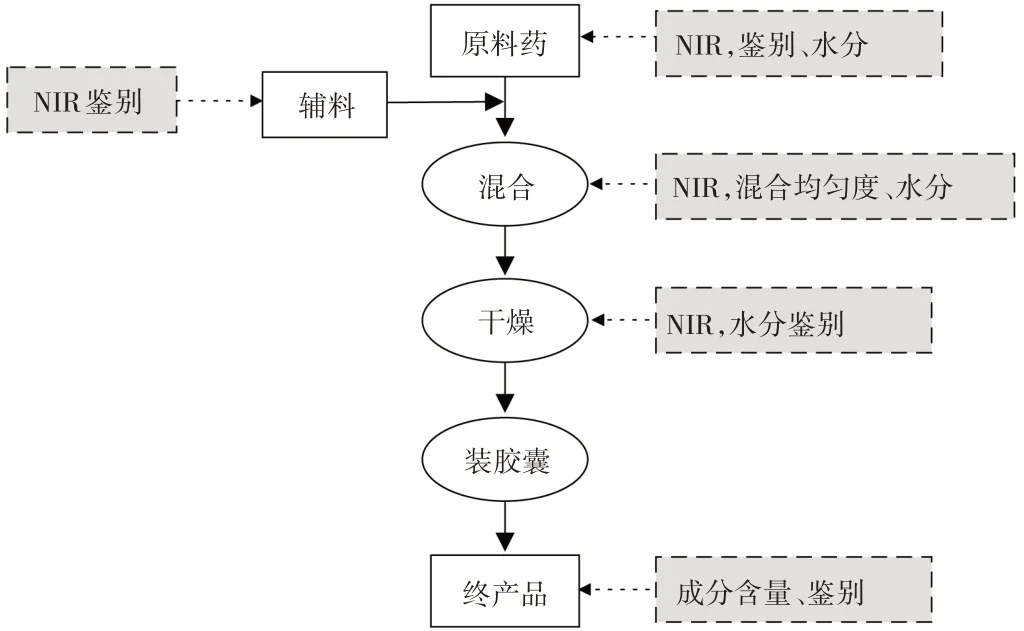
图7 近红外在线控制工艺图Fig.7 Flow chart of online NIR control
3 讨论
近年来,随着制药行业的迅速发展及药品监管力度的加大,成分不符的假药越来越少,但冒充其他知名品牌药的事件屡有发生。诺氟沙星胶囊按2020年版《中国药典》检验,需耗费的时间、仪器、人力及物力成本均较高,采用NIR法建立针对西安金花制药厂的诺氟沙星胶囊一致性检验定性模型,不仅可鉴别真伪,还可有效区分其他厂家的诺氟沙星胶囊,保护自己的品牌,实现在终端快速控制产品质量。同时,为了突出活性成分的信息,建立准确、稳健的NIR校正模型,基于光谱预处理方法及谱段选择的理论[14−16],比较内部交叉验证、模型稳健性理论[17]及OPUS软件自动优化的结果,经多次优化,确定最优模型。

A.预测值与真实值 B.RMSECV与Rank C.偏差与真实值 D.马氏距离与残差图6 内部交叉验证结果图A.Predicted value and real value B.RMSECV and Rank C.Deviation and real value D.Mahalanobis distance and residualFig.6 Results of internal cross validation
本研究中通过NIR分析技术,以西安金花制药厂的诺氟沙星胶囊为样品,从原料及辅料的验收、中间体混匀过程控制到终产品诺氟沙星胶囊的定性、定量分析,全面控制了诺氟沙星胶囊生产过程。试验采用便携式近红外光谱仪和固体光纤采样,便于移动,适用于生产车间、实验室多场所分析,耐用性好,分析速度快,不破坏样品,不使用有机溶剂,绿色环保,实时控制产品质量。

