猪TRIM3基因克隆、生物信息学及组织表达分析
张 航,沙惠阳,李华玮,黄良宗,赵孟孟
(1.佛山科学技术学院生命科学与工程学院,佛山 528231;2.河南牧业经济学院食品与生物工程学院,郑州 450046;3.佛山科学技术学院附属教学动物医院,佛山 528231)
三基序结合蛋白(tripartite motif-containing,TRIM)家族在人上已发现有80多个成员,是一组高度保守的E3泛素连接酶蛋白,参与细胞生长、分化、凋亡、细胞内运输和转录调节等多种生物进程[1]。该家族成员都含有3个保守结构域,分别为N-端的RING结构域[2]、B-box锌指结构域[3]、卷曲核心结构域(coiled-domain,CC)和1个额外的可变C-端结构域[4]。已有研究表明,TRIM家族成员与许多临床的生理和病理过程有关,如TRIM8已被证明在胶质母细胞瘤和乳腺癌等多种癌症中发挥肿瘤抑制作用[5];TRIM21作为自身抗原在自身免疫疾病中被广泛研究[6];TRIM32的缺失突变引起神经系统的罕见遗传病[7]。因此,对TRIM蛋白功能及作用机制的研究对认识疾病的发展具有重要意义。
病毒侵袭是困扰中国养猪业健康发展的关键问题之一。开发靶向治疗药物,提高猪体自身免疫成为解决这一关键问题的方向之一。先天免疫是机体抵抗外来病原微生物感染的第一道防线。病原微生物作为病原相关分子模式被模式识别受体识别,产生一系列信号级联反应促进细胞分泌干扰素(interferon,IFN)。产生的IFN与细胞表面受体结合,通过信号转导器和JAK-STAT途径激活信号级联反应,导致大量干扰素刺激基因(interferon stimulates genes,ISGs)的表达。ISGs的大量表达使机体处于抗病毒状态以保证宿主处于正常生理状态。目前已经筛选鉴定出多数TRIM家族成员作为ISGs参与病毒生命周期的各个环节,包括病毒侵入、基因组复制以及病毒装配与释放等过程,如TRIM41通过与核衣壳蛋白(NP)相互作用从而使NP泛素化和随后的蛋白质降解抑制A型流感病毒感染[8];TRIM22也可以泛素化NP,并将其作为蛋白质降解的靶点[9];TRIM25的C-端SPRY结构域与维甲酸诱导基因Ⅰ(retinoic acid-inducible gene Ⅰ,RIG-Ⅰ)的2CARD结构域结合,激活RIG-Ⅰ使其发生泛素化,从而促进β干扰素(interferon-β,IFN-β)的产生[10]。因此,深入研究ISGs的抗病毒机制对于开发靶向治疗药物具有重要意义。
TRIM3是TRIM家族成员之一,该蛋白除TRIM家族共有结构外,还含有1个Filamin结构域和1个C-末端NHL结构域[11]。目前对TRIM3的研究主要集中在肿瘤的发生发展过程中。TRIM3是一种候选肿瘤抑制基因,通过核转录因子-κB(NF-κB)、Musashi-Notch、p38等多条信号通路抑制肿瘤细胞的生长、侵袭与转移,参与肿瘤的临床分期和预后[12-14]。在抑制病毒感染过程中,TRIM5、TRIM14、TRIM21、TRIM25、TRIM38发挥重要作用[15-19],同为E3泛素连接酶的TRIM3是否在病毒感染中发挥作用鲜见报道。Li等[20]发现鼠源TRIM3基因介导Toll样受体3(Toll-like receptor 3,TLR3)泛素化,从而正向调控TLR3介导的先天免疫和炎症反应。但猪源TRIM3基因是否参与先天免疫仍然未知。因此,研究猪源TRIM3基因对猪病的防治具有重要意义。本研究以大白猪肝脏组织为试验材料,克隆猪TRIM3基因并对其进行生物信息学分析,预测其蛋白的结构及可能的功能,同时分析TRIM3基因在各组织中的表达差异,旨在为进一步研究猪TRIM3基因免疫学特点及其参与猪先天性免疫和抗病毒感染中的分子机制提供理论依据。
1 材料与方法
1.1 材料
分别采集健康30日龄大白猪公猪心脏、肝脏、脾脏、肺脏、肾脏、肌肉、气管和结肠等组织,—80 ℃保存备用。TRIzol总RNA抽提试剂盒(R0016)和BeyoFastTMSYBR Green qPCR Mix(2×,Low ROX)均购自上海碧云天生物科技有限公司;cDNA一链合成试剂盒(R111)、2×TaqMaster Mix、DL5000 DNA Marker、胶回收/DNA纯化试剂盒(DC301)、大肠杆菌DH5α感受态细胞和质粒DNA小提试剂盒(DC201)均购自南京诺唯赞生物科技股份有限公司;pMD18-T购自宝日医生物技术(北京)有限公司;实时荧光定量PCR仪(CFX ConnectTMOptics Module)购自伯乐生命医学产品(上海)有限公司。
1.2 引物设计与合成
参考野猪TRIM3基因(GenBank登录号:XM_021062339.1)CDS序列,利用Primer Premier 5.0软件设计克隆和实时荧光定量PCR引物,以GAPDH(GenBank登录号:NM_001206359.1)为内参基因,引物信息见表1。引物均由天一辉远基因科技有限公司合成。

表1 引物信息
1.3 总RNA提取及cDNA合成
采用TRIzol总RNA抽提试剂盒提取猪各组织总RNA,用超微量分光光度计测定RNA浓度,1.0%琼脂糖凝胶电泳检测其质量,确定总RNA完整度且纯度符合试验要求。取0.5 μg总RNA,利用反转录试剂盒(HiScript 1st Strand cDNA Synthesis Kit)合成cDNA,-20 ℃保存备用。
1.4 猪TRIM3基因CDS区克隆与测序
以反转录合成的肝脏组织cDNA为模板进行PCR反应,PCR反应体系25 μL:cDNA模板2 μL,10 μmol/L 上、下游引物各1 μL,2×TaqMasterMix 12.5 μL,ddH2O 8.5 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性15 s,43 ℃退火15 s,72 ℃延伸2 min 30 s,共35个循环;72 ℃延伸5 min。PCR产物采用1.0%琼脂糖凝胶电泳检测,将特异性条带切胶回收后连接pMD18-T载体,转化大肠杆菌DH5α感受态细胞,疑似菌落挑至400 μL含有氨苄抗生素的1.5 mL EP管,37 ℃、200 r/min摇至4 h后做菌液PCR鉴定。菌液PCR反应体系10 μL:菌液2 μL,10 μmol/L上、下游引物各0.5 μL,2×TaqMasterMix 5 μL,ddH2O 2 μL。菌液PCR反应程序同上。菌液PCR鉴定正确后送天一辉远基因科技有限公司进行测序。
1.5 相似性比对及系统进化树构建
从NCBI网站中搜索并下载相关物种的TRIM3基因序列,包括野猪(Susscrofa,GenBank登录号:XM_021062339.1)、人(Homosapiens,GenBank登录号:AF220021.1)、猕猴(Macacamulatta,GenBank登录号:NM_001266201.1)、小鼠(Muspahari,GenBank登录号:XM_029538710.1)、牛(Bosindicus,GenBank登录号:XM_027563142.1)、山羊(Caprahircus,GenBank登录号:XM_018059468.1)、马(Equuscaballus,GenBank登录号:XM_023645901.1)、鸡(Gallusgallus,GenBank登录号:XM_040657774.1)、鹅(Ansercygnoidesdomesticus,GenBank登录号:XM_013170643.1)、鸭(Anasplatyrhynchos,GenBank登录号:XM_038179015.1)、大鼠(Rattusnorvegicus,GenBank登录号:NM_031786.2)、黑猩猩(Pantroglodytes,GenBank登录号:XM_016920269.2)、响尾蛇(Crotalustigris,GenBank登录号:XM_039348142.1)。使用DNAStar软件进行TRIM3基因序列相似性比对;利用Mega 7.0软件中的邻接法(Neighbor-Joining,NJ)构建系统进化树,自展分析Bootstrap 1 000次。
1.6 生物信息学分析
利用ExPASy在线软件的ProtParam程序(https:∥web.expasy.org/protparam/)预测TRIM3蛋白的理化性质;利用Net OGlyc 4.0在线程序(https:∥www.expasy.org/search/Net OGlyc)预测TRIM3蛋白糖基化位点;运用Net Phos 3.1在线程序(https:∥www.expasy.org/search/Net Phos/)预测TRIM3蛋白磷酸化位点;利用WOLF PSORT在线软件(https:∥www.genscript.com/wolf-psort.html)预测TRIM3蛋白亚细胞定位;利用SignalP-4.1 Server(http:∥www.cbs.dtu.dk/services/SignalP/)和TMHMM 2.0(http:∥www.cbs.dtu.dk/services/TMHMM/)在线程序预测蛋白信号肽及跨膜螺旋结构;利用ProtScale在线程序(https:∥web.expasy.org/protscale/)预测TRIM3蛋白亲/疏水性;利用SOPMA在线软件(https:∥nspa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=/NPSA/npsa_sopma.html)预测TRIM3蛋白二级结构;利用SWISS-MODEL在线软件(http:∥www.swissmodel.expasy.org)预测TRIM3蛋白三级结构。
1.7 组织表达分析
分别对猪心脏、肝脏、脾脏、肺脏、肾脏、肌肉、气管和结肠组织中TRIM3基因进行实时荧光定量PCR检测。PCR反应体系10 μL:SYBR Premix ExTaqTMⅡ(2×)5 μL,上、下游引物(10 μmol/L)混合0.5 μL,cDNA 4.5 μL。PCR反应程序:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火延伸30 s,共40个循环。采用2-ΔΔCt法分析TRIM3基因在猪不同组织中的相对表达量,每个样品重复3次。数据处理采用GraphPad Prism 5.0(GraphPad Software,San Diego,CA)软件的多重比较方法,数据以平均值±标准差来表示,P<0.05表示差异显著。
2 结 果
2.1 猪TRIM3基因克隆
以大白猪肝脏组织cDNA为模板进行PCR扩增,得到约2 235 bp扩增片段(图1A),条带清晰明亮,与预期结果相符。经连接、转化、挑菌后进行菌液PCR鉴定,结果获得了约2 235 bp大小片段(图1B),表明成功克隆了猪TRIM3基因CDS区。
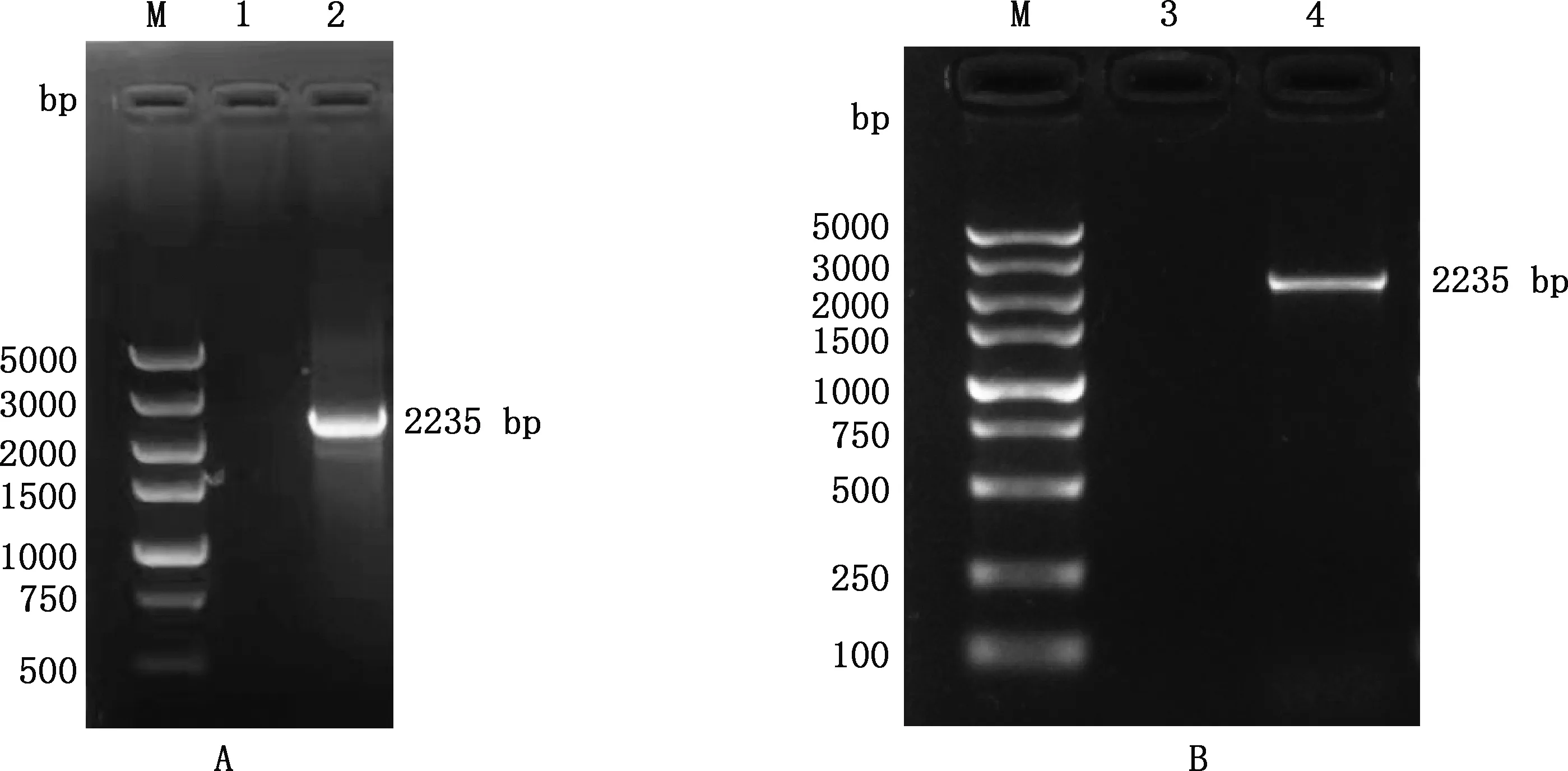
M,DL5000 DNA Marker;1、3,阴性对照;2,TRIM3基因PCR扩增产物;4,菌液PCR鉴定结果
2.2 相似性比对及系统进化树构建
相似性比对结果显示,大白猪TRIM3基因核苷酸序列与其他物种的相似性为75.1%~99.7%,其中与野猪的相似性最高,达99.7%;与鸭的相似性最低,为75.1%(图2)。系统进化树构建结果显示,TRIM3基因在大白猪和野猪中先聚为一类,与野猪亲缘关系最近,山羊和牛次之,与鹅的亲缘关系最远(图3)。
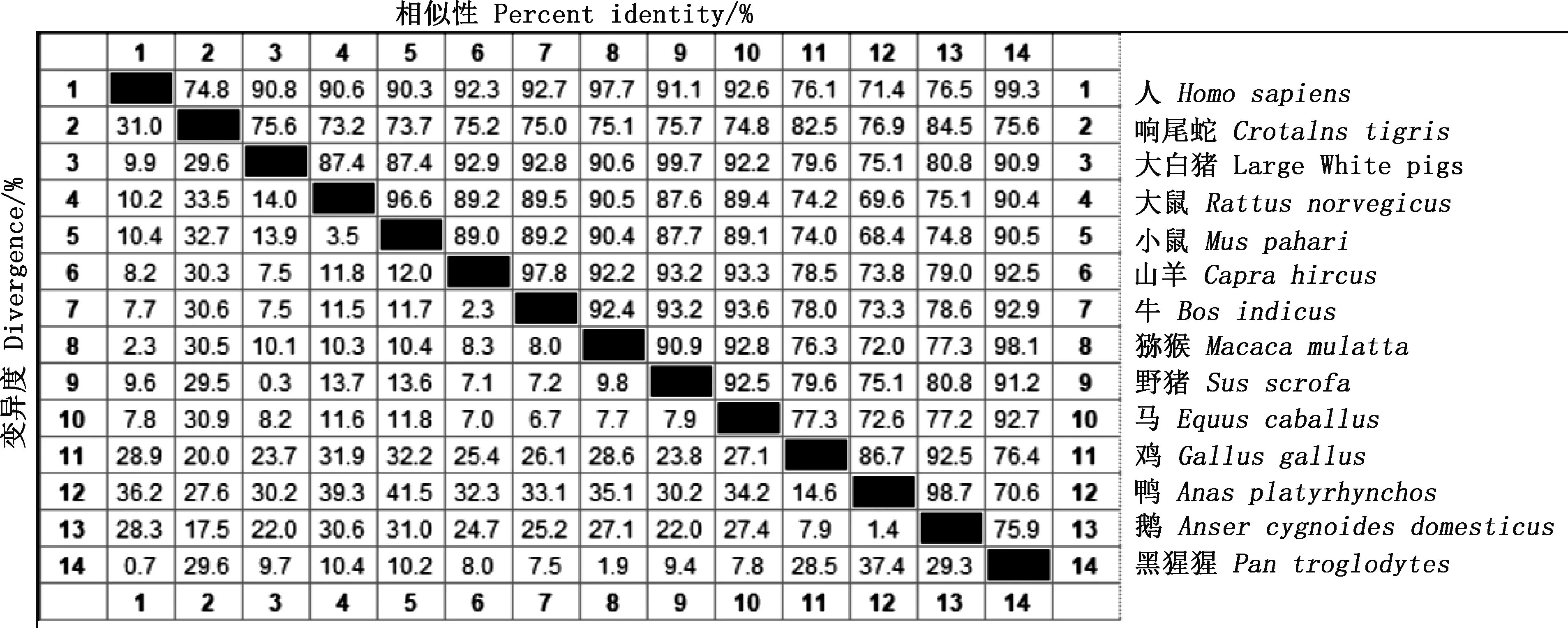
图2 不同物种TRIM3基因核苷酸序列比对
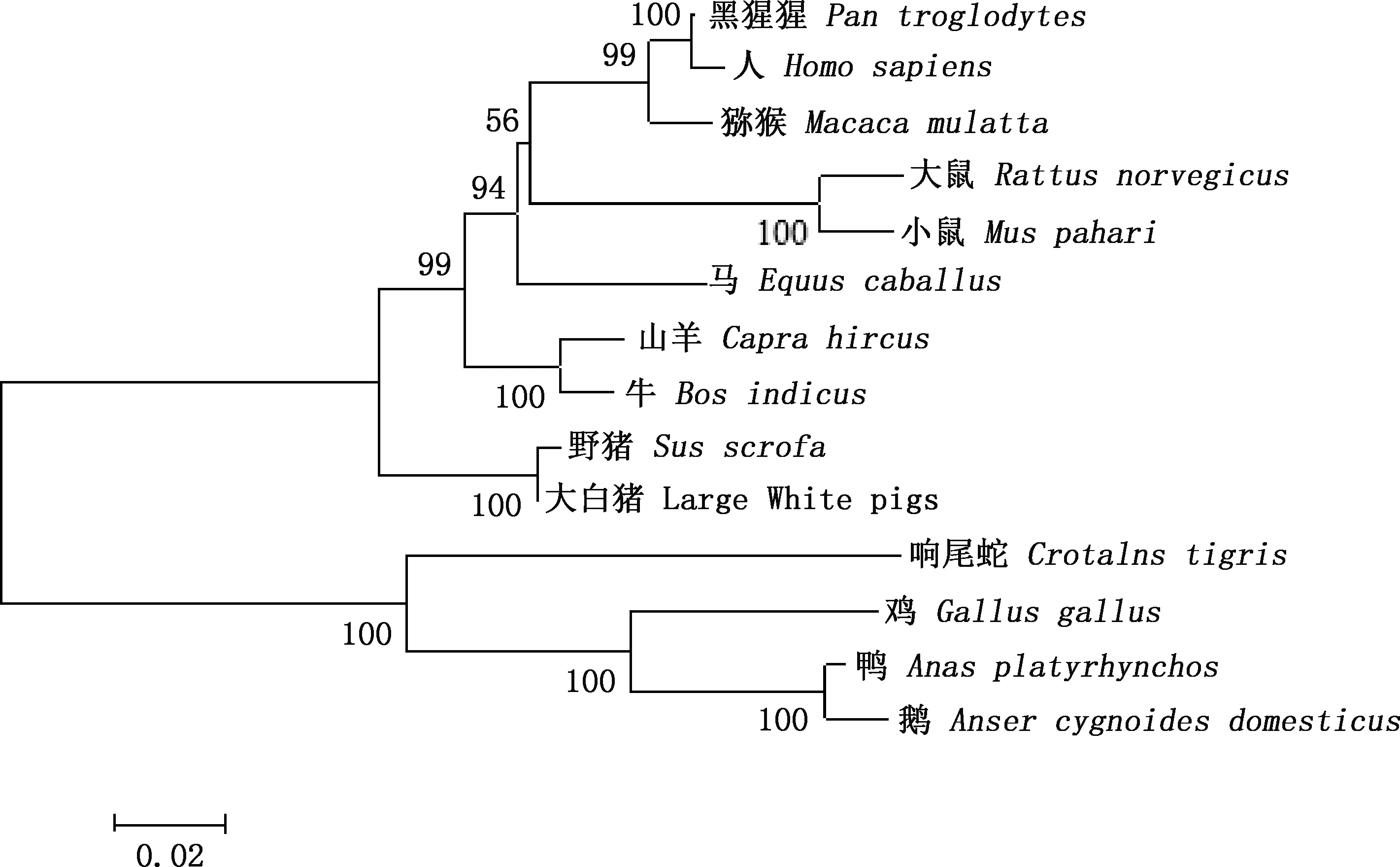
图3 TRIM3基因系统进化树
2.3 TRIM3蛋白生物信息学分析
2.3.1 理化性质、糖基化和磷酸化位点预测 大白猪TRIM3蛋白由744个氨基酸组成,分子式为C3514H5614N1048O1071S28,分子质量为80.58 ku,理论等电点(pI)为8.32,偏碱性。该蛋白含有20种必需氨基酸,其中含量最多的是甘氨酸(9.4%),亮氨酸(9.0%)次之(表2)。预测不稳定系数为40.85,证明TRIM3编码蛋白不稳定;理论半衰期在体外哺乳动物网织红细胞中为30 h,在酵母体内>20 h且在大肠杆菌体内>10 h。亲水性平均值(GRAVY)为-0.312,因此TRIM3蛋白为亲水性蛋白;不含N-糖基化位点和O-糖基化位点;可能存在60个磷酸化位点,其中丝氨酸(Ser)磷酸化位点40个、苏氨酸(Thr)磷酸化位点14个、酪氨酸(Tyr)磷酸化位点6个(图4)。
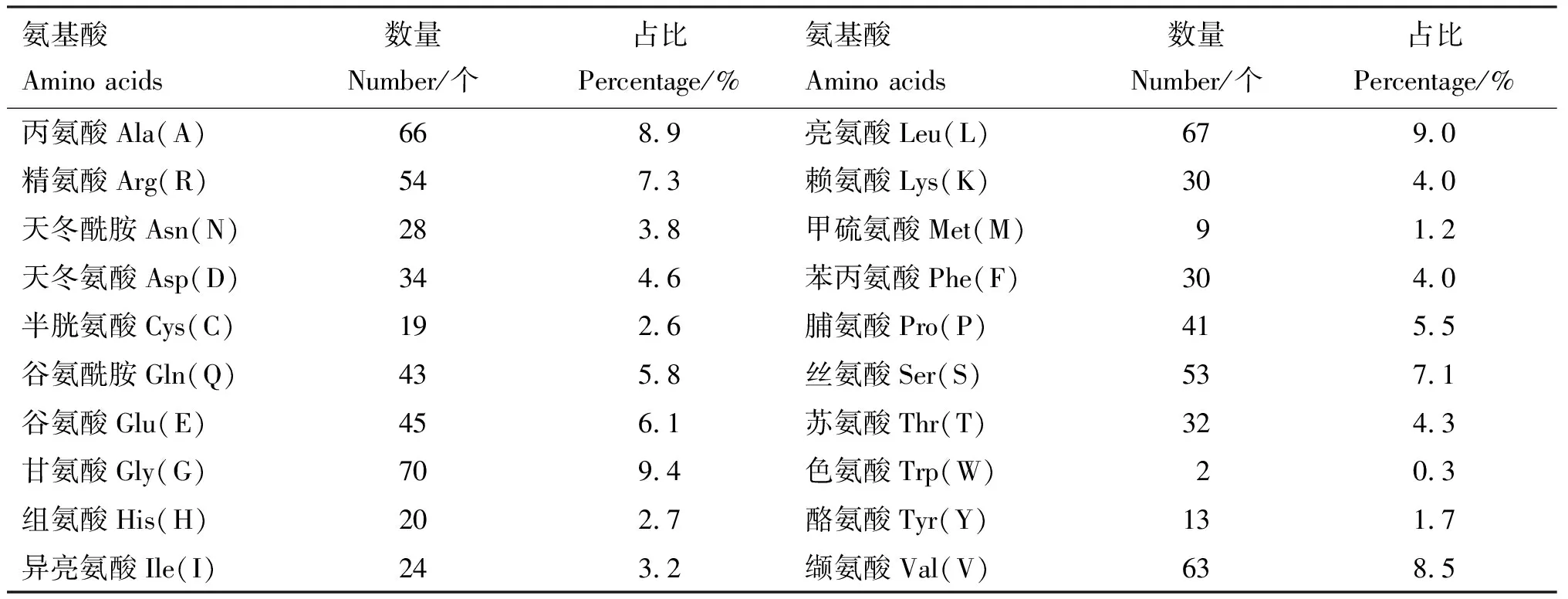
表2 猪TRIM3蛋白氨基酸组成
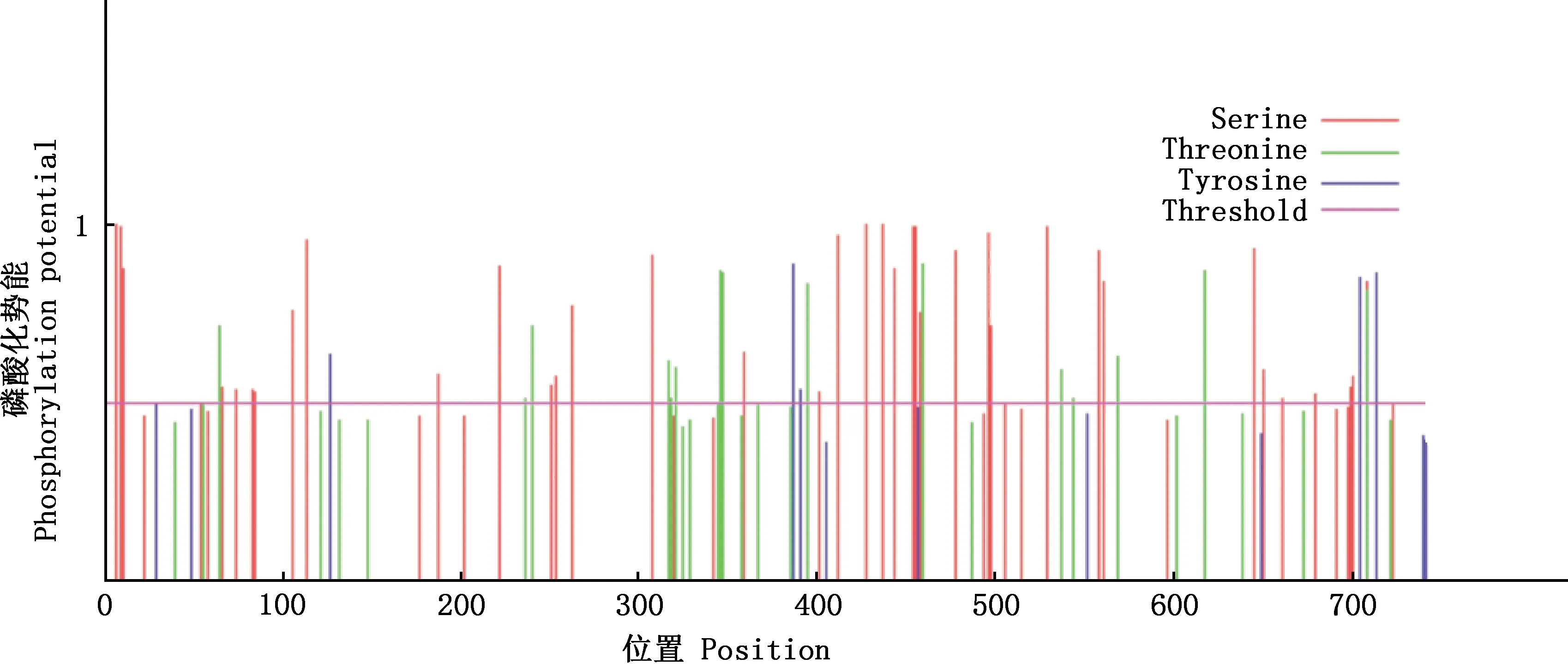
图4 猪TRIM3蛋白磷酸化位点预测
2.3.2 亲/疏水性预测 利用ExPASy中ProtScale程序对大白猪TRIM3蛋白进行亲/疏水性分析,结果显示第182位氨基酸处有最大疏水值为2.400,第466位氨基酸处有最小亲水值为-2.600(图5),即TRIM3为亲水性蛋白。
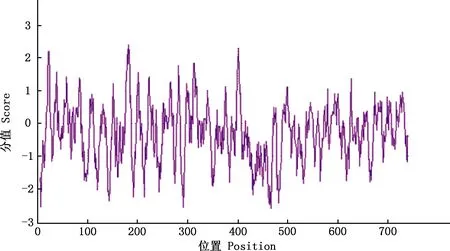
图5 猪TRIM3蛋白亲/疏水性预测
2.3.3 亚细胞定位 大白猪TRIM3蛋白亚细胞定位预测结果显示,TRIM3蛋白分布于细胞质、细胞核、过氧化物酶体和线粒体中,占比分别为52.2%、30.4%、8.7%和8.7%。
2.3.4 信号肽和跨膜螺旋结构预测 蛋白潜在信号肽剪切位点预测结果显示,大白猪TRIM3蛋白没有信号肽裂解位点。剪切位点分值(C值)为0.088(<0.32),无剪切位点;信号肽分值(S值)为0.176(<0.87),无信号肽;综合剪切点分值(Y值)为0.071(<0.33);S平均值为0.059(<0.48),不属于分泌蛋白;大白猪TRIM3蛋白D值为0.065,推测TRIM3蛋白不含有信号肽且不属于分泌蛋白(图6)。对大白猪TRIM3蛋白跨膜结构域预测显示,TRIM3蛋白所有氨基酸均在细胞膜外;无跨膜螺旋结构(图7),说明大白猪TRIM3蛋白为膜外蛋白。
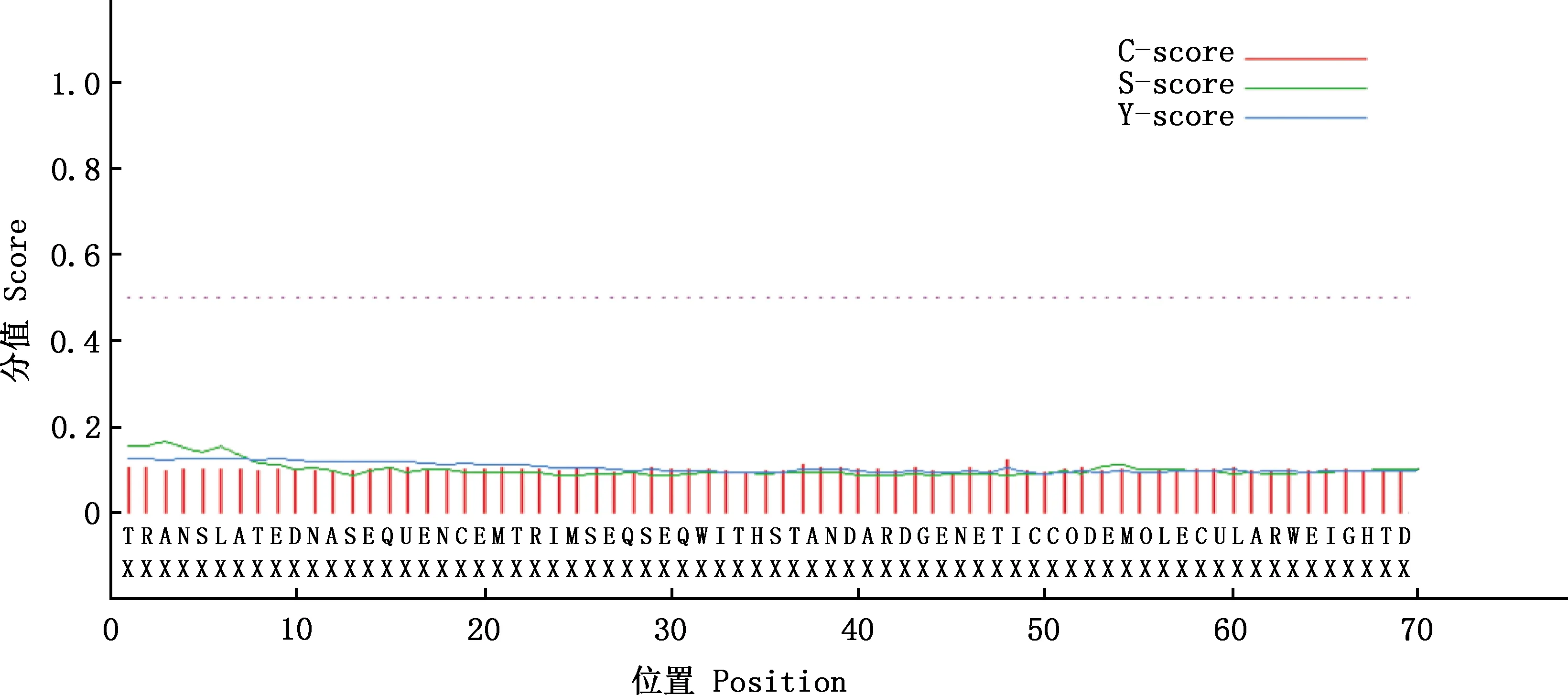
图6 猪TRIM3蛋白信号肽预测

图7 猪TRIM3蛋白跨膜结构域预测
2.3.5 二级结构和三级结构预测 利用SOPMA在线程序对大白猪TRIM3蛋白二级结构进行预测,结果显示α-螺旋、β-转角、无规则卷曲和延伸链分别占26.08%、8.60%、41.67%和23.66%(图8)。利用SWISS-MODEL在线程序构建大白猪TRIM3蛋白可能的三级结构模型,结果见图9,全局模型质量估计值为0.35,与模板的相似性为81.52%,说明模型构建合理。
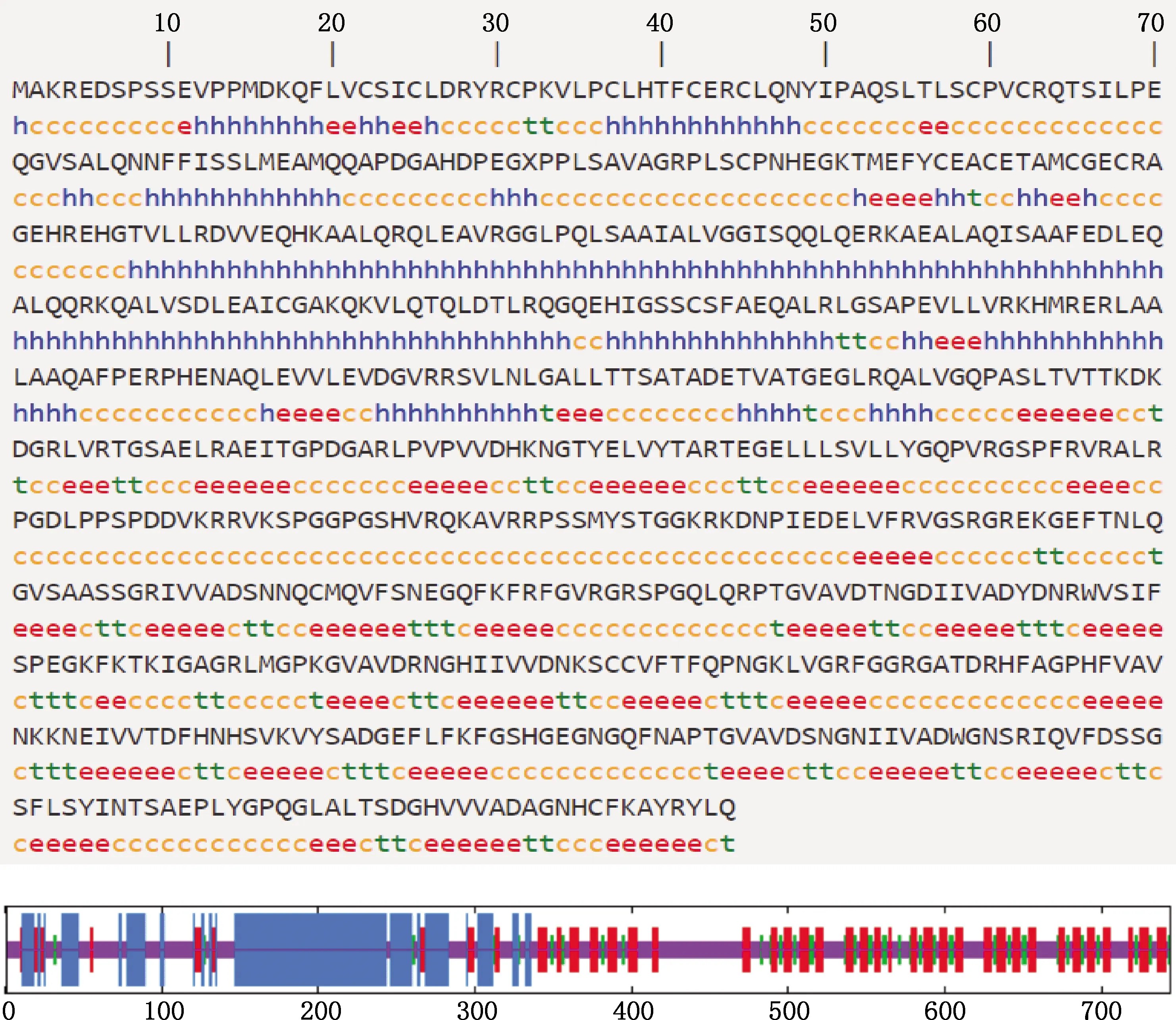
c和最短线,无规则卷曲;h和最长线,α-螺旋;e和中长线,延伸链;t和中短线,β-转角
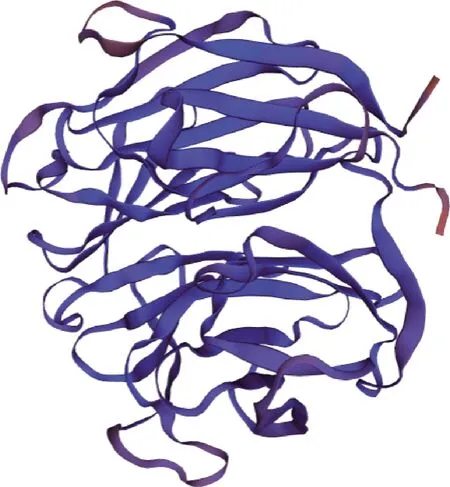
图9 猪TRIM3蛋白三级结构预测
2.4 猪TRIM3基因在不同组织中的相对表达量
由图10可知,TRIM3基因在猪心脏、肝脏、脾脏、肺脏、肾脏、肌肉、气管和结肠组织中均有表达,其中,在肺脏中的相对表达量最高,且显著高于其他组织(P<0.05);在肾脏中的表达量次之;在心脏、肌肉和结肠中的相对表达量最少,且显著低于其他组织(P<0.05)。

肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)
3 讨 论
本试验成功克隆大白猪TRIM3基因,并对该基因核苷酸序列与其他几个物种进行相似性比对,比对结果与系统进化树结果保持一致,显示大白猪与野猪亲缘关系最近,与鸭亲缘关系最远,证实TRIM3序列在各物种间具有高度保守性,符合生物进化特征,且具有广泛的同源性。TRIM3氨基酸序列不稳定,说明TRIM3蛋白容易失去活性;TRIM3蛋白没有信号肽位点,说明TRIM3蛋白不能转运,只会滞留到合成部位;TRIM3蛋白具有60个磷酸化位点,推测其可能参与某些细胞通路的调节,这与之前的报道一致[20]。TRIM3蛋白氨基酸序列亲水性残基多于疏水性残基,表现为亲水性,进一步说明TRIM3属于不稳定蛋白。亚细胞定位显示TRIM3蛋白主要位于细胞质,这在预测蛋白跨膜结构域中进一步得到证实,说明TRIM3蛋白可能在细胞质中合成。TRIM3蛋白二级结构和三级结构预测结果一致,为进一步了解TRIM3蛋白的功能奠定基础。总之,对TRIM3蛋白生物学功能的预测有利于揭示其可能参与的生物进程,为进一步研究TRIM3参与抗病毒天然免疫提供理论基础。
实时荧光定量PCR检测结果表明,TRIM3基因在大白猪不同组织中均有表达,这可能与TRIM3可通过各种途径介导肿瘤发生及转移过程相关[21-25];在肺脏中的相对表达量最高,在气管中的表达量也较高,说明该基因与呼吸系统的调节密切相关,为猪呼吸系统疾病的治疗提供参考;在肾脏中表达量较高,可能与之前报道的TRIM3过表达通过抑制干扰素调节因子3途径和NLRP3炎症小体预防急性肾损伤[26]相关;在脾脏中表达量较高,推测其与猪的免疫功能有关。研究报道,鼠源TRIM3泛素连接酶影响海马神经元树突状脊柱形态[27],斑马鱼的TRIM3a在神经系统的发育及神经信号的传导中起重要作用[28],人源TRIM3可通过激活PI3K/Akt信号通路减轻帕金森病的细胞凋亡,提示TRIM3在神经系统调节中发挥作用,猪源TRIM3是否参与神经系统的调节还有待进一步探索。
激活先天免疫是宿主抵御病原体的必要条件。已报道猪源TRIM21依赖于RING结构域和蛋白酶体抑制猪繁殖与呼吸障碍综合征病毒的复制,但不影响病毒附着和内吞[16]。在抑制猪流行性腹泻病毒增殖中TRIM21通过蛋白酶体途径靶向并降解核衣壳蛋白[29]。之前研究表明,TRIM3是一种高度保守的E3泛素连接酶,通过泛素化TLR3以引起先天抗病毒反应,但具体的作用机制尚未解释清楚,病毒蛋白与宿主蛋白的相互作用还需进一步验证[20]。本研究成功克隆大白猪TRIM3基因,并对其理化性质进行预测,为揭示抗病毒天然免疫反应,提高猪体免疫力抵抗病毒感染提供理论依据。
4 结 论
本研究成功克隆大白猪TRIM3基因CDS全长序列,其片段长度为2 235 bp,编码744个氨基酸,属于亲水性蛋白,二级结构中α-螺旋、β-转角、无规则卷曲和延伸链分别占26.08%、8.60%、41.67%和23.66%,以无规则卷曲为主,属于不稳定蛋白。TRIM3基因在猪各组织中均有表达,在肺脏中表达量最多,且极显著高于其他组织。本试验结果为进一步研究TRIM3基因的免疫学特点及参与猪先天免疫和抗病毒感染中的分子机制提供理论依据。

