鹅粪便中特基拉芽孢杆菌和类肠膜魏斯氏菌的分离鉴定
魏 笑,王秋菊,孙 愉,张 昊,李畅洋,陶燕子
(黑龙江八一农垦大学动物科技学院,大庆 163319)
微生物制剂具有维持肠道菌群平衡,分泌益生物质提高动物免疫力,改善食物消化和吸收,诱导免疫反应等优点,为抗菌药替代物的研发提供了依据和保障,逐渐被人们接受并广泛应用在养殖业上,以达到预防疾病、促进畜牧业健康发展的目的,因此需要进一步了解其最佳的生长环境及主要的功能。特基拉芽孢杆菌是一种产芽孢的革兰氏阳性杆菌,严格好氧。芽孢杆菌属产生的芽孢对植物病原体具有抑制能力,研究表明特基拉芽孢杆菌抑菌谱广,具有较高的生防能力,是天然的抗菌活性物质[1],尤其对植物的土传病害——青枯病有良好的防治效果。周瑚等[2]研究发现,特基拉芽孢杆菌有稳定的抑菌作用,对高温、紫外线和酸碱环境有较强抵抗性,Oberoi等[3]报道,抗菌蛋白的温度和酸碱度稳定性对其产品的研发应用起关键作用,可用特基拉芽孢杆菌制成农药。孙龙龙[4]研究发现,特基拉芽孢杆菌可以提高鲫的消化能力、抗氧化能力和免疫力,并增加鲫肠道菌群中有益菌的丰度,降低有害菌的丰度。因此特基拉芽孢杆菌具有较强的抗菌、助消化及改善肠道菌群丰度的功能,可以进一步作为功能菌开发利用。魏斯氏菌是一种存在于发酵产品中的革兰氏阳性乳酸菌,不运动不产生孢子,兼性厌氧,呈不规则的短杆状。研究表明,类肠膜魏斯氏菌产酸能力高,对大肠杆菌、金黄色葡萄球菌和沙门氏菌有良好的抑制作用[5]。刘韶娜[6]研究表明,类肠膜魏斯氏菌能够降低猪粪便中的粗蛋白和铵态氮,降低猪的腹泻率和便秘率,能够提高肠道内的脂肪酸含量并促进脂类代谢和维生素合成。由此可见类肠膜魏斯氏菌可作为猪饲料添加剂应用,但在禽上的应用还鲜见报道。本试验拟从鹅肠道中分离芽孢杆菌属和乳杆菌属细菌,检测其最佳生长时间、pH和温度及其对酸碱度、胆盐和抗菌药的耐受性,旨在为后续作为功能菌开发提供参考。
1 材料与方法
1.1 材料
1.1.1 样品 选取黑龙江省某畜牧场50周龄左右健康的体重为(6.7±1.2)kg的大群散养北方白鹅种鹅30只,在采食30 min后,取粪盒悬挂于鹅的泄殖腔外收集新鲜直肠粪便。将收集的粪便放入装有冰袋的保温盒中带回实验室。
1.1.2 主要试剂 甘露醇卵黄多黏菌素培养基(HB0248)、MRS培养基(HB0109)、LB肉汤培养基(HB0128)、Mueller-Hinton琼脂(HB6232)均购自青岛海博生物科技有限公司;醋酸铅培养基(L8490)购自北京索莱宝科技有限公司;羧甲基纤维素钠培养基购自山东拓普生物工程有限公司。抗菌药庆大霉素、卡那霉素、链霉素、四环素、头孢呋辛、头孢唑啉、头孢噻肟、氨苄西林、克拉霉素、红霉素、复方新诺明、呋喃妥因、氧氟沙星、诺氟沙星、环丙沙星、万古霉素均购自杭州滨河微生物试剂有限公司。
1.1.3 培养基配制 ①硝酸盐还原培养基:100 mL蒸馏水中加入1.00 g琥珀酸钠、0.10 g硝酸钠、0.10 g磷酸二氢钾、0.05 g七水硝酸镁、0.02 g氯化钾。②淀粉培养基:100 mL蒸馏水中加入2.00 g可溶性淀粉、0.50 g蛋白胨、0.50 g氯化钠、2.00 g琼脂,pH 7.0。③酪素培养基:100 mL蒸馏水中加入1.00 g干酪素、0.10 g酵母膏、2.00 g琼脂。④酸性汞指示剂:100 mL蒸馏水中加入15.00 g氯化汞、20 mL浓盐酸。配制后,121 ℃高压灭菌15 min后倒入培养皿中待用。
1.2 方法
1.2.1 细菌的分离 按1 g/只分别称取30只鹅的粪便,各加入9 mL生理盐水振荡混匀,取100 μL混合液加900 μL生理盐水进行倍比稀释,取稀释到10-6、10-7、10-8的菌液各100 μL加入到已配好的MRS固体培养基中,用涂布棒涂抹均匀,37 ℃恒温培养箱中培养48 h。用接种环挑取单一菌落重新划线培养,重复3~4次。
1.2.2 细菌筛选及生化鉴定 通特异性培养基和革兰氏染色对所得菌株进行形态上的初步筛选,保留形态明显的菌株。将初筛的细菌纯化后分别接种至LB肉汤中培养,再通过硝酸盐还原、产淀粉酶、产硫化氢、产纤维素酶、产蛋白酶和接触酶试验等生化反应进一步筛选。
1.2.3 16S rDNA鉴定 采用煮沸法提取细菌DNA。利用细菌16S rDNA基因通用引物343F:5′-TACGGRAGGCAGCAG-3′和798R:5′-AGGG-TATCTAATCCT-3′[7]进行PCR扩增。PCR反应体系25 μL:2×PremixTaq12.5 μL,上、下游引物各1 μL,DNA 2 μL,ddH2O 8.5 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,64 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃终延伸10 min;4 ℃保存。将得到的PCR产物进行1.0%琼脂糖凝胶电泳,检测DNA的大小及浓度,并PCR扩增产物送生工生物工程(上海)股份有限公司进行16S rDNA测序。最后获得的DNA部分序列与GenBank中参考菌株特基拉牙孢杆菌(Bacillustequilensis)、枯草牙孢杆菌(Bacillussubtitis)等序列进行比对,用Mega 11.0构建进化树,用MegAlign进行相似性比对。
1.2.4 生长曲线绘制 取100 μL筛选出的分离菌菌液按2.0%接种量分别接种到5 mL LB液体培养基中,以未接种细菌的LB液体培养基为对照,37 ℃、150 r/min摇床中培养,分别在0、2、4、6、8、10、12、14、16、18、20、22、24、36、48 h时取培养液测量D600 nm值,以时间为横坐标、D600 nm值为纵坐标绘制生长曲线。
1.2.5 细菌培养基酸碱度测定 用HCl和NaOH将LB液体培养基pH调至6.0、6.5、7.0、7.5、8.0,取100 μL筛选出的分离菌菌液按2.0%接种量接种,以未接种菌液的LB液体培养基为空白对照,37 ℃、150 r/min摇床中培养24 h,测量D600 nm值。
1.2.6 细菌适宜培养温度测定 取100 μL筛选出的分离菌菌液分别接种到5 mL LB液体培养中,分别将温度调至36.0、36.5、37.0、37.5和38 ℃,以未接种菌液的LB培养基作为空白对照,培养24 h后测量D600 nm值。
1.2.7 酸性和高胆盐浓度环境下细菌存活率测定 取筛选出的分离菌菌液接至pH=7.0的LB液体培养基中作为耐酸试验的空白对照,将菌液接至无胆盐的LB液体培养基中为耐胆盐试验的空白对照,分别将菌液接至pH为2.0、2.5、3.0、3.5、4.0及胆盐浓度为0.3%、0.6%、0.9%、1.2%、1.5%、1.8%的培养基中,37 ℃、150 r/min摇床中培养24 h,测定D600 nm值。酸性环境下细菌存活率(%)=各pH组D600 nm值/未经酸处理组D600 nm值×100%;高胆盐浓度环境下细菌存活率(%)=各胆盐浓度组D600 nm值/无胆盐组D600 nm值×100%。
1.2.8 抗菌药耐受性测定 取100 μL筛选出的分离菌菌液,活菌数>1×109CFU/mL,分别涂布到MH培养基中,用涂布棒涂抹均匀,放置抗菌药药片,轻轻压实,置恒温培养箱内培养24 h,并用直尺测量抑菌圈直径,以美国SCLA抗微生物敏感性试验执行标准M100做比较以判定菌株药物敏感性(表1)。

表1 药物敏感性判断标准
2 结 果
2.1 细菌的分离及生化鉴定
利用MRS培养基分离乳酸菌,在培养基上形成表面光滑的乳白色菌落,革兰氏染色呈长杆状、产芽孢的菌体,为革兰氏阳性菌(图1A);芽孢杆菌使甘露醇卵黄多黏菌素培养基变色,在表面形成不透明的白色菌落,革兰氏染色呈短杆状、单个或链状排列的菌体,为革兰氏阳性菌(图1B)。从30只鹅中共获得9株菌,3株为乳酸菌(编号1~3),6株为芽孢杆菌(编号4~9)。由表2生化试验结果可知,乳酸菌中2号产淀粉酶和纤维素酶,芽孢杆菌中7号产淀粉酶、纤维素酶和蛋白酶,属于产酶较多的菌株,因此选择这2株进行后续试验,并分别编号为2020V1和2020V2。

A,乳酸菌;B,牙孢杆菌

表2 细菌生化试验结果
2.2 细菌种属的鉴定
由图2可知,1.0%琼脂糖凝胶电泳结果表明2株细菌DNA大小均在1 600 bp左右。由图3、4可知,2020V1菌株和NCBI库中序列编号KU601351.1的细菌进化距离为100,相似性为99.9%;2020V2菌株和NCBI库中序列编号MT975238.1的细菌进化距离为100,相似性为99.9%,因此确定2020V1为特基拉芽孢杆菌CC2FG2,2020V2为类肠膜魏斯氏菌JY0R2。

1~4,2020V1;5~9,2020V2;M,DL2000 DNA Marker

图3 2020V1(A)和2020V2(B)菌株基于16S rDNA基因的进化树

图4 2020V1(A)和2020V2(B)菌株相似性比对
2.3 细菌生长曲线
由图5可知,2020V1菌株的菌液浓度从4 h开始迅速增加,到16 h时到达对数生长期顶峰,随后进入稳定期,浓度变化不大;2020V2菌株在培养4 h后菌液浓度大幅增加进入对数生长期,18 h时进入生长稳定期浓度不再发生较大波动。因此后续试验中为获得最高活菌数,2020V1菌株至少培养16 h,2020V2菌株至少培养18 h。

图5 2020V1和2020V2菌株生长曲线
2.4 细菌培养基酸碱度测定
由图6知,2020V1菌株在pH为6.5的环境下生长较好,2020V12菌株在pH为6.0的偏酸性环境下生长状况良好。
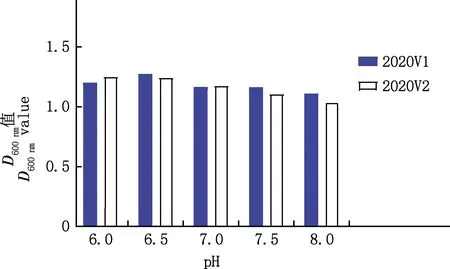
图6 不同pH下2020V1和2020V2菌株的浓度
2.5 细菌适宜培养温度测定
由图7可知,2020V1菌株在环境温度为36 ℃时D600 nm值最高,且随着温度升高D600 nm值逐渐降低;2020V2菌株在36.5 ℃时D600 nm值最高,36.5 ℃前后随着温度的降低或升高,D600 nm值均降低。
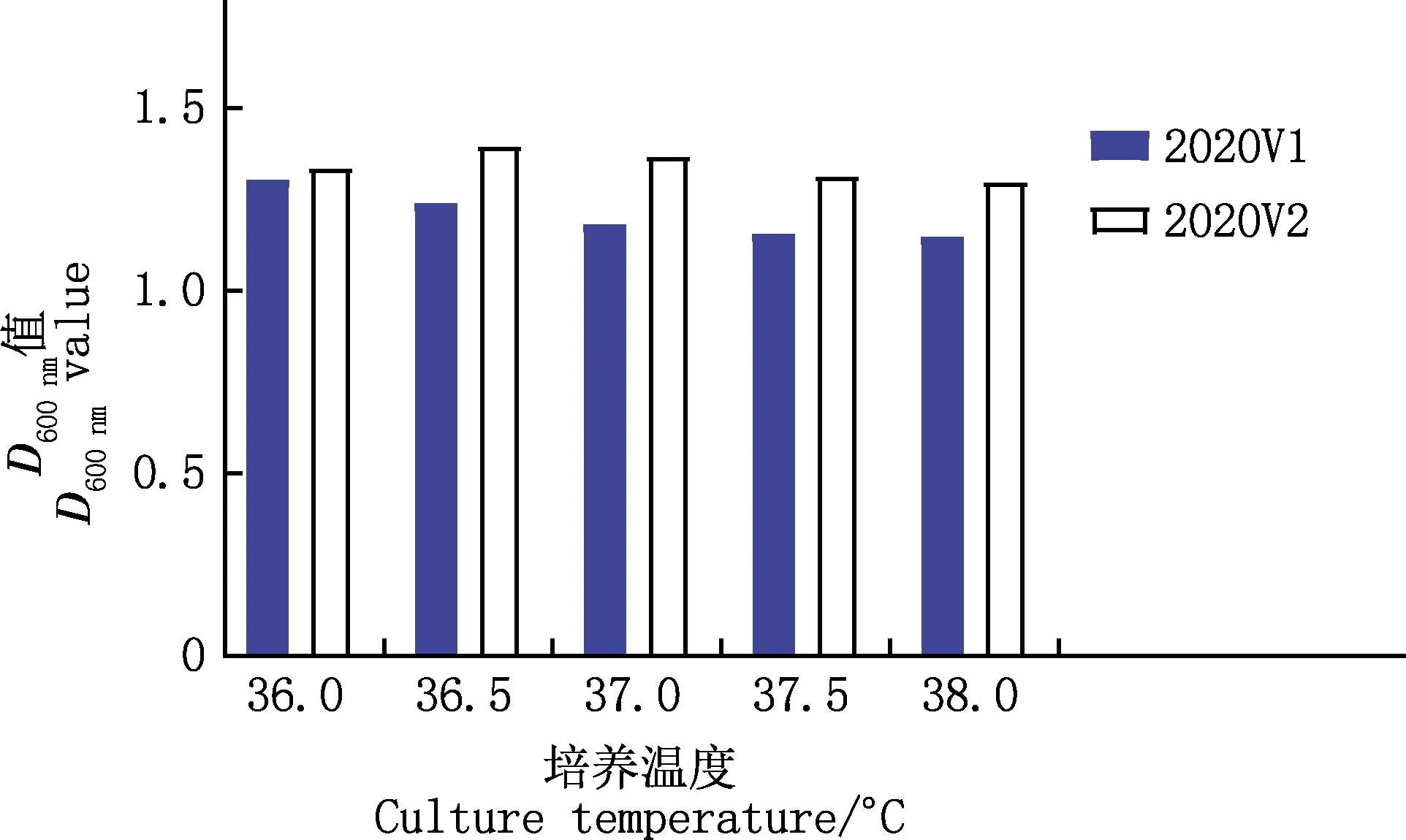
图7 不同温度下2020V1和2020V2菌株的浓度
2.6 酸性和高胆盐浓度环境下细菌存活率测定
2020V1和2020V2菌株在酸性和高胆盐浓度浓度环境下的存活率如表3和4所示。由表3可知,在pH=3.5环境下2株菌均能生长繁殖,且存活率超过半数,说明2株菌都具有耐酸能力。由表4可知,2020V1菌株能在1.5%胆盐浓度环境下生长繁殖,且存活率超过半数,2020V2菌株在1.2%胆盐浓度环境下存活超过半数,说明2株菌均具有较好的耐胆盐能力,且2020V1菌株的耐受力高于2020V2菌株。

表3 不同pH环境下2020V1和2020V2菌株的存活率

表4 不同胆盐浓度下2020V1和2020V2菌株的存活率
2.7 抗菌药耐受性的测定
由表5可知,20202V1菌株对头孢呋辛、头孢唑林、头孢噻肟、氨苄西林、呋喃妥因、环丙沙星、庆大霉素和四环素不敏感;对氧氟沙星、诺氟沙星、卡那霉素、链霉素、克拉霉素、红霉素、复方新诺明和万古霉素敏感。2020V2菌株对头孢呋辛、头孢唑林、头孢噻肟、氨苄西林、复方新诺明、万古霉素、庆大霉素和链霉素不敏感;对呋喃妥因、四环素、卡那霉素中度敏感;对氧氟沙星、诺氟沙星、环丙沙星、克拉霉素和红霉素敏感。

表5 2020V1和2020V2菌株药物敏感试验结果
3 讨 论
特基拉芽孢杆菌和类肠膜魏斯氏菌均属于畜牧生产益生菌[8-9],也是组成畜禽肠道微生物群落重要的成员。Pradhan等[10]研究发现,特基拉芽孢杆菌可通过产生脂肽及生物表面活性剂等物质破坏病原菌的生物膜,从而起到抑菌作用。特基拉芽孢杆菌可提高血清溶菌酶、脂肪酶和肝脏谷丙转氨酶的活性,从而达到促进消化、提高免疫的作用[11]。在自然界中类肠膜魏斯氏菌是一类广泛分布于肉类、新鲜果蔬、发酵食物、青贮饲料中的乳酸菌[12],其可广泛定植于宿主肠道[13-14]。研究发现,魏斯氏菌应用于食品发酵时,可合成葡聚糖和果聚糖等低聚糖,这些低聚糖可促进人体对微量元素的吸收,减轻人体肠胃不适,促进双歧杆菌增殖[15]。本试验中,2020V1菌株属于芽孢杆菌属中的特基拉芽孢杆菌,2020V2菌株属于乳酸菌属中的类肠膜魏斯氏菌,2株菌均具有较强的耐酸耐胆盐能力,能够在肠道中定植并发挥作用,并能与部分抗菌药联合用药。
2020V1和2020V2菌株作为微生物制剂的潜在益生菌,需测定其生长特性和耐酸耐胆盐能力以确定能否经过口腔进入消化道,通过胃液和胆汁最终定植并发在肠道发挥作用。2020V1和2020V2菌株在pH为3.5环境下存活率分别为81.5%和87.6%,在胆碱浓度为1.2%环境下存活率分别为69.2%和50.6%,均超过pH=7和无胆盐组半数,证明2种微生物可以通过胃酸和胆汁且活菌数仍然保持在正常范围,说明其能够顺利定植在肠道发挥作用,这与樊炳君等[16]和李文等[17]试验结果相符。2020V1菌株的生长特性研究结果表明,在4 h达到对数生长期,在36 ℃、pH为6.5的环境下培养较好,这与王旭[18]的生长特性研究一致。2020V2菌株的生长特性结果表明,在4 h达到对数生长期,在36.5 ℃、pH为6的环境下进行培养最为适宜,与高静等[19]研究结果相符合。
为确定2020V1和2020V2菌株对抗菌药的耐受性,采用美国SCLA抗微生物敏感性试验执行标准M100作为耐药、敏感和中介值进行判定。选择与抗菌药同时使用时,注意选择那些可相容的抗菌药,试验结果显示,2020V1菌株能耐受部分β-内酰胺类、硝基呋喃类、喹诺酮类、氨基糖苷类、四环素类抗菌药,与郭佳等[20]研究的芽孢杆菌菌抗菌药耐受部分结果一致,部分结果不同可能是因为菌种虽然同属但不同种,微生物自身携带的耐药基因不同所导致,这需要后续试验来证明;2020V2菌株能耐受部分β-内酰胺类、磺胺类、糖肽类、氨基糖苷类抗菌药,这与部分乳酸菌对抗菌药耐受性结果一致。在本研究中,通过分离得到2020V1和2020V2 2株益生菌,其对抗菌药具有不同程度的耐受性,可为将来在动物治疗过程中抗菌药的选用提供理论依据。
4 结 论
本研究成功从健康成年北方白鹅直肠粪便中分离到9株细菌,生化试验鉴定为特基拉芽孢杆菌CC2FG2和类肠膜魏斯氏菌JY0R2,2种菌均具有耐酸、耐胆盐的特性。特基拉芽孢杆菌CC2FG2能与β-内酰胺类、喹诺酮类和四环素类四环素联合使用;类肠膜魏斯氏菌JY0R2能与β-内酰胺类、磺胺类、糖肽类、氨基糖苷类联合使用。该结果可为鹅源功能菌的研发及其对抗菌药的选用提供思路。

