米曲霉发酵提取甘薯中去氢表雄酮工艺优化
陈蓬凤,邹浩峰,蔡芳,隋勇,施建斌,蔡沙,熊添,陈学玲,黄师荣,梅新*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064;2.湘潭大学化工学院,湖南 湘潭 411105)
甘薯(Ipomoea batats Lan.)属于旋花科甘薯属一年生草本,又名红薯、番薯、地瓜等,我国是世界上最大的甘薯生产国和消费国,甘薯富含淀粉、蛋白质、膳食纤维、维生素和矿物质等多种营养成分[1],还含有多酚、花青素、黏蛋白、去氢表雄酮(dehydroepiandrosterone,DHEA)等多种功效成分。DHEA是一种非共轭的△5,6-双键及可酯化的3β-羟基甾体,不溶于水,溶于石油醚、苯、氯仿、甲醇等有机溶剂。DHEA是人体血液循环中最为丰富的甾体物质,不仅直接参与人体甾体激素的合成,还具有调节免疫力、抗肿瘤、减肥、改善卵巢功能等多种功效[2-7]。
目前DHEA主要依赖于化学合成,合成步骤复杂,中间产物较多,DHEA得率和纯度不易控制[8-9]。相比之下,微生物法反应条件温和,各种酶促反应可实现DHEA充分游离。周配[10]采用微生物发法,通过微生物代谢酶对甾醇侧链进行专一性酶解,优化了以菜籽甾醇、谷甾醇等植物甾醇为底物高效制备DHEA的工艺。与黄姜等原料中薯蓣皂素的存在形式相似,甘薯中DHEA并不是以游离形式存在,而是与葡萄糖结合成皂甙存在于细胞内[3]。在相关研究中,甘薯中DHEA的提取工艺主要参考薯蓣皂素的提取方法[11-13],包括预发酵、酸水解、索氏提取等步骤,而酸水解所使用的硫酸、盐酸等强酸,易使皂甙裂解而破坏DHEA的结构,并同时产生大量酸性废液难以处理,因此,亟需开发更为高效、环保的甘薯中DHEA提取方法。
米曲霉(Aspergillus oryzae)是食品工业中常用的微生物,含有淀粉酶、糖化酶、纤维素酶等多种酶系,其中,纤维素酶系的重要组分β-葡萄糖苷酶可水解多种糖苷键。目前,已有采用米曲霉发酵制备薯蓣皂素的报道[14-15],但尚未见米曲霉发酵制备DHEA相关研究。本文以甘薯生全粉为原料,在对米曲酶发酵提取物定性分析基础上,采用单因素与响应面试验优化米曲霉发酵提取甘薯中DHEA工艺,旨在为甘薯中功效成分高效提取及高附加值产品开发提供依据。
1 材料与方法
1.1 材料与试剂
甘薯生全粉:湖北根聚地农业发展股份有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:青岛高科技工业园海博生物技术有限公司;米曲霉孢子粉:沂水(山东临沂)锦润生物科技有限公司;蛋白胨:北京双旋微生物培养基制品厂;石油醚、氢氧化钠、氯化钠、浓HCl、浓H2SO4(均为分析纯):国药集团化学试剂有限公司;DHEA标准溶液(1 mg/mL,甲醇为溶剂):Sigma-aidrich(上海)贸易有限公司;甲醇(色谱级):Thermo Fisher科技(中国)有限公司。
1.2 仪器与设备
Waters alliance e2695高效液相色谱仪:沃特世科技有限公司;UV-2800紫外可见分光光度计:尤尼柯(上海)仪器有限公司;BCM-1000型生物洁净工作台:苏州鸿基洁净科技股份有限公司;SHP-250生化培养箱、GZX-9240 MBE电热鼓风干燥箱:上海精宏试验设备有限公司;YM 75立式压力蒸汽灭菌器:上海三申医疗器械公司;SB-5200D超声波清洗器:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 米曲霉孢子悬浮液制备
无菌条件下,取两环米曲霉孢子粉接种于已灭菌的PDA斜面培养基上,于30℃下培养7 d,至斜面铺满绿色新生孢子,后用0.9%无菌生理盐水将斜面新生孢子冲洗于无菌锥形瓶中,加入0.05%(体积比)吐温20,于30℃,150 r/min下振荡20 min混匀后经灭菌纱布过滤,收集滤液,用0.9%无菌生理盐水冲洗滤渣2次~3次,合并收集滤液,用生理盐水调整滤液中孢子浓度至1×107个/mL~3×107个/mL,即得米曲霉孢子悬浮液。
1.3.2 米曲霉发酵提取DHEA工艺
蛋白胨与甘薯生全粉按质量比4%混合,再按一定液固比加入去离子水,搅拌混匀后置于121℃下灭菌15 min得发酵培养基,按一定体积比于发酵培养基中接种米曲霉孢子悬浮液,发酵一段时间后高温灭菌终止发酵,发酵后培养基冷却后于4 000 r/min下离心15 min,收集沉淀于50℃下干燥并粉碎过60目筛得发酵产物。发酵产物按10∶1(mL/g)液固比与石油醚充分混匀后于500 W下超声辅助提取3次,每次20 min,合并收集提取液,旋蒸去除石油醚,再用色谱级甲醇定容至5 mL,得DHEA提取物。
1.3.3 提取物中DHEA的定性定量分析
采用紫外-可见分光光度计对DHEA标准溶液与提取物进行紫外光谱扫描;在此基础上,采用高效液相色谱(high performance liquid chromatography,HPLC)比对标准溶液与提取物中DHEA保留时间,从而对提取物中DHEA结构进行定性分析。在定性分析基础上,采用HPLC对提取物中DHEA含量进行测定,根据DHEA标准溶液峰面积、DHEA提取物峰面积,计算DHEA得率。色谱条件:流动相为甲醇:水=80∶20(体积比)、流速 0.4 mL/min、柱温 42 ℃、进样量 10 μL,检测波长200 nm。DHEA得率计算方法如下。
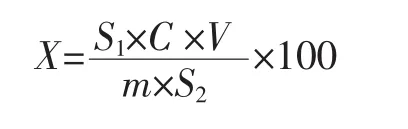
式中:X 为 DHEA 得率,μg/100 g;S1为 DHEA 提取物峰面积;S2为DHEA标准溶液峰面积;V为提取物定容体积,mL;C为标准溶液浓度,μg/mL;m为甘薯生全粉样品质量,g。
1.3.4 单因素试验
分别考察米曲霉孢子悬浮液的接种量(以下简称接种量)(4%、6%、8%、10%、12%)、发酵时间(36、48、60、72、84 h)、发酵温度(26、28、30、32、34 ℃)、液固比[5∶1、10∶1、15∶1、20∶1、25∶1(mL/g)]等因素对以甘薯生全粉为原料米曲酶发酵提取DHEA得率的影响。单因素试验过程中,在探讨其他单因素时,接种量、发酵温度、发酵时间、液固比、分别设定为6%、30℃、72h和15∶1(mL/g)。
1.3.5 响应面及对比试验
基于单因素试验,根据Box-Behnken试验设计原理,确定中心组合试验因素与水平,以DHEA得率为响应值进行响应面试验,优化以甘薯生全粉为原料米曲霉发酵提取DHEA的工艺条件,并与酶解法、预发酵-酸解法提取甘薯DHEA的得率进行对比。
预发酵-酸解法:参照杨红花等[13]的方法。取一定量甘薯生全粉,按液固比15∶1(mL/g)与去离子水混合,搅拌制成匀浆,于60℃水浴自然发酵24 h后,加入2%(体积比)浓H2SO4加至发酵后匀浆中,混合均匀后,于90℃下水解36 h,水解液加碱中和至中性,脱水收集残渣干燥。干燥残渣按液固比10∶1(mL/g)与石油醚混合并密闭提取40 min,收集提取液,减压浓缩至原来体积的1/3,旋蒸去石油醚,色谱级甲醇定容,得DHEA提取物,采用HPLC进行分析。
1.4 数据处理
所有试验均重复3次,结果以平均值±标准差表示;分别采用SPSS8.0分析处理数据、OriginPro 8.5绘图、Design-Expert 10方差回归分析。
2 结果与分析
2.1 提取物中DHEA定性分析
以DHEA标准溶液为对照,提取物中DHEA紫外扫描及色谱分析结果如图1所示。
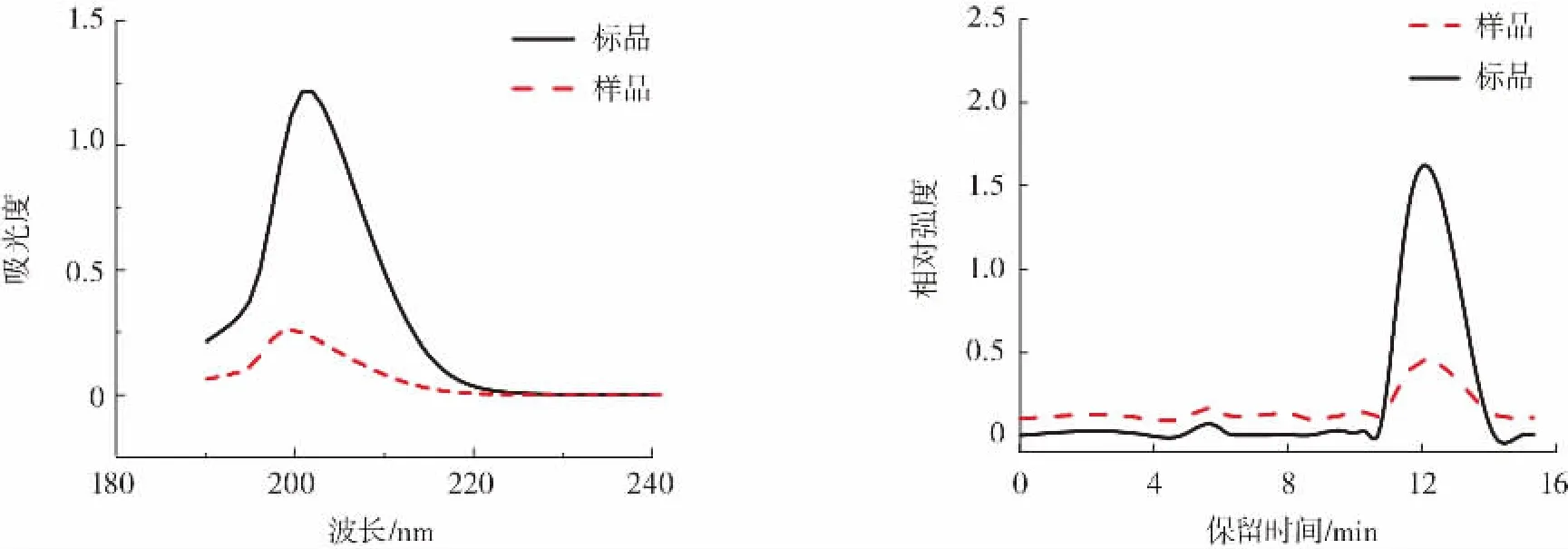
图1 DHEA标准溶液与提取物紫外光谱及色谱图Fig.1 UV spectra and chromatograms of DHEA standards and extractions
从图1中可以看出,标准溶液与提取物紫外光谱图基本一致,紫外最大吸收波长分别为201 nm和199 nm;且色谱图中二者保留时间基本吻合,可以确定提取物中含有DHEA,且结构与标准溶液中DHEA结构相同。
2.2 单因素试验结果
2.2.1 不同接种量下DHEA得率
接种量对DHEA得率的影响如图2所示。
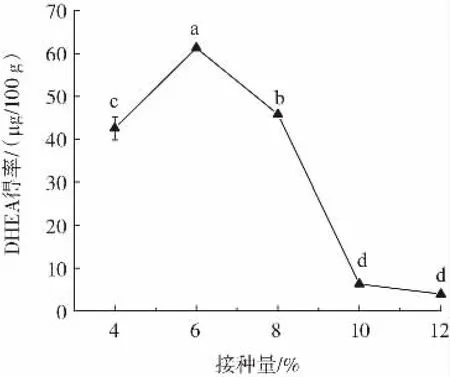
图2 接种量对DHEA得率的影响Fig.2 Effect of inoculation amount on the yield of DHEA
从图2可看出,随接种量升高,DHEA得率呈明显先上升后下降变化趋势。当接种量介于4%~10%之间时,接种量对以甘薯生全粉为原料米曲酶发酵提取DHEA得率有显著(p<0.05)影响;接种量超过10%时,继续提升接种量,DHEA得率无显著变化;接种量为6%时,DHEA得率最高,达61.32 μg/100 g。一定范围内提高米曲酶孢子悬浮液接种量,可提升培养基中营养成分利用率,丰富发酵液中酶的种类,提高酶的浓度和含量,进而提高DHEA得率[14];但接种量超过一定范围后,因短时间内米曲酶菌丝体绝对数量急剧增加,引发培养基碳源氮源快速消耗,加之发酵液溶氧量不足,最终影响菌丝体生长及酶的合成[18]。
2.2.2 不同发酵时间下DHEA得率
发酵时间对DHEA得率的影响如图3所示。
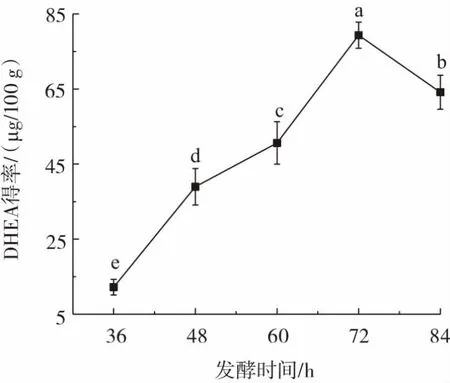
图3 发酵时间对DHEA得率的影响Fig.3 Effect of fermentation time on the yield of DHEA
从图3可看出,随发酵时间延长,DHEA得率呈显著先上升后下降变化趋势(p<0.05)。发酵36 h时,DHEA得率最低,仅为 12.20 μg/100 g;发酵 72 h 时,DHEA 得率最高,为79.34μg/100g。研究表明,发酵48h~72 h是米曲霉生长繁殖的高峰期,发酵时间不足,发酵液中菌丝体绝对数量不高,产酶不足进而影响DHEA得率[19];发酵时间太长,培养基中营养物质消耗过多,米曲酶生长减缓甚至衰亡,可水解糖苷键等酶的产量降低[20],导致培养基中DHEA不能充分游离,最终其得率下降。
张清元觉得,唐小芹是孤儿院里最漂亮的女孩。她比那帮小家伙要大一些,但比张清元要小。黎院长就叫她小芹子。小芹子是一个从下江逃难来的女人留在河口的。张清元第一次见到小芹子是在河口。他之所以能记住小芹子,是因为她的嘴唇上长有一颗鲜亮突起的黑痣,圆圆的。他听大人们说过,那颗痣就叫美人痣,乍一看有些刺眼,但看过之后就觉得这女孩漂亮,过目难忘。
2.2.3 不同发酵温度下DHEA得率
发酵温度对DHEA得率影响结果如图4所示。
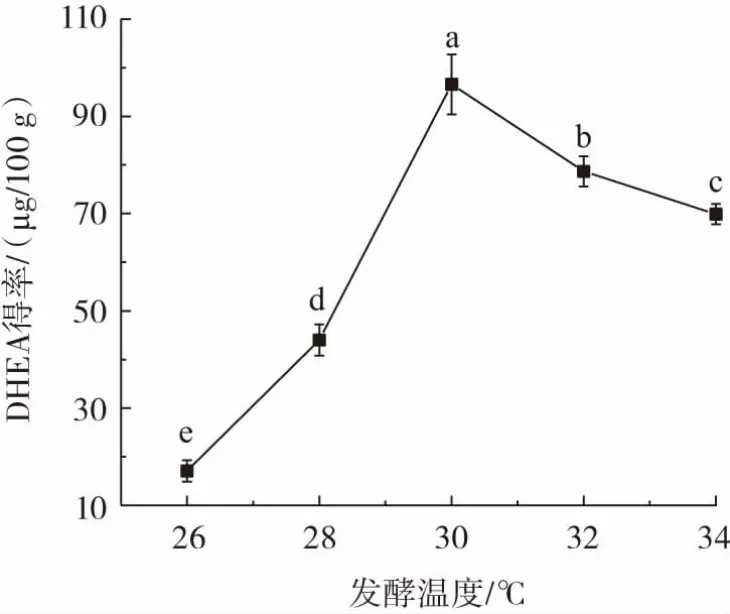
图4 发酵温度对DHEA得率的影响Fig.4 Effect of fermentation temperature on the yield of DHEA
由图4可知,DHEA得率随着发酵温度升高呈显著地(p<0.05)先上升后下降变化趋势,发酵温度为26℃时,DHEA 得率最低,仅为 17.08 μg/100 g;发酵温度为30℃时,DHEA得率最高,达96.57 μg/100 g,发酵温度超过30℃时,菌丝体老化加速,其产酶能力及酶活下降[19],导致DHEA得率降低。
2.2.4 不同液固比下DHEA得率
液固比对DHEA得率的影响如图5所示。
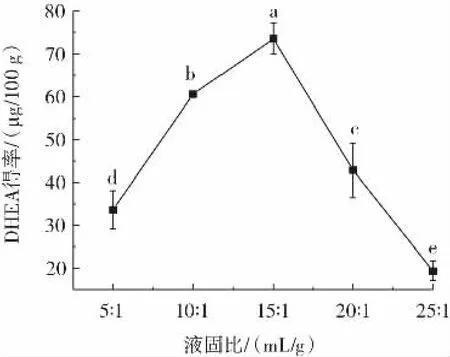
图5 液固比对DHEA得率的影响Fig.5 Effect of liquid-to-materials ratio on the yield of DHEA
从图5可看出,随液固比的升高,DHEA得率呈显著(p<0.05)地先上升后下降变化趋势。液固比为25∶1(mL/g)时,DHEA得率最低,仅为19.34μg/100g;液固比为 15∶1(mL/g)时,DHEA 得率最高,达 73.56μg/100g。液固比高低直接影响米曲酶生长环境,如营养物质的浓度、培养液渗透压以及黏度等,液固比过高或过低均不利于米曲酶生长繁殖,导致其产酶能力下降,最终影响DHEA得率[17]。
2.3 响应面法优化试验设计及结果
2.3.1 回归模型建立与方差分析
基于单因素试验结果,依据Box-Behnken中心组合试验设计原理,以接种量、发酵时间、发酵温度、液固比为自变量,DHEA得率为响应值进行响应面试验,优化以甘薯生全粉为原料米曲霉发酵提取DHEA工艺条件。选取3个中心点,进行四因素三水平试验,响应面试验设计及结果如表1所示。

表1 响应面试验设计及结果Table 1 Test design and results of response surface experiment
采用Box-Behnken方法对试验结果进行多元回归拟合,得到DHEA得率对试验自变量的二次多项回归方程:Y=96.64+7.4A+0.1B-2.43C-0.33D-5.48AB+1.75AC-0.89AD+10.82BC+1.43BD-1.02CD-34.55A2-34.82B2-43.79C2-50.21D2。
回归模型及方差分析见表2。
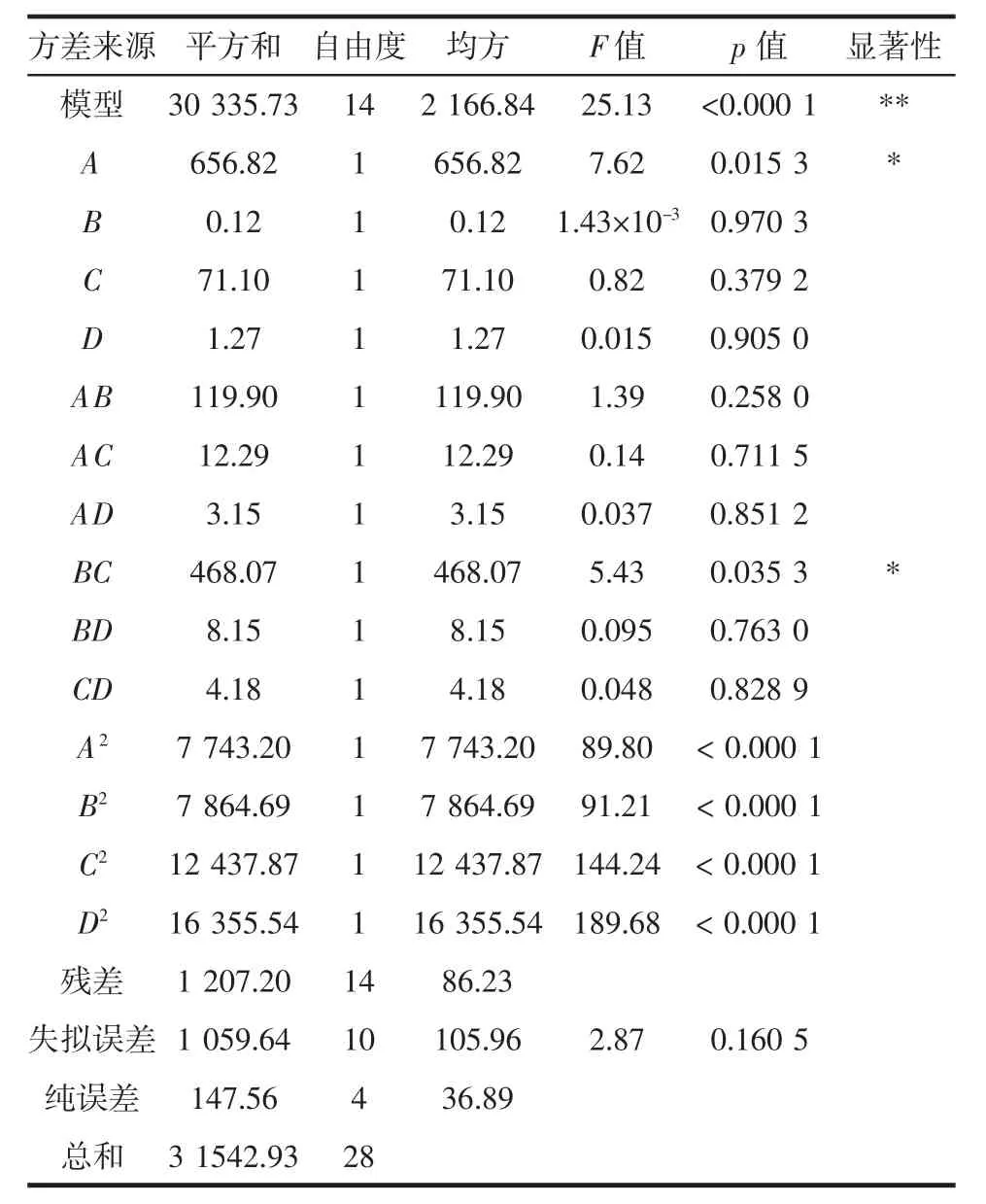
表2 回归模型及方差分析Table 2 Regression model and analysis of variance
由表2可知,回归模型极显著(p<0.01),且失拟项不显著(p>0.05),说明残差是由随机误差引起。计算结果显示,模型校正决定系数(Radj2)为0.923 5,证明该模型可解释92.35%的响应值变化;模型相关系数(R2)为0.961 7,表明该回归方程拟合度高,能用来预测以甘薯生全粉为原料米曲酶发酵提取DHEA的发酵工艺。表2还反映了4个自变量对响应值DHEA得率的影响程度,各因素对DHEA得率影响大小顺序:接种量>发酵温度>液固比>发酵时间。其中,因素A和BC的交互作用对DHEA得率有显著影响(p<0.05)。
2.3.2 响应面分析与优化
等高线图能直观展现各因素对响应值的影响程度,以及各参数之间的相互作用,圆形表明两因素间相互作用对DHEA得率的影响不显著。接种量、发酵时间、发酵温度、液固比之间交互作用对DHEA得率的影响如图6所示。
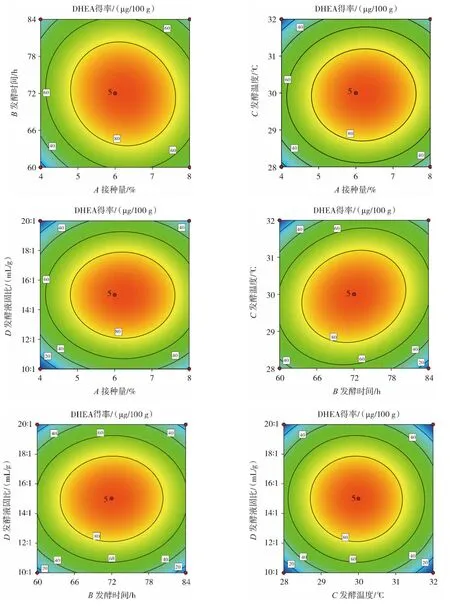
图6 各因素之间的交互作用对DHEA得率影响的等高线图Fig.6 Contour map of the influence of the interaction between various factors on the yield of DHEA
从图6的等高线图可以看出,以DHEA得率为响应值,AB、AC、AD、BD、CD 的交互作用等高线均呈圆形,说明这些因素对DHEA得率无交互影响;而BC交互作用等高线呈椭圆形,结合表2的回归模型系数显著性检验结果,表明BC间交互作用对DHEA得率有显著影响,即发酵温度与发酵时间的交互作用对DHEA得率有显著影响。响应面试验优化得到以甘薯生全粉为原料米曲霉发酵提取DHEA的最佳工艺:米曲酶孢子悬浮液接种量6.21%,发酵温度29.95℃,发酵时间71.86 h,甘薯生全粉与蛋白胨混合物与去离子水的液固比 14.98∶1(mL/g),此工艺下 DHEA 理论得率为 97.07 μg/100 g。
2.4 验证与对比试验
基于实际操作可行性,开展米曲酶发酵提取甘薯生全粉中DHEA工艺预测模型准确性的验证试验,选取接种量6%,发酵时间72 h,发酵温度30℃,液固比15∶1(mL/g)等工艺参数,DHEA 得率 94.70 μg/100 g,与理论值97.07 μg/100 g基本吻合。说明响应面分析方法对米曲霉发酵提取甘薯生全粉中DHEA的发酵条件优化是可行的。
米曲霉发酵提取甘薯生全粉中DHEA得率与其他方法比较结果如表3所示。
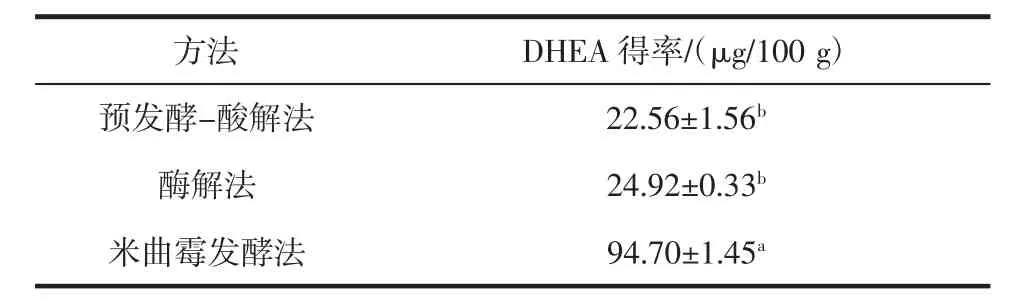
表3 不同制备方法的DHEA得率对比Table 3 Comparison of DHEA yields of different extraction methods
从表3中可看出,米曲霉发酵提取DHEA得率显著(p<0.05)高于现有的预发酵-酸解法、酶解法。
3 结论
去氢表雄酮是甘薯中一种功能性成分,目前米曲霉发酵提取甘薯中DHEA的相关研究较少。本文探讨优化以甘薯生全粉为原料米曲霉发酵提取DHEA工艺,基于单因素试验结果,进行响应面试验优化并验证得到米曲霉发酵提取甘薯生全粉中DHEA最佳工艺条件为:接种量6%,发酵温度30℃,发酵时间72 h,液固比 15∶1(mL/g),此条件下 DHEA 得率为 94.70 μg/100 g,且得率显著(p<0.05)高于现有的酶解法、预发酵-酸解法等方法。米曲霉发酵提取甘薯DHEA可为甘薯中功效成分深度发掘利用以及甘薯高附加值产品开发提供依据和技术支持。

