犬用生物药剂学分类系统的初步建立
王存才 李 康 郝智慧*
(1.中国农业大学 动物医学院/中兽医药研究中心,北京 100193;2.青岛农业大学 农用生物制药实验室,山东 青岛 266109)
生物药剂学分类系统(Biopharmaceutics classification system, BCS)是促进药品开发和监管的重要工具,通过了解化合物在生物相关介质中的溶解度及其透过生物膜的渗透性,可以确定影响药物吸收速率和程度的限制因素。并根据药物的溶解度和渗透性将其分为以下四类:第一类:高溶解度,高渗透性(吸收良好的化合物);第二类:低溶解度,高渗透性(表现为溶解率有限的吸收);第三类:高溶解度,低渗透性(表现出渗透性限制的吸收);第四类:低溶解度,低渗透性(口服生物利用度极差的化合物)。早在2000年时,美国食品和药物管理局(FDA)就已将BCS纳入到FDA的工业指南中,世界卫生组织(WHO)和欧洲药品管理局(EMA)随后也将BCS引入到了其药品管理规范中用于指导药物开发。此后,BCS成为了仿制药在体内生物等效性研究的豁免依据,不仅加快了药物筛选和新药研发速率,而且显著减少了研发成本。
随着近年来兽医药的快速发展,BCS的概念也逐渐被引入到了兽药领域。在2005年,Davis等率先探讨了BCS应用于马内服药物的可能性。此后,Martinez等和Guo等分别研究了药物在牛和猪体内的溶解度分类,并提出了相应的BCS溶解度标准。Liu等更是成功建立了适用于鸡的BCS分类系统,为其他物种BCS的建立提供了参考。令人遗憾的是,由于犬与人在胃肠道生理解剖结构上存在的巨大差异,现有的BCS分类标准的适用性尚未外推到犬中,这限制了其在犬类药物开发中的应用。
众所周知,药物溶解度是建立BCS的基本挑战之一。其中犬用内服药物的溶解主要取决于胃液体积,因为犬在给药时通常没有水共服。根据本实验室前期对犬生理常数的研究,得到了24 mL空腹胃液容积,这为犬用药物溶解度的研究提供了数据基础。此外,温度与pH也是影响药物溶解的关键因素,特别是对于具有pH依赖性的药物尤为重要。因此,如何获得犬胃肠道生理参数并得到合适的溶解度条件是建立犬用BCS亟需解决的问题。
建立BCS的另一个挑战是药物在胃肠道中的渗透性。目前,药物的吸收分数(Fa)是衡量内服药物在肠道中渗透性的主要参数,根据质量平衡测定或与静脉参考剂量比较,当被测药物在胃肠道中的吸收分数Fa≥85%时被认为是高渗透性,反之为低渗透性。在临床研究中,吸收分数可以通过平行人工膜渗透性试验(PAMPA)、体外细胞培养、肠外翻法和原位肠灌注等方法进行研究,其中原位肠灌注法的结果最接近体内实验,也是FDA指南推荐的方法,其可靠性已在大鼠和人等研究中被证实。然而,药物在犬胃肠道中渗透性的研究目前还未见报道。
基于此,本研究拟通过测量犬的胃肠道生理常数和单通道肠灌注(Single-pass intestinal perfusion, SPIP)技术建立起用于测定犬用药物溶解度条件和渗透性方法,并以此为依据初步建立犬用生物药剂学分类系统(BCS),为今后犬类内服药物的开发提供数据支撑。
1 材料与方法
1.1 药品与试剂
美托洛尔、阿莫西林、氨苄西林、多西环素、地高辛、林可霉素、盐酸美洛沙星均由中国食品药品检定研究院提供;色谱级甲醇、色谱级乙腈购于美国Fisher公司;KOH、HCl、K-R溶液、生理盐水均购于中国医药集团有限公司。
1.2 试验仪器
十万分之一分析天平(SA124S-CW)购于北京楚齐仪表有限责任公司;玻璃水银温度计购自江苏宇威医疗器械有限公司;便携式pH计购于上海雷克斯科学仪器有限公司;往复水浴恒温振荡器(SHZ-88A) 购于上海沪粤明科学仪器有限公司,蠕动泵(BT100-8)购于上海沪西公司;液相色谱仪(Agilent-1260)购于美国Agilent公司。
1.3 试验动物
12只平均体重为10 kg健康的成年比格犬(6公6母),均购于山东博龙实验动物中心。本研究经青岛农业大学动物实验专业委员会批准[许可证号:SYXK(SD)20170005],并按照青岛农业大学实验动物护理和使用指南进行饲养。试验结束后,将这些动物实施安乐死,并被无害化处理。
1.4 方法
1
.4
.1
体温测量将玻璃水银温度计的前部均匀涂上凡士林以减少犬的不适,旋转入直肠2~3 cm,直到获得稳定的温度读数(约3~5 min)。犬体温由两名独立的实验人员进行测量和读取,以便减少误差。
1
.4
.2
胃肠液pH测定通过外科手术的方法,分别刮取胃、十二指肠、空肠和回肠中的液体置于西林瓶中,将pH测量仪的探针快速插入到西林瓶中进行测量,待仪器读数稳定后记录数值。在两次测量之间需要重新校准pH仪的准确性,并用蒸馏水彻底清洗电极。
1
.4
.3
标准曲线的建立用十万分之一天平精密称取美托洛尔、阿莫西林、氨苄西林、多西环素、地高辛、林可霉素和盐酸洛美沙星各50 mg到50 mL容量瓶中,用色谱级甲醇溶解并定容,配制成1 mg/mL的母液。用移液器分别从中吸取0.125、0.625、1.250、2.500、6.250和12.500 mL的母液到25 mL容量瓶中,再用色谱级甲醇定容至刻度,配制成浓度为5、25、50、100、250和500 μg/mL系列标准液。用0.22 μm有机滤头过滤,取续滤液到进样瓶中,然后经高效液相 (HPLC)检测,色谱条件参考《中国兽药典》2015版。
1
.4
.4
药物计量数(Do
)的计算将过量的阿莫西林、氨苄西林、多西环素、地高辛、林可霉素和盐酸洛美沙星置于含50 mL不同pH(3.0、5.0、6.8、7.6和8.0)缓冲液的烧瓶中,在38.5 ℃恒温水浴震荡器中,以30 r/min的转速震荡24 h后再在38.5 ℃恒温水浴震荡器中静置0.3 h。取上清液并适当稀释,经0.22 μm滤膜过滤后,用HPLC测定药物平衡溶解度,并根据平衡溶解度结果计算各药物的计量数(D
)。式(1)为剂量数(D
)的计算公式:(1)
式中:M
为单次给药的最大剂量,mg;V
为犬胃液体积,mL;C
为药物平衡溶解度,mg/mL。当D
≤1时为高溶解度,当D
>1时为低溶解度。1
.4
.5
在体原位肠灌注(Single-
pass intestinal perfu-
sion, SPIP)试验前12 h禁食,并在前4 h禁水。前肢静脉注射陆眠宁(0.2 mL/kg)将犬麻醉后,置于加热装置上保持38.5 ℃恒温。经手术打开腹腔暴露小肠,结扎胆管以避免肠肝循环。分离出十二指肠、空肠和回肠,每段长约10 cm,并在被测各肠段的近端和远端小心插入两个自制EP套管。用生理盐水轻轻冲洗肠道中内容物,直到液体变澄清为止。近端EP管连接到进口套管,远端连接出口套管,在灌注液与进口管之间放置一个恒流泵控制流速。将空白灌注液在38.5 ℃恒温下泵入肠道约15 min,以清除任何可能残留的异物。然后改换为含药溶液灌注30 min,以便达到肠道吸收稳态。后每隔15 min(15、30、45、60、75、90、105、120、135和150 min)更换一次标有重量的接收瓶。立即离心(10 000 r/min)取上清液,放入-20 ℃冷冻,直到HPLC分析。实验结束时,用饱和氯化钾处死试验犬,剪取并准确测量灌注肠段的长度和直径。实验期间用纱布覆盖手术区域并喷洒生理盐水以保持湿润。在SPIP研究中,以药物在胃肠道中的吸收分数(Fa)来区分其渗透性的高低,当F
≥85%时属于高渗透性,F
<85%为低渗透性。Fa的计算公式如式(2)所示:F
=1-e
-2(2)
式中:An
是吸收常数,代表口服药物吸收的基本变量。其计算公式如式(3)所示:(3)
式中:R
为肠直径,cm;T
为药物在肠内停留时间,min;Peff为药物通过肠壁的有效渗透率,cm/s;渗透性系数结果表示为平均值±标准偏差,SD。P
的计算公式如式(4)所示:(4)
式中:Q
为进口流量,mL/min;C
′为稳态下的修正出口浓度,mg/mL;C
为进入灌注液中的药物浓度,mg/mL。R
、L
分别为肠段直径与长度,cm。C
′的计算公式如下,(5)
式中:C
为在规定时间间隔内测量灌注液中化合物浓度,mg/mL;Ø为在规定时间间隔内测量灌注液出口流量,mL/min。1
.4
.6
灌注液的配制灌注研究中使用的每种药物的浓度是基于溶解在24 mL K-R缓冲液中的最高剂量,所有溶液均是现用现配。其中,美托洛尔分别配制成浓度为4、40和400 μg/mL的灌注液各2份,其中一份用盐酸调节pH至6.8,另一份用KOH溶液调节pH至7.6,所有药液均现用现配。
1.5 数据分析
所有动物试验均为3次平行试验,采用SPPS 24.0软件进行独立t检验和单因素方差分析,分别评估两组和多次比较的差异,数据以平均SD表示。
2 结果与分析
2.1 药物溶解度检测条件的建立
图1和表1分别列出了在禁食与进食两种状态下,比格犬体温和胃肠道pH的变化情况。图1显示,在禁食与进食两种状态下比格犬的直肠温度没有显著差异,平均温度为(38.5±0.5) ℃。从表1中可以看出,胃肠道pH范围为3.8~8.0,平均为6.6。其中胃液pH范围在3.8~5.4,平均pH为4.6;十二指肠、空肠和回肠的pH范围为6.1~8.0,平均pH为7.2。结合比格犬的空腹胃液体积24 mL,可建立一种犬用药物溶解度体外检测模型,即单次给药的最大剂量能溶解在24 mL,pH 3.8~8.0的38.5 ℃水溶液中时被定义为高溶解度,反之为低溶解度。
表1 不同胃肠道部位的pH分析
Table 1 pH analysis in different gastrointestinal tract sites
状态Condition胃Gastric十二指肠Duodenum空肠Jejunum回肠Ileum进食 Feeding3.8±0.76.4±1.17.8±1.07.5±0.6禁食 Fasting5.4±0.86.1±0.47.8±0.77.3±1.2
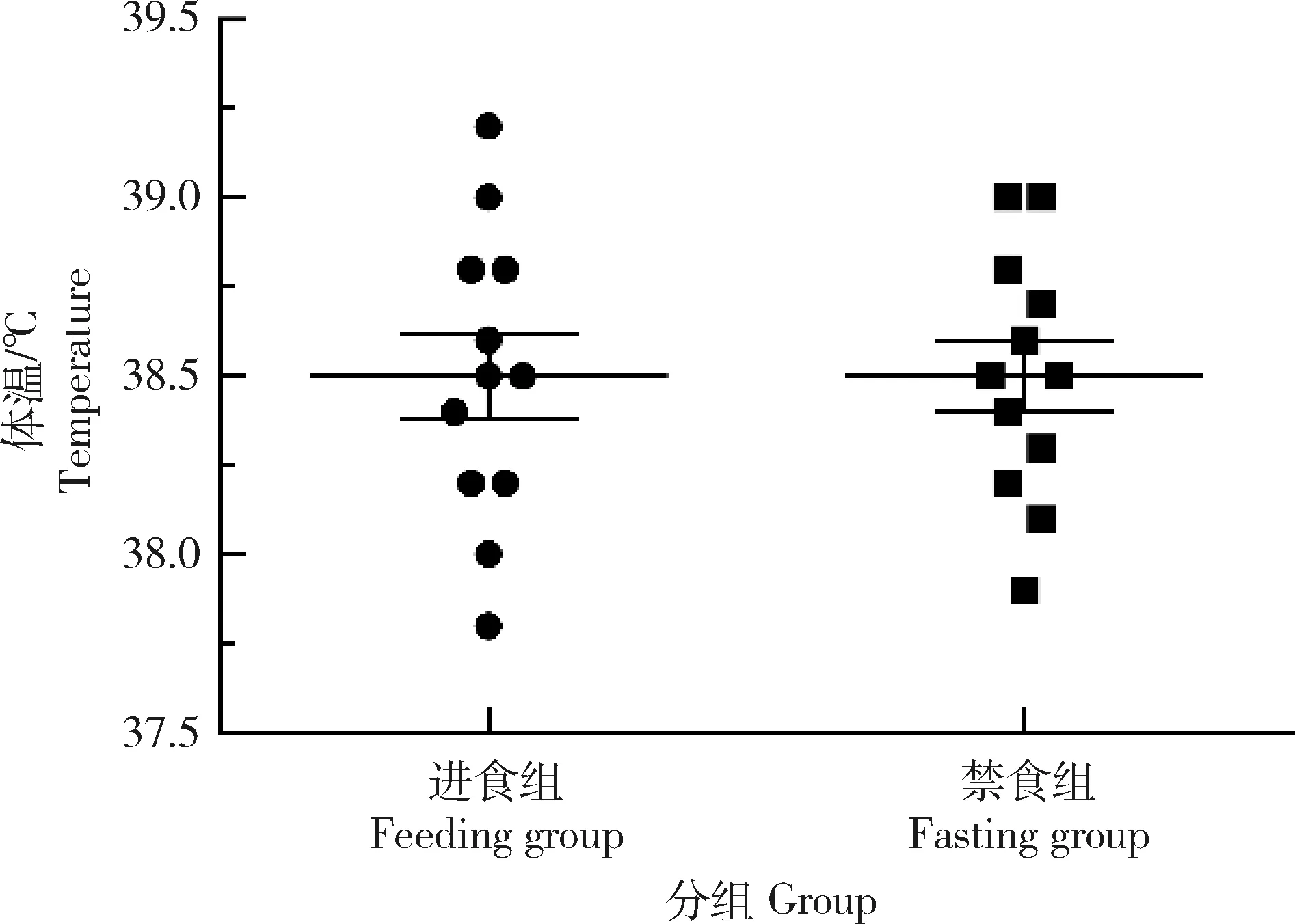
图1 不同饲养条件下比格犬的核心体温Fig.1 Core temperature of Beagles in different feeding conditions
2.2 模型药物的标准曲线
采用HPLC测定模型药物的峰面积,以药物浓度(μg/mL)为横坐标,峰面积(A)为纵坐标绘制标准曲线。表2中是7种模型药物的标准曲线,R表明药物浓度与峰面积之间有良好的线性关系。
表2 模型药物的标准曲线
Table 2 The standard curve of model drugs
药物Drug标准曲线方程Standard curve equation相关系数R2Correlation coefficient阿莫西林 AmoxicillinY=257.73X+9.060.999 9氨苄西林 AmpicillinY=917.31X+5.390.999 9多西环素 DoxycyclineY=449.12X+2.710.999 9地高辛 DigoxinY=188.18X-0.640.999 9林可霉素 LincomycinY=380.59X+3.430.999 9盐酸洛美沙星 Lomefloxacin hydrochlorideY=894.07X-81.490.999 6美托洛尔 MetoprololY=448.68X-0.120.999 8
2.3 药物溶解度分类
模型药物的平衡溶解度测定结果见表3,其中氨苄西林、盐酸洛美沙星和美托洛尔受溶液pH影响较大,其他药物没有明显的变化。根据药物平衡溶解度结果,以最低平衡溶解度为条件对模型药物的计量数Do
进行了分类,结果见表4。其中阿莫西林、多西环素、地高辛被分为低溶解度,氨苄西林、林可霉素、盐酸洛美沙星和美托洛尔被分为高溶解度。表3 药物在不同pH下的平衡溶解度
Table 3 Equilibrium solubility of drugs at different pH values
药物DrugpH 3.0pH 5.0pH 6.8pH 7.6pH 8.0阿莫西林 Amoxicillin3.403.503.413.663.56氨苄西林 Ampicillin13.1812.6310.0011.5412.99多西环素 Doxycycline0.510.570.520.600.59地高辛 Digoxin///0.060.09林可霉素 Lincomycin38.2039.0138.0040.2040.23盐酸洛美沙星 Lomefloxacin hydrochloride15.6415.7315.6020.3528.06美托洛尔 Metoprolol32.7528.8316.1118.7619.03
2.4 美托洛尔在犬肠道中的渗透性
在不同生理pH下,美托洛尔在小肠各区域段渗透性见图2和表5。图中显示,美托洛尔(400 μg/mL)在小肠各段中的渗透性大小依次为:十二指肠>回肠>空肠,其中在十二指肠中的渗透性约是空肠中的1.4倍,表明该药物的吸收依赖于肠道不同的部位。为了确定pH对美托洛尔渗透性的影响,在2个pH条件下(pH 6.8和7.6)分别测定了美托洛尔的Peff值。实验表明,pH增加虽然会促进美托洛尔的吸收,但对在十二指肠、空肠和回肠中的通透性并没有显著影响(P
=0.86)。表4显示了在pH 6.8时,美托洛尔在小肠各区域段的吸收分数与Peff值一致,其Fa值均大于0.85,渗透性分类均属于高渗透性。表4 药物溶解度分类
Table 4 Solubility classification of drugs
药物Drug剂量/mgDoes溶解度/(mg/mL)Solubility计量数Does numberBCS分类BCS classification阿莫西林 Amoxicillin110 3.401.35低氨苄西林 Ampicillin11010 0.46高多西环素 Doxycycline100 0.518.17低地高辛 Digoxin10 0.066.94低林可霉素 Lincomycin22038.000.24高盐酸洛美沙星 Lomefloxacin hydrochloride11015.600.29高美托洛尔 Metoprolol12516.110.32高
表5 美托洛尔在不同肠道部位的吸收分数
Table 5 Absorption fraction of metoprolol in different intestinal sites
肠道部位Intestinal site有效渗透率/(×10-4 cm/s)Effective permeability吸收分数/%Absorption fraction渗透性Permeability十二指肠 Duodenum1.45±0.1795高空肠 Jejunum1.05±0.1586高回肠 Ileum1.18±0.3290高
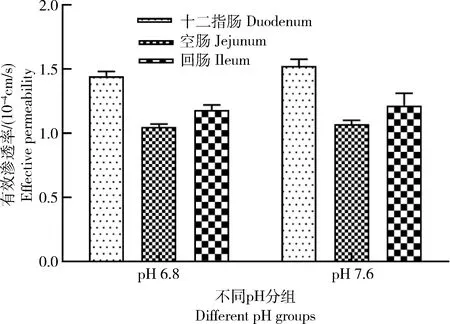
图2 美托洛尔在不同肠段和不同pH下的有效渗透率Fig.2 Effective permeability values of metoprolol in different intestinal segments and pH
使用不同浓度 (4、40和400 μg/mL) 的美托洛尔在空肠进行原位灌注,其Peff值见图3。图中结果显示,药物在中低浓度灌注后的Peff值约是高浓度时的1.6和1.7倍,表明低中浓度的吸收效果较高浓度时更好。各组中美托洛尔的Peff值差异无统计学意义(P
=0.31)。综上研究表明,美托洛尔可以作为犬用药物渗透性分类的边界性药物使用。
图3 不同浓度下美托洛尔的渗透性Fig.3 Permeability of metoprolol at different concentrations
2.5 模型药物的渗透性
使用SPIP方法检测了7种犬用临床常见药物的肠道渗透性,以美托洛尔为边界性药物进行了渗透性高低的分类,结果见表5。其中多西环素、地高辛与美托洛尔被分类为高渗透性,而阿莫西林、氨苄西林、林可霉素与盐酸洛美沙星被分类为低渗透性。
2.6 模型药物的生物药剂学分类
根据药物溶解度与肠道渗透性研究,对7种模型药物进行生物药剂学 (BCS)分类,如图4所示。在所有药物中,美托洛尔被分为Class 1类,多西环素和地高辛被分为Class 2类,氨苄西林、林可霉素、盐酸洛美沙星被分为Class 3类,阿莫西林被分为Class 4类。
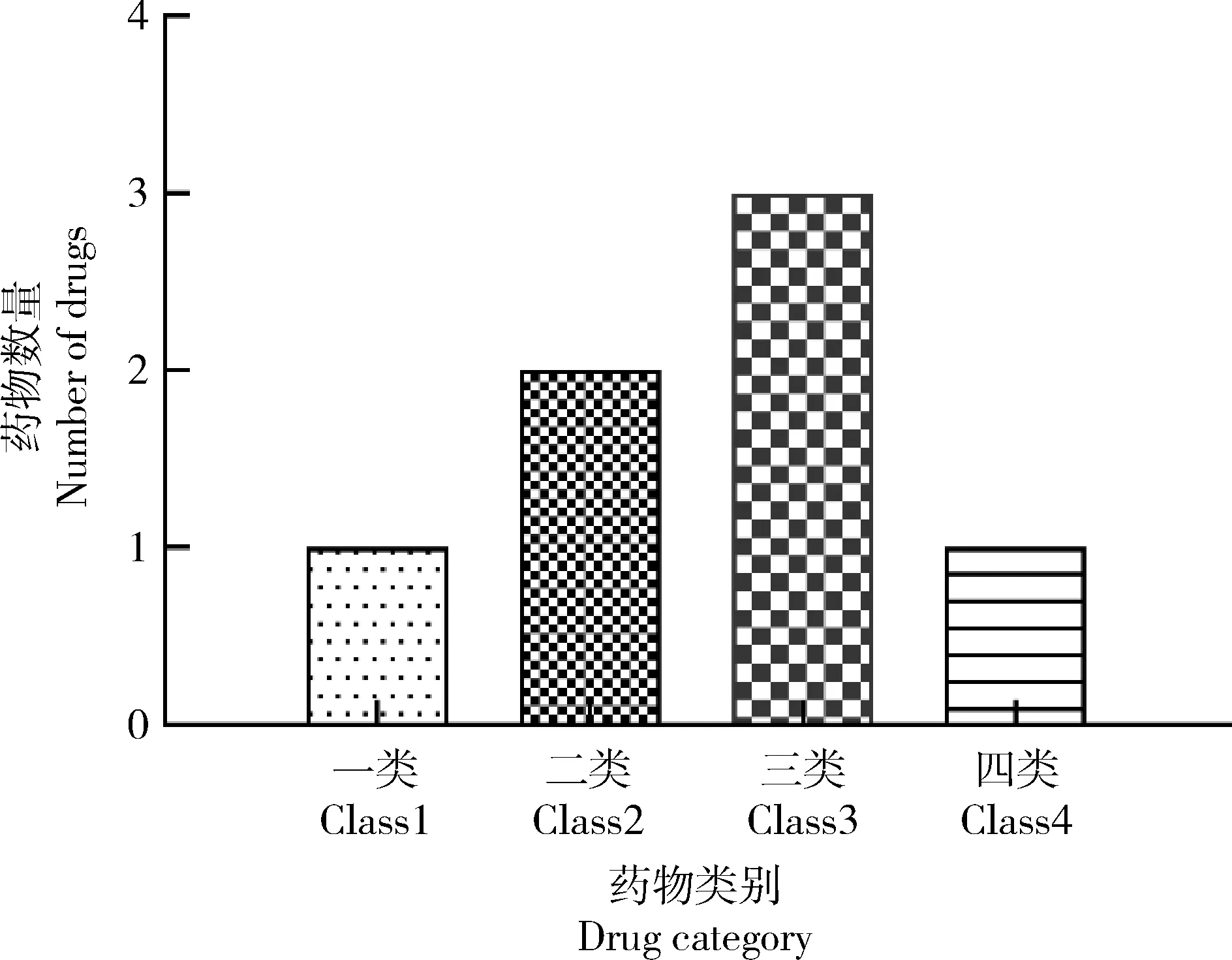
图4 模型药物的生物药剂学分类Fig.4 Biopharmaceutics classification of model drugs
3 讨 论
测定药物溶解度并建立适用的溶解度条件对于犬用药物生物药剂学分类系统(BCS)的开发是至关重要的,也是检测药物在肠道内渗透性高低的前提。目前药物溶解度的测定条件是基于人胃肠道(GI)生理学而不是犬,因此,为获取专属溶解度检测方法必须根据犬胃肠道生理参数对现有BCS溶解度标准进行调整。
温度是影响溶解度的重要因素,药物溶解度往往会随着温度的变化而改变。与人类(37 ℃)、猪(39 ℃)和鸡(41 ℃)显著不同,本研究结果显示犬体温是38.5 ℃。在此条件下测得的7种模型药物的溶解度均高于兽药典(25±2 ℃)中的数据记录,这与Liu等在研究吡喹酮等鸡用药物溶解度时的发现是一致的。此外,由于犬胃液中的基础pH变化很大,为确定影响药物溶解度的pH范围,也为排除因小肠pH远高于胃而出现药物在小肠析出等现象。本研究分别测定了犬进食前后胃肠道(GI)的pH变化,得到GI的pH范围是3.8~8.0,这与Dressman等研究的犬因基础胃酸分泌量较低而导致胃肠道pH偏高的现象相吻合,同时也填补了Papich等在研究犬用药物溶解度时缺少胃肠道pH范围的空白。此外,研究显示犬胃液拥有比人更高的pH,这可能是导致多西环素、地高辛和盐酸洛美沙星的溶解度变化更大的原因。考虑到影响药物在犬体内溶解度的pH范围,使用与人用药物溶解度定义相同的犬用药物的pH溶解度条件似乎是合适的。
表6 模型药物的渗透性分析
Table 6 Permeability analysis of model drugs
药物Drug有效渗透率/(×10-4 cm/s)Effective permeability标准差Standarddeviation (SD)渗透性分类Permeabilityclassification阿莫西林 Amoxicillin0.480.05低氨苄西林 Ampicillin0.620.21低多西环素 Doxycycline2.760.53高地高辛 Digoxin1.430.26高林可霉素 Lincomycin0.220.08低盐酸洛美沙星 Lomefloxacin hydrochloride0.720.15低美托洛尔 Metoprolol1.050.33高
当试图建立犬特异性BCS时面临的另一个障碍是与肠道渗透性(Peff)分类相关的挑战。尽管有如Caco-2细胞、平行人工膜通透性试验(PAMPA)和基于磷脂囊泡的通透性试验(PVPA)可用于预测Peff,但这些估算方法仅适用于人用药物,因为没有类似于人用BCS高渗透性或低渗透性分类的边界性药物(拉贝洛尔、美托洛尔、甘露醇等)的Peff来评估狗体内的有效渗透性。虽然利用药物的logP或绝对生物利用度(F)有时可预测到药物的渗透性大小,但这往往是那些已知的通过被动扩散以外的机制而被吸收的化合物(如通过转运体或细胞旁路转运)。基于此,本研究以美托洛尔作为犬用药物渗透性分类的边界性药物。研究结果表明,美托洛尔在空肠和回肠中的吸收率相似,在十二指肠中的渗透率约为空肠的1.4倍,且pH和其自身浓度变化对吸收没有显著影响,这表明美托洛尔在犬胃肠道中的吸收过程与人体内相似。此外,美托洛尔在小肠不同部位的吸收分数(Fa)均大于85%,这表明美托洛尔暂时作为犬用药物渗透性分类的标准药物是合理的。需要进一步说明的是,使用绝对生物利用度(F)作为渗透性标准是不合适的,因为肠道壁和肝脏代谢的影响以及膜内流入和流出转运蛋白活性可能会引入偏差。而吸收分数(Fa)作为渗透性标准已被广泛承认,其正确性优于绝对生物利用度。为证明BCS渗透分类方法的适用性,本研究对7种犬临床常用药物为模型进行了检测,并分别以美托洛尔的Peff值和Do
作为渗透性和溶解度指标进行初步的BCS分类。结果显示,7种药物均被正确分类。尽管本研究使用的方法存在局限性,但评估结果强烈表明,美托洛尔暂时作为犬用药物渗透性分类的边界性药物是合适的。诚然,在初步建立的BCS分类系统的基础上,为提高对犬用药物分类的准确性,还有很多工作要做。应用BCS预测药物吸收依赖于广泛的变量,除配方因素和胃肠生理因素外,还需考虑腔内和粘膜酶反应、肠道运动、药物首过作用和转运蛋白活性等影响。此外,比格犬作为标准的中型犬被用于本试验,根据其生理特性建立的BCS分类系统是否适用于小型犬和大型犬还有待于研究。正因为如此,在后续BCS分类系统的开发中,应建立对应的体外预测模型,并结合体内数据进行体内外相关性分析,建立相关数据库。通过这些努力,将获得更好的评价决定体内药物吸收的关键因素,并确定潜在的错误来源,以支持BCS在药物开发及临床应用上的指导作用。
综上所述,根据药物溶解度条件和渗透性方法建立的犬用药物BCS分类系统,不仅填补了该系统在犬用药物领域的空白,也为其他物种BCS分类系统的开发和建立提供了参考。将BCS应用于兽药研发,不仅可以预测和优化药物的临床性能,而且有助于避免额外的体内研究,显著减少开发药物产品的成本和时间。

